茶籽皂苷对链脲佐菌素诱导的糖尿病大鼠血糖的影响
刘芷君,林 玲,雷郑延,曾文治,程福建,林全女,杨江帆
(福建农林大学园艺学院,茶学福建省高校重点实验室,福建 福州 350002)
随着社会经济的飞速发展和人民生活水平的显著提高,糖尿病患者的数量在中国也不断增多。据国际糖尿病联盟统计,2017年全球糖尿病患者已达4.25亿 人,其中我国糖尿病患者人数约达1.1亿 人,在目前全球糖尿病患者数量排名中位居首位[1]。预计到2045年,将会有6.93亿的18~99 岁人群,或6.29亿的20~79 岁人群患有糖尿病[2]。目前市场上治疗糖尿病的主流药物有11 种,它们虽然能较好地抑制病情恶化,却会引起一系列的不良反应[3-4]。近几年人体和动物实验表明,许多人们普遍正在消费的茶叶及其部分生化成分具有较好的降血糖效果[5]。
茶籽皂苷又称茶籽皂素,是1931年由日本学者青山新次郎从茶树种子中分离出来的一类齐墩果烷型五环三萜类的混合物,以其抗菌[6]、抗病毒[7]、消炎、抗氧化[8]等多种生物学活性而被广泛研究应用,主要集中在其化学结构及生物活性等方面,以细胞实验为主。
当前茶叶作为一种天然降血糖材料已经被国内外学者广泛关注,其降血糖的机制可归纳为以下几个方面:1)抑制α-葡萄糖苷酶活性,延缓葡萄糖吸收;2)改善糖代谢相关酶活性;3)调节自身免疫,清除自由基,防止脂质过氧化;4)改善胰岛细胞形态和功能,促进胰岛素分泌;5)提高胰岛素敏感性;6)改善糖代谢,促进肝脏、肌肉等外周组织和靶器官对糖的利用;7)抑制小肠内葡萄糖运转载体SGLT-1的活性,延缓糖的吸收[9-12]。但在众多茶叶生化成分降糖功效的研究中,茶籽皂苷降血糖功效的研究还鲜见报道。
因此,本实验选用茶籽皂苷作为原材料,设置3 个不同浓度梯度干预链脲佐菌素(streptozocin,STZ)诱导的糖尿病模型大鼠,通过检测血糖、血脂水平、肝功能等指标,系统评估茶籽皂苷对糖尿病大鼠血糖水平的影响,以期检验茶籽皂苷是否具有调节血糖水平的功能。
1 材料与方法
1.1 动物、材料与试剂
SPF级成年雄性健康Wistar大鼠,共60 只,体质量(200±20)g,由上海斯莱克实验有限责任公司提供,生产许可证号:SCXK(沪)2012-0002,于福建中医药大学实验动物中心SPF级屏障动物实验室饲养(医动字23-016号),使用许可证号:SYXK(闽)2012-001。室温22~26 ℃,相对湿度40%~70%,分笼饲养,每笼5 只。明暗交替条件为12 h/12 h。固定时间添加足量饲料与饮水,高脂高糖饲料采购于北京博爱港商贸有限公司,配方如下:66.5%大小鼠维持饲料+10%猪油+20%蔗糖+2.5%胆固醇+1%胆酸钠。
茶籽皂苷(含量及相关指标见表1) 湖南汉清生物技术有限公司;STZ(纯度≥99%) 北京博爱港商贸有限公司;盐酸二甲双胍片 白云山汤阴东泰药业有限责任公司;水合氯醛(分析纯) 阿拉丁试剂(上海)有限公司;4%多聚甲醛通用型组织固定液 合肥白鲨生物科技有限公司。

表1 茶籽皂苷的质量分数及相关指标Table 1 Purity and water content of commercial theasaponin used in this study and pH of its aqueous solution
1.2 仪器与设备
JCS-W型电子天平 哈尔滨众汇衡器有限公司;血糖测试仪 三诺生物传感技术股份有限公司;KDC-2046低速冷冻离心机 安徽中科中佳科学仪器有限公司;7180全自动生化分析仪 日本日立公司。
1.3 方法
1.3.1 2型糖尿病模型的建立及分组
大鼠分笼饲养,普通饲料适应性喂养1 周。除正常组大鼠外均高脂高糖饲料喂养4 周后禁食12 h,将STZ在冰浴条件下,溶于0. 1 mol /L柠檬酸和柠檬酸钠试剂缓冲液(pH 4.2~4.5),参考林心君等[13]体质量联合体表面积法的糖尿病大鼠造模方法,尾静脉注射STZ溶液。72 h后测定血糖浓度,以空腹血糖浓度不低于11.1 mmol/L且伴随表现出“三多一少”、毛色暗淡、运动量减少等特征为糖尿病大鼠造模成功。将造模成功的大鼠随机分为5 组:阴性对照组(模型组)、阳性对照组、高剂量组、中剂量组、低剂量组。
1.3.2 日常饲养与灌胃给药方法
将茶籽皂苷与二甲双胍溶于5%羧甲基纤维素钠配制成溶液后进行灌胃。正常组以基础饲料喂养,并灌胃1 mL 5%羧甲基纤维素钠溶液,无其他药物干预;模型组喂饲高糖高脂饲料,并灌胃1 mL质量分数5%羧甲基纤维素钠溶液,无其他药物干预;阳性对照组喂饲高糖高脂饲料,以200 mg/(kgmb·d)剂量灌胃二甲双胍;高、中、低剂量治疗组饲喂高糖高脂饲料,茶籽皂苷灌胃剂量分别为150、100、50 mg/(kgmb·d)。日常饲养期间自由饮水摄食,6 组实验组的大鼠每日按时以灌胃的方式给药,共需灌胃40 d。
1.3.3 日常观察指标
在实验的过程中,每日观察动物精神状态、活动情况及毛色光泽度等,每周定量测定进食量及体质量,观察其体质量的变化。
1.3.4 空腹血糖值的测定及口服葡萄糖耐受实验
将大鼠禁食不禁水6 h后,以尾静脉取血的方式测定大鼠给药前、给药10、20、30、40 d后的空腹血糖值。实验即将结束时,将所有大鼠禁食不禁水12 h后给大鼠灌胃葡萄糖1.5 g/(kgmb·d),之后测定各组大鼠喂饲葡萄糖后0、30、60、120 min的血糖值(分别记为FBG0、FBG30、FBG60、FBG120,单位为mmol/L)。按下式计算血糖曲线下面积(area under curve,AUC)[14]。
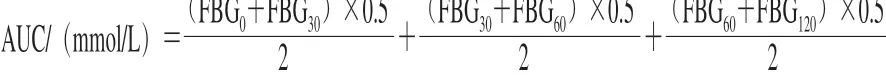
1.3.5 血清指标测定
给药40 d后,结束灌胃。空腹12 h,在消毒的情况下,大鼠腹腔注射10%水合氯醛(2 mL/(kgmb·d))进行麻醉,腹主动脉取血,常温静置30 min后,放到低速冷冻离心机,4 ℃离心,取上层血清。委托福建中医药大学附属第三人民医院采用全自动生化仪测定甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白-胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白-胆固醇(high-density lipoprotein cholesterol,HDL-C)水平及肝功能指标天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)的活力。
1.3.6 病理组织学观察
每组大鼠采血后,快速取肝脏、胰腺,分别剪取部分组织用4%多聚甲醛磷酸盐缓冲液固定,进行苏木精-伊红(hematoxylin-eosin,HE)染色,通过光学显微镜观察肝脏与胰腺的变化。
1.4 数据统计分析
采用SPSS 19.0软件对实验数据进行分析,结果均用±s表示,以单因素方差分析法比较两组间差异显著性。
2 结果与分析
2.1 一般日常观察及体质量变化
实验期间,大鼠的精神状态保持良好,具有较强的行动力。正常组的大鼠皮毛光滑,实验前后进食量、饮水量几乎不变,体质量呈上升趋势。模型组大鼠精神萎靡,呈现明显的多食、多饮和多尿等症状,皮毛暗淡无光部分呈浅褐色,体质量下降幅度较大。阳性对照组(二甲双胍)及茶籽皂苷组在灌胃一段时间后,皮毛的光泽度提升,活动正常且体质量下降幅度减少,后期体质量呈现一定程度的回升,以高剂量组效果较为明显(图1)。实验期间各组均未出现实验动物非正常死亡。
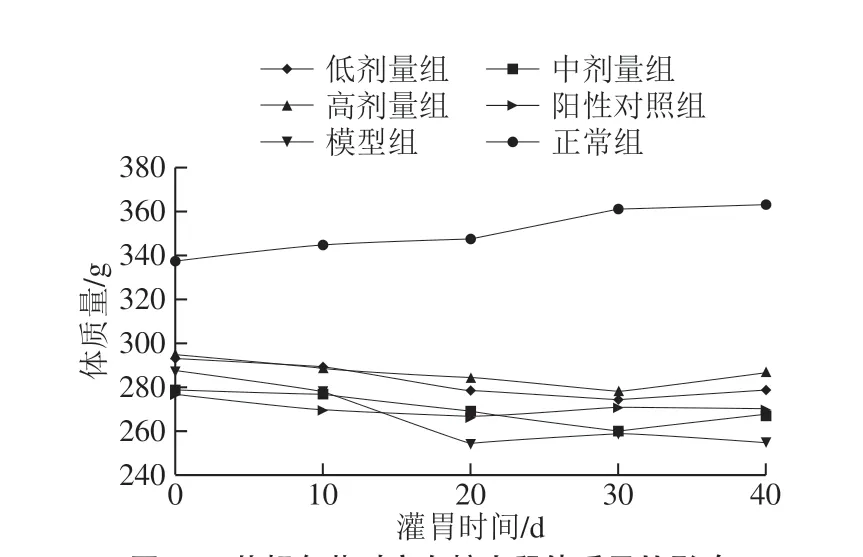
图1 茶籽皂苷对高血糖大鼠体质量的影响Fig. 1 Effect of theasaponin on body mass of hyperglycemic rats
2.2 茶籽皂苷对糖尿病大鼠空腹血糖的影响
血糖水平升高是2型糖尿病的主要特征之一,其症状体现为持续的血糖水平升高,并会在一定程度上导致机体糖代谢紊乱,产生糖毒性[15],血糖值侧面反映了胰岛β细胞对胰岛素的分泌功能[16]。
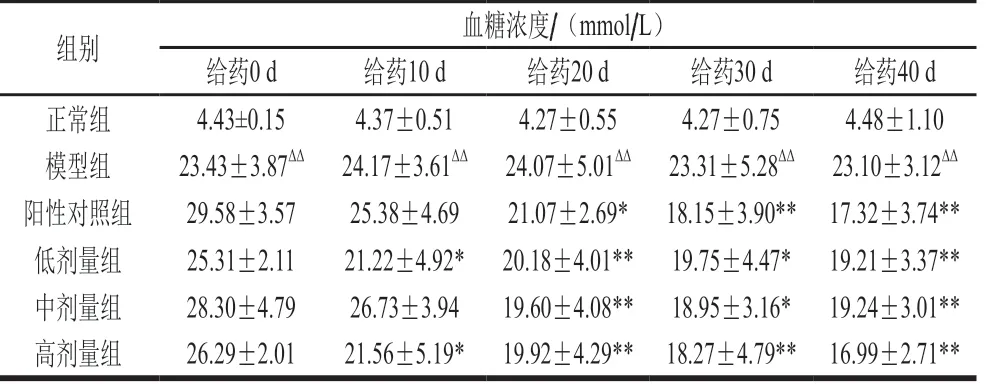
表2 茶籽皂苷对糖尿病大鼠血糖的影响Table 2 Effect of theasaponin on blood glucose of diabetic rats
由表2可知,不同时期,正常组大鼠与模型组大鼠血糖浓度波动范围较小,血糖浓度较为稳定。而阳性对照组及各剂量组大鼠血糖浓度变化较为显著,其中阳性对照组大鼠血糖浓度变化范围最大,降幅达41.46%;高、中、低剂量组大鼠也都呈现出一定降低血糖浓度的效果,且血糖浓度波动幅度与给药浓度呈正相关。综上,降低空腹血糖浓度的效果为:阳性对照组>高剂量组>中剂量组>低剂量组>模型组,且经过茶籽皂苷干预40 d的糖尿病大鼠血糖浓度与模型组呈现极显著差异(P<0.01),茶皂苷中、高剂量灌胃后的糖尿病大鼠血糖降幅高于低剂量,但中、高剂量组间差异不大。
2.3 茶籽皂苷对糖尿病大鼠糖耐量的影响
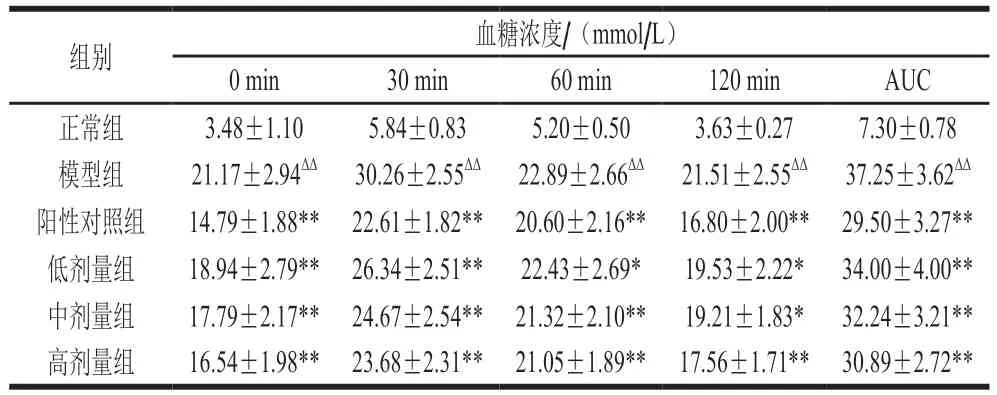
表3 茶籽皂苷对糖尿病大鼠糖耐量的影响Table 3 Effect of theasaponin on glucose tolerance of diabetic rats
糖耐量即对葡萄糖的耐受能力,通过对糖耐量的检测,可以了解机体对糖的吸收利用水平。由于机体内需要对葡萄糖进行代谢贮存,因此正常情况下服用一定量葡萄糖后,血糖浓度会先升高随后在一定时间内恢复到空腹水平[17]。若服糖120 min后机体血糖浓度仍然保持较高水平,说明糖耐量能力降低,即对糖的吸收利用率低于正常人[18]。此外,AUC也常被应用于反映人体利用和清除葡萄糖的程度,其值增大说明机体糖耐量能力下降,反之则能力升高[19]。
由表3可知,给药40 d后,阳性对照组与茶籽皂苷组显示出较好的降低糖尿病大鼠空腹血糖浓度的作用(P<0.01)。在给药第38天时检测实验性大鼠糖耐量,结果表明,模型组大鼠在糖负荷0、30、60、120 min后的血糖浓度显著高于正常组糖负荷后血糖浓度,糖尿病大鼠血糖值在前30 min间快速升高,并达到峰值,随后缓慢下降,在120 min时接近起始值,该时刻茶籽皂苷低、中剂量组大鼠血糖浓度与模型组大鼠血糖浓度呈现显著性差异(P<0.05),茶籽皂苷高剂量组、阳性对照组与模型组大鼠血糖浓度差异极显著(P<0.01)。其中模型组AUC最大,茶籽皂苷组的AUC与茶籽皂苷浓度成反比,且阳性对照组和茶籽皂苷组的AUC与模型组呈现出极显著的差异(P<0.01)。
2.4 茶籽皂苷对糖尿病大鼠血脂的影响
血脂是人体血浆中产生沉积的脂类物质,一般可概括为:三酰甘油、胆固醇、β-脂蛋白、磷脂和游离脂肪酸等[20],血脂的变化可以反映出体内脂质代谢的情况[21]。而脂蛋白是指与脂类结合在一起的蛋白质[22],其中LDL-C是将肝脏合成的胆固醇转运到全身组织的主要形式,因此LDL-C浓度增高必然伴随胆固醇总量的增高;HDL-C颗粒较小,蛋白质含量最高,胆固醇浓度会随着HDL-C的减少而增高[23]。

表4 茶籽皂苷对糖尿病大鼠血脂的影响Table 4 Effect of theasaponin on blood lipids of diabetic rats
由表4可知,给药40 d后,与正常组对比,模型组的大鼠TC、TG、HDL-C浓度均极显著升高(P<0.01),LDL-C浓度下降,这证明糖尿病大鼠已经出现了脂代谢紊乱的情况。对比模型组,茶籽皂苷各剂量组空腹TC、TG、HDL-C浓度呈现出极显著差异(P<0.01),LDL-C浓度随茶籽皂苷浓度增加而呈现下降趋势,说明茶籽皂苷对糖尿病大鼠的脂代谢紊乱具有较好的调节作用。研究发现,正常组大鼠血清HDL-C浓度最低,推测可能是因为正常组的大鼠在动物房笼内活动量少造成肥胖,造成正常组大鼠血清HDL-C浓度下降,而模型组的LDL-C浓度最低,推测是因为模型组大鼠后期体质量下降,因此造成血清LDL-C浓度下降。
2.5 茶籽皂苷对糖尿病大鼠肝功能的影响
肝脏作为调节血糖最重要的器官,肝功能在糖尿病治疗中的作用正被更多的人关注[24]。AST、ALT是反映肝脏功能的关键指标,可以一定程度上反映肝细胞受损情况及损伤程度。

表5 茶籽皂苷对糖尿病大鼠血清AST、ALT活力的影响Table 5 Effect of theasaponin on serum AST and ALT activities of diabetic rats
如表5所示,模型组AST与ALT活力最高,与其他组呈极显著差异(P<0.01);除正常组外,高剂量组与阳性对照组活力最低,且AST、ALT的活力随茶籽皂苷灌胃浓度的升高而呈下降趋势。说明茶籽皂苷高、中、低剂量组与阳性对照组能很好地降低糖尿病大鼠AST、ALT的活力。模型组AST、ALT活力的比值与正常组呈现极显著差异(P<0.01),但与阳性对照组及各剂量组差异不显著。
2.6 病理学组织切片观察结果
茶籽皂苷具有一定溶血作用和鱼毒活性[25],重点观察灌胃茶籽皂苷各组动物解剖组织切片结果,对比模型组,动物内脏均未出现较为严重的损伤情况,说明茶籽皂苷在所灌胃的剂量范围(50~150 mg/(kgmb·d))内对动物是安全的。

图2 茶籽皂苷对糖尿病大鼠肝细胞形态的影响(×400)Fig. 2 Effect of theasaponin on liver cell morphology in diabetic rats (× 400)
如图2所示,正常组大鼠肝组织正常,细胞核完整,大小均匀,排列整齐,且结构轮廓清晰。模型组大鼠肝细胞完整性差,大部分细胞呈溶解状态,结构轮廓模糊,有细胞核减少、肝细胞肿胀现象。通过灌胃茶籽皂苷后的大鼠肝组织切片细胞完整性好,细胞边缘轮廓较清晰,细胞及细胞核数量增多,且较少出现肿胀迹象,从图2C中可以看出细胞溶解现象得到了改善。
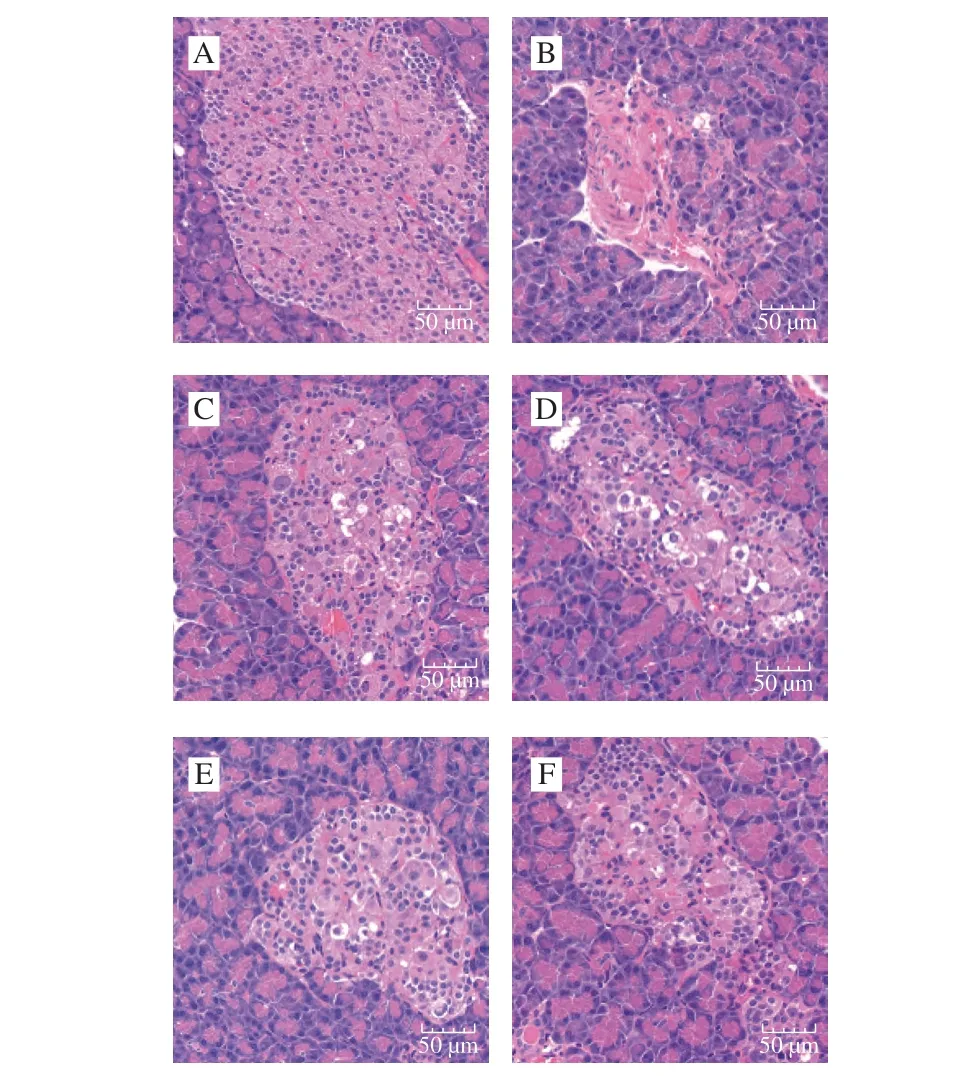
图3 茶籽皂苷对糖尿病大鼠胰岛组织形态的影响(×400)Fig. 3 Effect of theasaponin on pancreatic islet morphology in diabetic rats (× 400)
胰岛细胞为胰腺的内分泌细胞,分布于腺泡之间。如图3所示,正常组大鼠外分泌腺中腺泡细胞的结构正常,大小适中,细胞数量较多,内分泌区域的胰岛外观完整(图3A)。模型组大鼠胰岛萎缩,β细胞数量减少,部分出现空泡化、分布不均。茶籽皂苷组与阳性对照组岛内β细胞破坏较小,均不同程度地改善了胰岛内的分布、细胞形态、染色颗粒分布,胰岛β细胞染色颗粒数量增多并排列成团,较模型组细胞边缘结构更清晰,空泡化减少(图3C)。
3 讨 论
2型糖尿病作为遗传因素和环境因素共同作用而形成的多基因遗传性疾病,是一种复杂的异质性糖代谢性疾病,可引起多器官或组织功能失调[26],且发病率逐年升高。而在生物活性成分降血糖研究中,以STZ诱导的糖尿病模型大鼠型最为常用。STZ会使得胰岛β细胞功能受损、胰岛素合成减少,从而引发糖尿病[27]。与此同时,由于血糖水平升高而导致的机体脂质代谢紊乱也会加重胰岛β细胞损伤,导致病情持续恶化。
本研究结果表明, 适当剂量的茶籽皂苷(50~150 mg/(kg mb·d))能有效降低STZ诱导的糖尿病大鼠的空腹血糖水平、调节糖脂代谢、增强其葡萄糖耐受程度,且其效果与剂量成正比。该结果与吉川雅之等[28]对茶花抑制血糖水平的研究结论一致。研究发现,正常组大鼠血清HDL-C浓度偏低,而模型组的LDL-C浓度偏低,已有研究表明体质量的过高会导致HDL-C浓度的降低[29],体质量过低的机体LDL-C浓度会低于体质量正常的机体[30],因此推测是因为正常组、模型组大鼠后期体质量的变化,造成血清HDL-C、LDL-C浓度的异常,其变化机制还有待进一步验证。
胰腺内胰岛中央区的β细胞是胰岛素表达的主要场所[31]。虽然目前2型糖尿病的发病机制尚未完全明确,但经过前人的研究发现2型糖尿病的发病因素与胰岛素抵抗和胰岛β细胞受损有密切关系[26]。本研究采用HE染色法观察糖尿病大鼠胰岛组织形态,结果显示,茶籽皂苷可使STZ诱导的糖尿病大鼠胰岛细胞破坏、空泡化现象得到改善。
肝脏作为调节血糖浓度的主要器官,参与糖的代谢过程[32]。本研究结果显示,茶籽皂苷可以降低糖尿病大鼠体内ASL、ALT活性,同时能修复大鼠肝脏细胞溶解现象,使得肝脏细胞边缘轮廓清晰,细胞核数量增多。这一结果表明,茶籽皂苷能兼顾有效护肝,使其发挥血糖调节功能,目前该作用机理仍有待进一步研究检验。
茶籽皂苷由苷元和糖组成,苷元为齐墩果烷型,糖链结构和链接位置的不同导致这些化合物具有不同的药理活性。3位糖苷键普遍被认为是齐墩果烷型皂苷具有抗肿瘤、降血糖等药理作用的活性部位[33],据已有研究显示,茶籽皂苷的糖苷键链接在3位取代基上[34]。当前关于皂苷降血糖的研究主要集中在达玛烷型皂苷,且对人参、西洋参、三七和绞股蓝等中的达玛烷型皂苷降血糖方面的研究较为成熟[35],对齐墩果烷型皂苷降血糖功效研究较少。研究表明其抑制血糖水平上升的作用机理与根皮苷类似[36]。能通过抑制小肠对糖的吸收,从而提高糖尿病2型病人的葡萄糖耐量[37]。因此本研究下一步将对其具体作用部位和机理进行探讨。
综上所述,本研究结果显示长期适当剂量的茶籽皂苷(50~150 mg/(kg mb·d))干预可以有效调节糖尿病大鼠的血糖水平。茶籽皂苷可以通过修复胰岛损伤、肝脏损伤,调节糖尿病大鼠糖脂代谢、改善葡萄糖耐受。在化学制品主导的降血糖药物市场,茶籽皂苷因其所具备的护肝降糖效应,有望为糖尿病患者提供安全有效的护肝降糖辅助治疗选择。

