三水磷酸氢镁合成小试研究
吕福喜,刘素芹,杨玉霄,王 丹
(天津中盐海晶投资咨询有限公司,天津 300450)
磷酸氢镁主要有无水、三水和七水三种水合物,其中三水磷酸氢镁为无色或白色斜方晶体或粉末,微溶于水,易溶于稀酸,不溶于乙醇,相对密度2.013,加热至205 ℃时,脱去1分子结晶水。加热至550 ℃~650 ℃时分解成焦磷酸盐。
在医药上用作变质剂和制造治疗风湿性关节炎的药物。食品行业用于营养增补剂、pH值调节剂、抗结剂、稳定剂。用于包装材料增塑剂。化肥碳酸氢铵的稳定剂。牙膏添加剂,也用作饲料添加剂和肥料[1]。
在城市及工业污水水处理中被用作化学沉淀剂,用来去除浓度较高的水体富营养化污染源——氨氮[2]。
在实验中,采用天津长芦海晶集团第三分公司的浓厚卤进行净化处理得到的晶体氯化镁为原料,最后得到三水磷酸氢镁产品,摸索出较佳的工艺参数。实验全过程均无有毒有害物质,属于绿色环保的生产工艺。
1 实验部分
1.1 实验装置与流程
实验使用的原料为天津长芦海晶集团有限公司的浓厚卤处理后得到的晶体氯化镁,用其与磷酸氢二钠的水溶液进行反应,主要实验设备见表1。
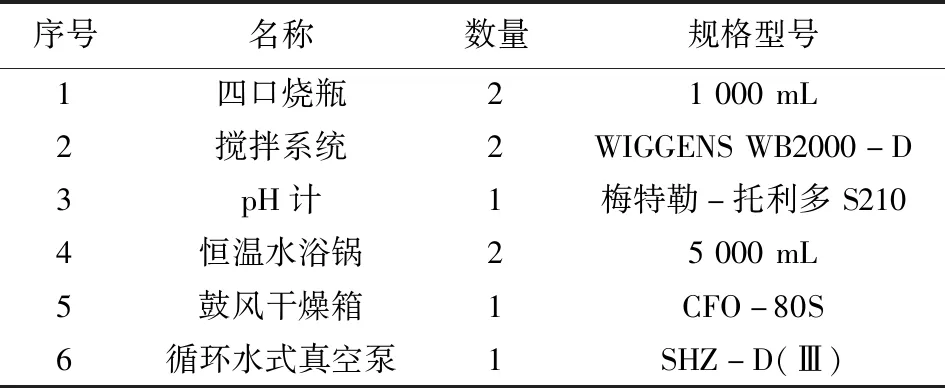
表1 主要实验设备Tab.1 Main experimental equipment
实验装置示意图如图1所示。
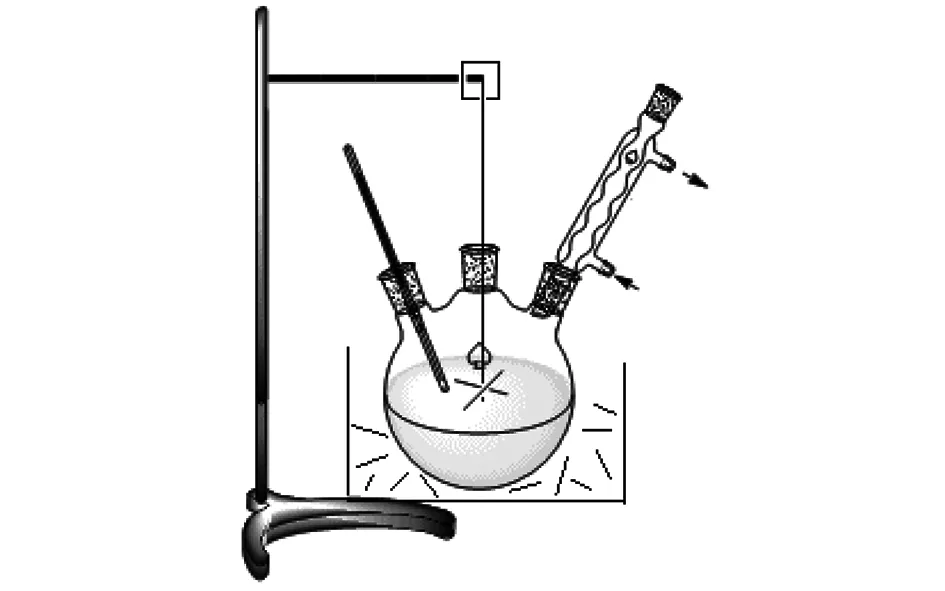
图1 实验装置示意图Fig.1 Schematic diagram of experimental device
具体步骤为利用晶体氯化镁为原料,将六水合氯化镁溶液与十二水合磷酸氢二钠溶液混合后,在67 ℃的水浴上加热熟化2 d,即可制得三水合磷酸氢镁。将产品进行灼烧后,对含量、灼烧失重进行检测分析。
1.1.1 反应温度的规律研究
根据文献记载,磷酸氢二钠与氯化镁水溶液反应温度需要控制在65 ℃以上,才能结晶析出三水磷酸氢镁,而控制温度在65 ℃以下,结晶析出七水磷酸氢镁。化学反应方程式为:
综合考虑实验仪器实际情况,试验中配置的氯化镁溶液浓度为1 mol/L,磷酸氢二钠溶液浓度为0.4 mol/L。在小试过程中,课题组对反应温度进行了考察,结果见表2。

表2 不同反应温度下的产品纯度Tab.2 Purity of product of different reaction temperature
1.1.2 反应原溶液pH值的规律研究
在实验中测得浓度为0.4 mol/L的磷酸氢二钠溶液pH值约为8.7,浓度为1 mol/L的氯化镁溶液pH值约为7。为了考查反应原溶液的pH值对产品纯度的影响,反应原溶液在不同的pH值下进行了对照实验,结果见表3。
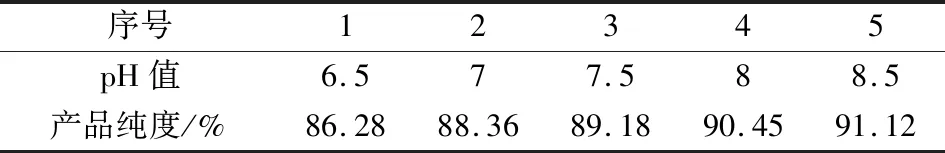
表3 不同pH值下的产品纯度Tab.3 Product purity at different pH value
1.1.3 反应原料物料比的规律研究
根据化学反应方程式可知,磷酸氢二钠与氯化镁物质的量之比为1 ∶1,为了考查反应原溶液的物料比对产品纯度的影响,课题组在实验过程中进行了对照实验,结果见表4。

表4 不同原料物料比下的产品纯度Tab.4 Product purity under different raw material ratio
1.1.4 反应时间的影响研究
根据文献记载,磷酸氢二钠与氯化镁水溶液反应时间需要48 h,为了考查反应时间对产品纯度的影响,课题组在实验过程中进行了对照实验,结果见表5。
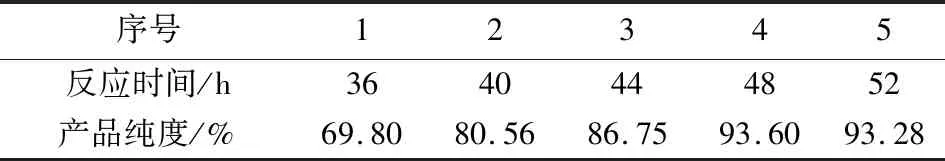
表5 不同反应时间下的产品纯度Tab.5 Purity of product under different reaction time
1.2 分析方法
(1)鉴别试验。取试样100 mg,溶于0.5 mL稀醋酸试液和20 mL水中。加1 mL氯化铁试液,静置5 min后过滤。滤液进行镁盐鉴别试验。取供试品溶液,加氨试液,即生成白色沉淀;滴加氯化铵试液,沉淀溶解;再加磷酸氢二钠试液1滴,振摇,即生成白色沉淀。分离,沉淀在氨试液中不溶解。
(2)含量分析。精确称取灼烧残渣约500 mg,加水50 mL和盐酸2 mL加热溶解。冷却后用水稀释至100.00 mL,混匀。取此溶液50 mL移入一400 mL烧杯,加水100 mL,加热至55 ℃~60 ℃。经滴定管加0.1 mol/L的EDTA二钠15 mL,在磁力搅拌器下用氢氧化钠试液调整pH值至10。加10 mL氨—氯化铵缓冲溶液和12滴羊毛铬黑试液后,继续用0.1 mol/L的EDTA二钠滴定至由酒红色变为纯蓝色,按下式计算残渣中焦磷酸镁(Mg2P2O7)含量。
Mg2P2O7含量(mg)=2×11.13×V
式中:V——滴定50.0 mL试样液时,0.1 mol/L EDTA二钠的耗用量,mL[1]。
2 实验结果与讨论
通过实验考察了反应温度、溶液的pH值、物料比、反应时间对产品纯度的影响,并且得到了实验数据。
实验研究过程中的产物中不含有毒有害物质,不会造成二次污染,经济、社会、环保意义明显。
3 结论
实验以晶体氯化镁为原料,将六水合氯化镁溶液与十二水合磷酸氢二钠溶液进行反应得到三水磷酸氢镁,考察了实验的反应温度、溶液的pH值、物料比、反应时间,得出以下主要结论。
1)随着温度升高,产品纯度并未随之提高,综合考虑实验仪器的实际温度控制情况,较适宜的反应温度为67 ℃。
2)当反应原溶液的pH值控制在6.5和8.5之间,随着pH值降低升高,产品纯度也随之提高。磷酸氢二钠溶液的pH值大约为8.5,无需调低的情况下对主反应较有利。
3)实验结果表明,磷酸氢二钠与氯化镁物质的量之比为1 ∶1的情况下对主反应较有利。
4)实验结果表明,当反应时间达到48 h,再延长反应时间,产品纯度并不会随之增长,因此较适宜的反应时间为48 h。

