N-Zn/TiO2光催化氧化脱硫废液中亚硫酸钠的研究
胡 敏,郭 嘉,吴华东,张林锋
(武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北武汉430073)
为了减少燃煤烟气中SO2的排放,常见的烟气脱硫方法分为:干法脱硫和湿法脱硫。双碱法脱硫作为湿法脱硫的一种,由于其具备转化率高、操作简便、脱硫剂易再生等优点被广泛应用于工业生产中[1-3]。但在双碱法脱硫工艺过程中,不能参与循环的浆液需要被排放出来,其中含有大量不稳定的亚硫酸盐,对环境有极大的危害。一方面,亚硫酸盐会造成水体和土壤污染,同时其分解后会重新释放出SO2,影响脱硫效率[4]。目前工业上处理亚硫酸盐的方法多为加热搅拌自然氧化或通空气强制氧化成硫酸盐,氧化效率低,反应时间长[5]。因此,如何高效快速地将双碱法脱硫废液中的Na2SO3进行充分氧化成为脱硫工艺研究的重点。
近年来,光催化氧化技术的应用得到了越来越多的研究和关注。二氧化钛(TiO2)是研究最为广泛的光催化半导体材料之一,具备很多优良的特性,在降解有机污染物(如十二烷基苯磺酸钠、罗丹明B等)方面有很广泛的应用[6-8]。此外,TiO2在处理无机污染物方面也表现出良好的性能。如:李丹丹等[9]利用TiO2纳米管电催化氧化处理氨氮废水,降解废水中的NH4Cl。孙勇等[10]利用TiO2对纯Na2SO3的光催化氧化进行了研究。但是,TiO2的带隙能量为3.2 eV,与其他半导体材料相比较大,且其禁带较宽,导致其仅能响应紫外光,对可见光波段的利用率较低[11-13]。另外TiO2产生的光生电子空穴对的分离效率较低,导致其与反应物接触的活性位点数量不足。有相关研究表明,TiO2中的氧空位数目是影响其对可见光吸收利用效率的主要原因,所以克服以上缺陷给TiO2光催化性能带来的局限性成为了最新的研究热点[14-15]。有相关文献表明,对TiO2进行元素掺杂改性可以在TiO2的禁带引入掺杂能级,促进光生电子由价带向导带的激发过程,同时掺杂能级可以抑制电子和空穴复合。从而起到克服TiO2内部结构缺陷、提高其对光催化反应的催化效率的作用[16-17]。
本文在前人基础上对TiO2进行掺杂改性,以尿素为掺杂氮源、乙酸锌作为锌源通过溶胶凝胶-煅烧方法制备出可用于光催化氧化工业废水中Na2SO3的N-Zn/TiO2催化剂,对催化剂用量、溶液pH、空气流量、亚硫酸钠初始浓度等工艺条件进行了研究。将光催化技术与工业废水中无机物的氧化相结合,具备较好的工业应用前景。
1 实验部分
1.1 实验试剂和仪器
实验试剂:双碱法脱硫废液(成分见表1)、五水硫代硫酸钠、碘、钛酸四丁酯、乙酸锌等。
实验仪器:磁力搅拌器、管式炉、增氧泵、氙灯光源等。
1.2 实验方法
1.2.1 亚硫酸钠转化率的测定
采用碘量法测定双碱法脱硫废液中的SO32-含量,其基本原理如下:SO32-质量浓度ρ(mg/L)按以下公式计算:

式中:V1为试样消耗硫代硫酸钠标准溶液量,mL;V2为蒸馏水消耗硫代硫酸钠标准溶液量,mL;M为硫代硫酸钠标准溶液浓度,mol/L;V为试样体积,mL。
1.2.2 催化剂的制备
N-Zn/TiO2催化剂的制备步骤:1)将钛酸四丁酯溶解于乙醇中(5 mL),其中V(钛酸四丁酯)∶V(无水乙醇)=1∶5,得到Ⅰ液;2)分别称取1 g尿素和1 g乙酸锌溶解于5 mL HNO3(质量分数为5%)中,然后加入去离子水(与所加入HNO3的体积比为2∶1),搅拌5 min,最后加入100 mL乙醇,得到Ⅱ液;3)取2 g聚乙二醇2000分散于25 mL乙醇中得到Ⅲ液,将Ⅲ液缓慢加入至Ⅱ液中,随后,将Ⅱ、Ⅲ两种液体混合并搅拌均匀,逐滴滴加到Ⅰ液中。将上述所得混合物在40℃下恒温搅拌2 h至出现白色凝胶,然后将烧杯置于80℃烘箱中干燥18 h。最后,将所得到的产物碾碎成粉末放于坩埚中在550℃下煅烧120 min即得到最终产物[18]。
1.2.3 亚硫酸钠的催化氧化
N-Zn/TiO2光催化氧化双碱法脱硫废液的装置见图1,取300 mL双碱法脱硫废液于光催化反应器中,用PHC-3C型数显酸度计将溶液的pH调节到所需值,加入一定量的N-Zn/TiO2催化剂。打开增氧泵,通入空气。使用PLS-SXE300氙灯提供紫外线光源。每隔30 min取一次样测定脱硫废液中SO32-的浓度,若硫代硫酸钠的用量不随时间变化,则认为反应到达终点,按照公式计算Na2SO3的浓度以及其氧化率。

图1 光催化氧化亚硫酸钠反应装置图
2 N-Zn/TiO2催化剂表征
2.1 X射线衍射
通过对TiO2和N-Zn/TiO2进行X射线衍射(XRD)表征掺杂前后晶相的变化,结果见图2。对于制备的纯TiO2样品,XRD谱图中同时出现锐钛矿型和金红石型两种晶型的特征衍射峰[19]。其中,位于25.34、37.85、48.08、62.81°的 衍 射 峰 对 应 金 红 石 型TiO2的(101)、(004)、(200)和(204)晶面。而位于27.51、36.15、41.31、54.40、69.06°的衍射峰则对应锐钛矿型TiO2的(110)、(101)、(117)、(211)和(301)晶面。对于N-Zn/TiO2样品,其中又新出现了位于23.91、32.77、35.37、40.51、53.50、61.87°的衍射峰,这些衍射峰归属于Ti2O3(JCPDS:74-2278),即掺杂N、Zn元素会导致一部分TiO2转化为Ti2O3。不同晶型的TiO2与Ti2O3会形成异质结,从而对材料的活性和催化效果都有促进作用[20]。

图2 TiO2及N-Zn/TiO2的XRD谱图
2.2 红外光谱
图3 是纯TiO2与N-Zn/TiO2的红外光谱图(FT-IR)。由图3可见,在510 cm-1处出现的峰为Ti—O键吸收峰,在3 000~3 500 cm-1处的吸收峰源自O—H键的伸缩振动,这来自于吸附在催化剂表面的水分。同时,N-Zn/TiO2还在430 cm-1处出现了吸收峰,这归因于Zn—O键的晶格振动。在1 045 cm-1处还出现了一个微弱的峰,这是因为在N-Zn/TiO2催化剂中出现了N—Ti—O键。以上结果说明,ZnO成功嵌入了TiO2中,并且N元素代替了TiO2中的O形成了N—Ti—O键[21-22]。

图3 TiO2及N-Zn/TiO2的红外谱图
2.3 X射线光电子能谱
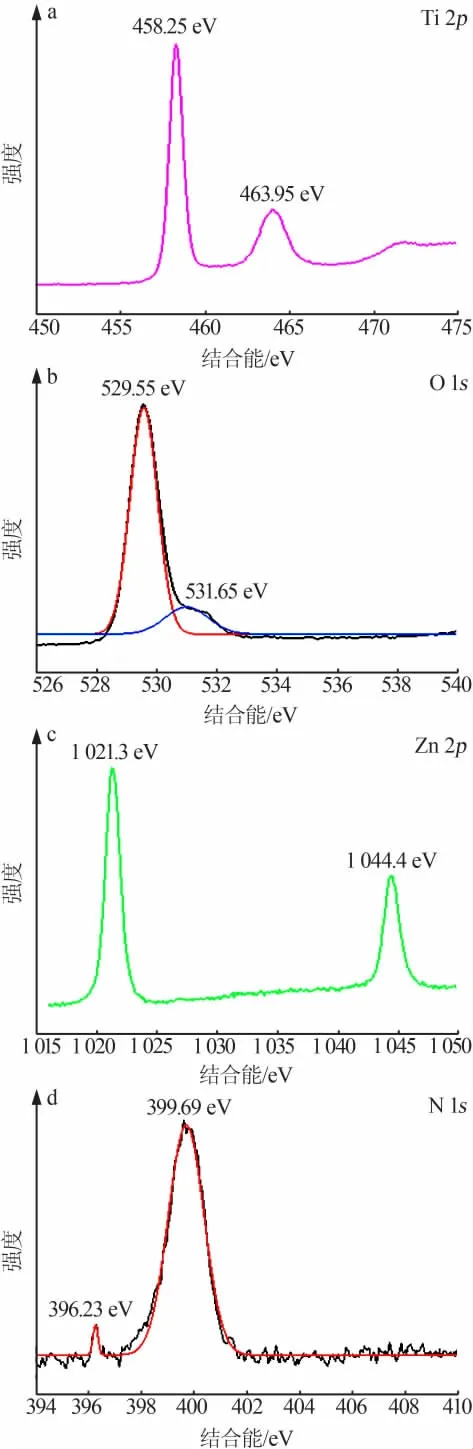
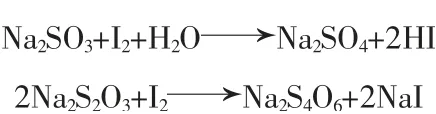
图4 N-Zn/TiO2催化剂的Ti 2p,O 1s,Zn 2p和N 1s的XPS能谱图
图4 是N-Zn/TiO2的XPS能谱图,其中a,b,c,d分别为Ti 2p,O 1s,Zn 2p和N 1s。在Ti 2p谱图中,可以观察到分别位于458.25 eV和463.95 eV结合能处的两个峰,它们分别对应Ti 2p3/2和Ti 2p1/2轨道。与Ti 2p3/2(459.40 eV)和Ti 2p1/2(465.00 eV)轨道的标准值相比,结合能出现了左移。可能的原因是N掺入了晶格中并替代了O,N的电负性较低,导致电子从N转移到Ti上,从而增加了Ti的电子密度[23-24]。在O 1s谱图中,观察到在529.55 eV处有明显的O—Ti—O峰,在531.65 eV处有一个小峰属于Ti—OH峰。在Zn 2p谱图 中,在1 021.30 eV和1 044.40 eV的两个峰分别是Zn的2p3/2和2p1/2电子态,这表明在共掺杂体系中Zn是以Zn2+的氧化态存在的[25-26]。在N 1s谱图中,399.69 eV处有一个N电子峰,这是属于γ-N 1s的峰,可能是因为在TiO2晶格之间形成了N2或者NO分子。除此之外,在N 1s谱图中还有一个位于396.23 eV处的小峰,这可能来源于β-N1吸收态,在Ti—O键之间掺入N后,形成了N—Ti—O键造成的[27]。以上结果与所测的红外结果相同,在N-Zn/TiO2催化剂中,ZnO成功嵌入了TiO2中,N元素以共价键的形式代替了TiO2中的O形成了N—Ti—O键,成功掺杂到TiO2中。
2.4 场发射环境扫描电镜
图5 中a,b分别是TiO2和N-Zn/TiO2粉末的场发射环境扫描电镜(FESEM),掺杂后的N-Zn/TiO2催化剂形貌与纯TiO2相比基本保持一致,主要由直径在0.6~1μm的颗粒组成,良好的分散性和较小的直径保证了材料有充足的触光面积,能尽可能充分地与溶液中的SO32-接触,从而在一定程度上促进光催化氧化亚硫酸根反应的进行。

图5 TiO2及N-Zn/TiO2粉末的FESEM图
3 亚硫酸钠氧化结果讨论
3.1 催化剂N-Zn/TiO2填加量对反应速率的影响
反应条件为:300 mL脱硫液,其中ρ(SO32-)=38 g/L,在30℃下将pH调为6.5,通入流量为5 L/min的空气,将反应器放在转速为300 r/min的磁力搅拌器上,光照强度为300 W,催化剂的用量分别为:m(催化剂)∶m(Na2SO3)=1∶50、1∶100、1∶200、1∶300。所得结果见图6。由图6可知,不加N-Zn/TiO2催化剂进行光催化氧化完全反应耗时8 h,反应时间较长,而加入一定量的催化剂能大幅度缩短反应时间。说明N-Zn/TiO2对脱硫废液中Na2SO3的氧化能起到很好的催化效果。纯TiO2通常情况下仅对400 nm以下的紫外光有响应。同时,TiO2的量子效率也不是很高,可能会影响Na2SO3的催化氧化效果以及有效的活性反应时间。因此,可采用元素掺杂、半导体复合和贵金属沉积等方法来对TiO2的光学性质进行改进。光生电子空穴对能分别与H2O和O2发生反应,可进一步生成直接参与氧化反应的活性基团(·OH和·O2-),这些自由基与反应体系中的SO32-反应最终生成SO42-完成反应过程,具体反应过程如下:
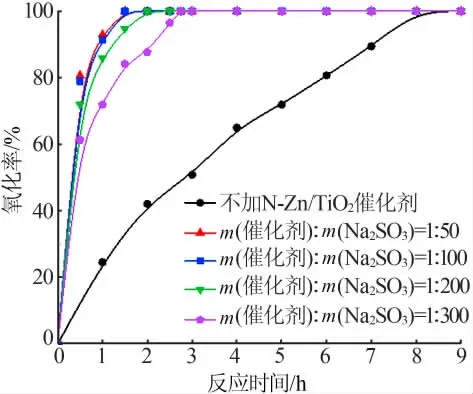
图6 N-Zn/TiO2催化剂用量对反应速率的影响
1)电子和空穴的生成
2)氧化剂的生成和SO32-的氧化(·OH和·HO2分别代表羟基自由基和过羟基自由基)
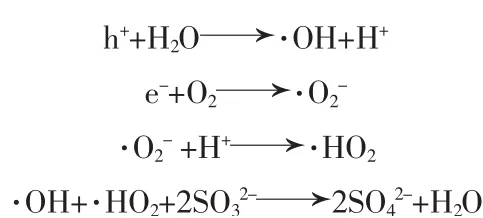
当m(催化剂)∶m(Na2SO3)=1∶300,即N-Zn/TiO2用量为0.06 g时,完全反应耗时2.75 h;当m(催化剂)∶m(Na2SO3)=1∶200时,完 全 反 应 耗 时2 h;当m(催化剂)∶m(Na2SO3)=1∶100和1∶50时,完全反应耗时1.5 h。当m(催化剂)∶m(Na2SO3)低于1∶100,即N-Zn/TiO2的用量少于0.26 g时,Na2SO3的氧化速率随着催化剂用量的增多而提高;当N-Zn/TiO2的用量大于0.26 g后,反应速率无明显增长。说明适当增加催化剂的用量可以促进反应的进行,m(催化剂)∶m(Na2SO3)=1∶100是能够将脱硫液中Na2SO3完全催化氧化的最佳比例。
3.2 pH对亚硫酸钠氧化率的影响
反应条件为:300 mL脱硫液,其中初始ρ(SO32-)=38 g/L,在30℃下通入流量为5 L/min的空气,并将反应器放在转速为300 r/min的磁力搅拌器上,加0.26 g N-Zn/TiO2催化剂,反应时间为1 h,光照强度为300 W,调节脱硫液pH分别为:5.0、5.5、6.0、6.5、7.0、7.5。所得结果见图7。
由图7可知,N-Zn/TiO2对Na2SO3的催化氧化效果与脱硫液的pH有关,也有相关文献表明,pH是影响光催化氧化反应的关键参数[28]。N-Zn/TiO2对Na2SO3的光催化氧化是由催化剂对SO32-的吸附以及羟基自由基(·OH)氧化协同作用的。在弱酸性条件下,溶液中的SO32-更容易吸附在催化剂表面,同时溶液中OH-浓度并没有显著降低,对SO32-的氧化最为有利。当pH<6.5时,随着pH的降低,溶液中H+浓度增大,OH-的浓度大幅降低,从而影响羟基自由基(·OH)的生成,对Na2SO3氧化反应的进行造成阻碍。当pH>6.5时,随着pH的增大,溶液中的OH-浓度增大,带相同电荷的OH-会与SO32-产生竞争吸附,阻碍催化剂对SO32-的吸附从而降低催化活性。因此,溶液pH过低或过高都会影响N-Zn/TiO2对Na2SO3的催化氧化效果,实验结果说明N-Zn/TiO2在紫外灯照射下对Na2SO3的催化反应存在最佳pH为6.5。

图7 pH对亚硫酸钠氧化率的影响
3.3 空气流量对亚硫酸钠氧化率的影响
反应条件为:300 mL脱硫液,其中初始ρ(SO32-)=38 g/L,在30℃下将pH调为6.5,并将反应器放在转速为300 r/min的磁力搅拌器上,光照强度为300 W,加0.26 g N-Zn/TiO2催化剂,反应时间为1 h,调节增氧泵流量分别为:1、2、3、4、5、6 L/min。所得结果见图8。
由图8可知,N-Zn/TiO2对Na2SO3的催化氧化效果与空气流量大小有关。随着空气流量的增大,脱硫液中的Na2SO3反应速率加快,当空气流量大小增长至4 L/min后,Na2SO3的氧化率不再发生明显变化。可能原因是随着气体流量的增大,溶液中的溶氧量也会增大,对Na2SO3的氧化反应会起到促进作用。同时,增大空气流量会使得气液相间的传质阻力降低,从而使得氧化反应速率加快。当气体流量增大到一定程度后,溶液中的溶氧量达到饱和,此时继续增大空气流量对反应速率影响不大。

图8 空气流量对亚硫酸钠氧化率的影响
3.4 亚硫酸钠初始浓度对反应速率的影响
反应条件为:取300 mL脱硫液,在30℃下通入流量为5 L/min的空气并将反应器放在转速为300 r/min的磁力搅拌器上,加0.26 g N-Zn/TiO2催化剂,光照强度为300 W,调节亚硫酸根质量浓度分别为28、38、48 g/L。所得结果见图9。
如图9所示,亚硫酸钠的氧化速率与脱硫液中SO32-的初始浓度有关,随着溶液中SO32-浓度的增大,催化反应速率降低,造成这种现象的原因可能是因为:一定数量的N-Zn/TiO2催化剂在光照强度不变的紫外灯下,能发生电子跃迁产生的电子空穴对是有限的,面对SO32-的增多,不能第一时间提供活性基团和活性位点参与氧化反应,导致反应时间延长,反应速率变慢。同时也有相关文献表明,随着溶液中Na2SO3浓度的增大,溶液本身会吸收一部分紫外光,从而导致用于催化剂产生活性基团的光子能量降低,在一定程度上会影响到Na2SO3的氧化速率。
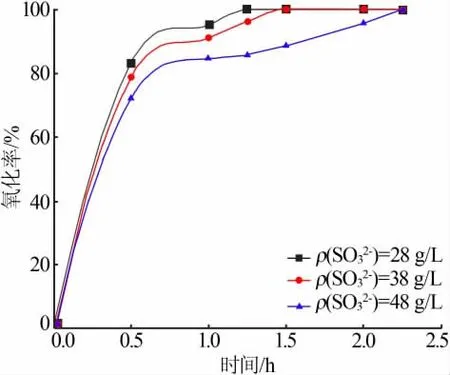
图9 亚硫酸钠初始浓度对反应速率的影响
4 结论
1)本文利用溶胶凝胶法制备了N-Zn/TiO2催化剂能够催化氧化双碱法脱硫废液中的Na2SO3。对催化剂的表征结果表明:掺杂N、Zn元素后,一部分TiO2转化为Ti2O3。不同晶型的TiO2与Ti2O3会形成异质结,从而促进材料的光催化活性。共掺杂体系中Zn元素以Zn2+的氧化态存在,N元素以N—Ti—O键的形式存在。2)双碱法脱硫废液中的Na2SO3在不加催化剂时,完全氧化需要8 h,加N-Zn/TiO2在300 W紫外氙灯照射下,反应时间可缩短至1.5 h。随着N-Zn/TiO2催化剂用量的增加,脱硫废液中Na2SO3的氧化速率呈先增大后不变的趋势,催化剂的最佳用量为反应废液中Na2SO3质量的1%。3)Na2SO3的反应速率随着溶液pH的增大呈先增大后减小的趋势,其中,pH=6.5时反应效果最好。空气流量和Na2SO3的初始浓度对催化反应的进行也有一定影响。随着空气流量的增大,使得反应速率加快,当溶液中的溶氧量达到饱和后继续增大空气流量对反应影响不大,空气的最佳流量为4 L/min。随着脱硫废液中亚硫酸钠初始浓度的增加,反应速率降低,反应时间延长。

