血清蛋白组学对高脂血症性胰腺炎患者治疗前后的差异性分析
邱嘉华 李俊达(通讯作者) 黄敏 陈一婧 葛安琪
(深圳市龙华区人民医院消化内科 广东 深圳 518109)
高脂血症已成为急性胰腺炎的主要病因之一,且高脂血症性胰腺炎(HLP)发病率随着人们生活习惯和饮食结构的改变呈现上升趋势[1]。与其他病因相比,HLP 具有发病年龄较轻、易复发的特点。但临床上对HLP 的相关发病机制及诊治认识不足,确切的发病机制尚不完全清楚。相对和绝对定量同位素标记(iTRAQ)是一种可以寻找差异表达蛋白和分析蛋白功能的技术,广泛应用于蛋白质组学定量研究中[2]。本文旨在采用iTRAQ 与二维液相色谱质谱(2DLC-MS/MS)联用技术对HLP 患者治疗前后进行血清差异蛋白质组学研究,为寻找HLP 新的治疗途径开辟新思路。
1.资料与方法
1.1 一般资料
选取2018 年6 月—2019 年5 月我院收治的高脂血症性急性胰腺炎患者30 例,所有入选患者符合诊断标准:中华医学会消化病学分会胰腺疾病学组修定的《中国急性胰腺炎诊治指南(2019年,沈阳)》[3],同时血甘油三酯(TG)≥11.30mmoL/L,或TG 5.65~11.3mmol/L,且血清呈乳糜状。排除标准:伴有心血管疾病、机械性肠梗阻、消化性溃疡并穿孔、胆管梗阻患者、长期饮酒者和其它原因引起的急性胰腺炎等患者。所有入组者均知情,通过医院伦理委员会审批。
1.2 主要试剂及仪器
iTRAQ 试剂盒、胰酶(Promega)、三乙基碳酸氢铵缓冲液TEAB、TCEP、MMTS、蛋白浓度检测试剂盒、真空干燥仪冷冻离心机、分光光度计、恒温箱、液相色谱仪、质谱仪Q Exactive、ProteinPilot 4.0 软件等。
1.3 实验方法
1.3.1样本采集、分组 所有入组病例均于治疗前(入院时)、治疗后7 天分别抽取患者空腹静脉血5ml,静置1h,3000r/min离心10min 后取上清液,分装入EP 管中,编号后贮存于-80℃超低温冰箱待检。共收集HLP 治疗前组30 例,均分为3 组,分别为HLP 治疗前1 组、HLP 治疗前2 组、HLP 治疗前3 组(每组10 例);HLP 治疗后组30 例,均分为3 组,分别为HLP 治疗后1 组、HLP 治疗后2 组、HLP 治疗后3 组(每组10 例)。
1.3.2 蛋白质提取、定量 首先使用去高丰度蛋白试剂盒去除血清样本中的高丰度蛋白后,进行蛋白提取,并用 Bradford法测定蛋白浓度(根据试剂盒说明书进行操作)。
1.3.3 蛋白酶解、iTRAQ 标记 取200ug 蛋白用胰酶消化至肽段水平,从冰箱中取出iTRAQ 试剂盒,平衡到室温,按照手册对样品进行iTRAQ 标记。将HLP 治疗前1 组、HLP 治疗前2组、HLP 治疗前3 组分别标记为:iTRAQ 113、iTRAQ 115、iTRAQ 117;将HLP 治疗后1 组、HLP 治疗后2 组、HLP 治疗后3 组分别标记为:iTRAQ 114、iTRAQ 116、iTRAQ 118。3 个HLP 治疗前组和3 个HLP 治疗后组之间进行3 组重复试验,减少实验误差。混合标记后的样品,真空冷冻离心干燥,抽干后的样品冷冻保存待用。
1.3.4 高PH 液 相 分 级 流 动 相A:H2O(NH3in H2O PH=10);流动相B:80%ACN (NH3in H2O PH=10)。梯度洗脱条件:0 ~5min,5%B;5 ~10min,5%~10%B;10 ~60min,10%~40%B;60 ~65min,40%~95%B;65 ~75min,保 持95%B;75min ~85min,95%-5%B。真空冷冻离心干燥,抽干后的样品冷冻保存待用。
1.3.5 纳升级反相色谱-质谱分析(nano-RPLC) 将高PH反相分离得到组分后,每管样本用流动相A(2%ACN+0.1%FA)复溶。涡旋震荡,12000prm,4℃离心20min,吸取上清,采用夹心上样,Loading Pump 流速3ul/min,上样10min,分离流速0.3ul/min,分离时间为60min。样本经nano 高效液相色谱分离后转移到质谱仪Q Exactive 进行分析。一级质谱分辨率70000,扫描范围350 ~1800m/z;二级质谱分辨率17500。
1.4 数据分析及生物信息学分析
采用ProteinPilot4.5 软件进行搜库鉴定及定量分析,设置蛋白鉴定置信度为95%,且至少有一个肽段和库中的肽段95%以上相匹配,同时进行蛋白反库检索,设置假阳性率(FDR)<1%。选取差异倍数≥1.2 为上调蛋白,差异倍数≤0.83 为下调蛋白,所得结果进入分析。通过Uniprot 数据库筛选相关蛋白并进行分析。
1.5 统计学方法
2.结果
2.1 一般情况
30 例入组HLP 住院患者,男性19 例,女性11 例,年龄26~61 岁;平均(40.9±10.7)岁;30 例入组患者入院时(治疗前)进行BISAP 评分[4],平均(1.53±1.04)分;治疗7 天后进行第二次评分,平均(0.4±0.62)分,评分显著降低(P <0.05),所有患者均病情明显好转后出院。
2.2 质谱鉴定结果
共鉴定出蛋白质367 种,基于筛查和鉴定差异蛋白质的条件:选取差异倍数≥1.2 为上调蛋白,差异倍数≤0.83 为下调蛋白,并且P <0.05,与HLP 治疗前组比较,HLP 治疗后组发现显著差异蛋白共有91 个,其中上调78 个,下调13 个,见表1。
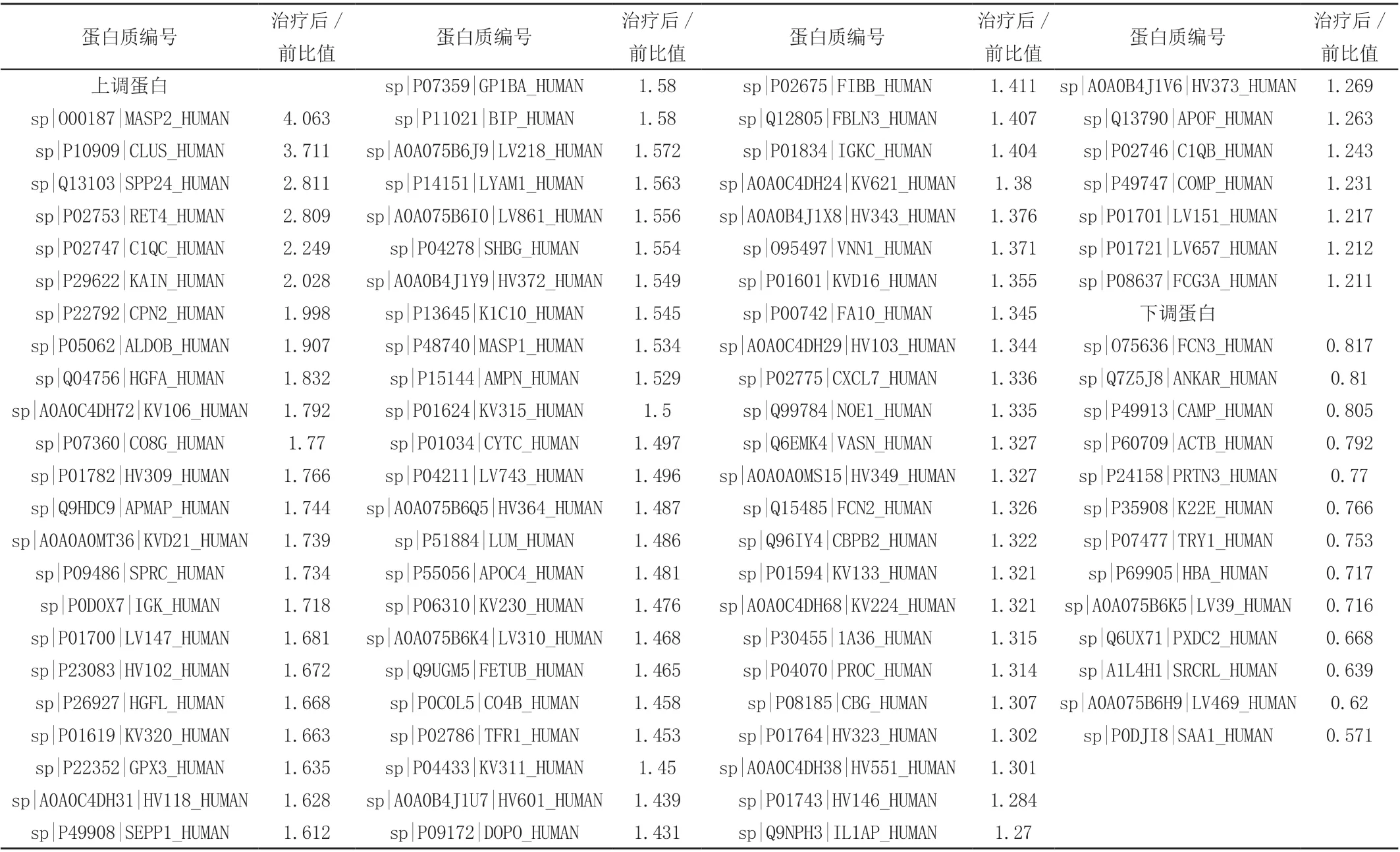
表1 高脂血症性胰腺炎患者治疗前后血清差异蛋白列表
3.讨论
HLP 的严重程度和并发症发生率更高,其发生发展是多种因素共同参与、共同作用的复杂的病理生理过程。研究HLP 的发病机制,对于提高HLP 的治疗效果具有重要意义。蛋白质是各种生物活动的执行者,绝大部分疾病的病理状态和治疗效应均可体现在蛋白质水平上。通过对HLP治疗前后血清蛋白质组学的研究,筛选和鉴定显著差异蛋白质,有望寻找出新的治疗靶点,提高临床疗效。本实验结果共筛选出显著性差异的蛋白91 个,其中差异最为明显的蛋白质有:MASP2、CLUS 和SAA1。
甘露糖结合凝集素相关丝氨酸蛋白酶2(MASP2)是补体凝集素途径关键酶,以酶原形式存在,是天然免疫系统中的重要组分,有激活补体、促进调理吞噬、调节炎症反应及促进凋亡等功能[5]。MASP2 血清浓度在不同疾病及同一疾病不同阶段不尽相同,与感染性疾病以及自身免疫性疾病的发生发展密切相关。本结果发现HPL 患者治疗后血清MASP2 水平上调,推测与机体启动补体系统、抵御感染有关。
聚集素(CLUS)是一种多功能的糖蛋白复合体,作为对损伤等应激反应的应答而在多种组织中表达,是一种新发现的凋亡抑制因子。研究发现在急性胰腺炎时CLUS 具有抗腺泡细胞凋亡的作用,从而减轻胰酶、炎症因子释放所导致的炎症反应,同时提高CLUS 的表达可能有利于促进胰腺细胞的再生和修复,阻止病情的进展[6,7]。这和本次发现的HLP 患者治疗后血清CLUS上调的结果一致,将为开辟一条新的治疗途径提供线索。
血清淀粉样蛋白A1(SAAl)是一种急性期反应蛋白,参与了机体炎症反应的发生与发展。当炎症、组织损伤等激发时,IL-1、IL-6 等促炎因子调控肝细胞分泌大量SAA1[8]。SAAl 还是一种载脂蛋白,可代替载脂蛋白Al 作为高密度脂蛋白胆固醇的主要载脂蛋白,尤其在急性炎症反应时,SAA1 在高密度脂蛋白胆固醇的转运过程中起主要作用[9]。近年来,相关研究发现过表达SAA 蛋白的肿瘤患者预后不佳[10]。故发现HLP 患者治疗后血清SAA1 下调,可能成为治疗效果或预后随访的指标。
本文筛选出了一系列HLP 相关的血清差异蛋白,这些蛋白可能为研究提高HLP 治疗效果提供线索,但需要进一步深入研究。

