基于16S rRNA序列分析糖皮质激素诱导大鼠骨质疏松模型肠道菌群的变化
董万涛 宋敏 巩彦龙 董平 田杰祥 张亚彬 文浩楠
1.甘肃中医药大学附属医院,甘肃 兰州 730020 2.甘肃中医药大学,甘肃 兰州 730000
糖皮质激素诱导性骨质疏松症(glucocorticoid-induced osteoporosis,GIOP)是全身性糖皮质激素(glucocorticoid,GC)治疗的常见并发症,是继发性骨质疏松症最常见的原因,GC的临床应用所导致的骨质疏松症(osteoporosis,OP)与骨骼脆弱性和骨折风险增加有关[1]。临床中糖皮质激素被广泛应用于免疫性疾病、肾病、过敏性疾病、器官移植等疾病的治疗中,其中骨质疏松症的发生率高达41.4%[2],还有更多的患者有潜在的OP发生的危险[3]。GC导致骨质疏松症的作用机制复杂,研究[4]显示,GC是骨形成和成骨细胞生成的负调节因子,其对骨形成的抗合成作用与1型原胶原N-端前肽(procollagen type 1 N-terminal propeptide,P1NP)的快速抑制有关,并且其可直接通过抗成骨细胞合成和促进成骨细胞代谢而导致骨质疏松的发生[5],目前对GIOP的病理机制主要从成骨细胞、破骨细胞、内分泌系统、钙磷代谢及骨代谢相关因子等途径展开,而从肠道菌群方面研究GIOP发生的机制尚未见报道,本研究从肠道菌群方面探讨了GIOP的发病机制。
1 材料和方法
1.1 实验动物
购自于甘肃中医药大学SPF级实验室[SCXK(甘)2011-0001]的Wistar大鼠(雌雄各半)20只体重(180±20)g,在SPF级实验室环境下(室温20~24 ℃、相对湿度40%~65%、每天光照明暗各半)每五只饲养在同一笼中,每2天更换一次垫料,给予充足的水和食物。
1.2 试验药物、试剂与仪器
水合氯醛250 g/瓶(上海展云化工有限公司,生产批号:20151023);VnF和VnR(10 μmol/L)(上海英俊生物技术有限公司);dNTP Mix(10 mmol/L)(BioLabs);Phusion HF MM(M0 541 L)和Phusion(BioLabs);VAHTSTM DNA Clean(VAHTSTM);Min Elute© PCR Purification Kit(QIAGEN);100 bp DNA Ladder Marker(Ta Ta Ra);Mobio 土壤微生物DNA强力提取试剂盒Power Soil© DNA Isolation Kit。96well PCR仪(AB,型号 9902);24孔离心机(EPPENDORF,型号 5424EQ766751)。
1.3 方法
1.3.1动物分组及造模:20只大鼠适应性喂养7 d后,随机分为正常组组(K组,10只)、模型组(MY组,10只);模型组按人鼠等效剂量给予醋酸地塞米松片(成都第一制药有限公司,规格0.75 mg×100片,国药准字H41021038,生产批号 170001),每日0.5 mg/kg;连续给药8周。正常组不做任何处理。
1.3.22组大鼠的粪便收集及粪菌总DNA的提取与检测:模型成功后,两组随机抽取4只,10%水合氯醛腹腔注射麻醉并处死,剖开腹腔后在回盲部行“V”形切口,无菌镊子夹取内容物放入冻存管中,-80 ℃冰箱保存备用。8个样品每个称取0.3 g提取每个样品粪便DNA、经甲醛变性琼脂糖凝胶电泳检测提取的总DNA质量,分光光度法测量DNA的纯度及浓度,-20 ℃冰箱保存备用。
1.3.316srRNA扩增子测序:以提取后样本的DNA为模板,使用细菌16S rRNA(V3+V4)区域引物[6]:5′-ACTCCTACGG GAGGCAGCA-3′,5′-GGACTACHVGGGTWTCTAAT-3′进行扩增及纯化。
1.3.4肠道菌群物种注释及功能预测:在物种注释的基础上,选每组样本在门、纲、目、科、属、种(Phylum、Class、Order、Family、Genus)分类水平上的丰度柱形累加图;根据物种注释结果,选取每个样品或分组在各分类水平(Phylum、Class、Order、Family、Genus、Species)上最大丰度排名前10的OTU,生成相对丰度柱形累加图,以观察各样品在不同分类水平上的丰度;采用PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States) 工具通过KEGG(Kyoto Encyclopedia of Genes and Genomes)代谢途径分析两组的差异途径,通过COG(Clusters of Orthologous Groups of Proteins)分析蛋白功能分类[7]。
1.4 统计学处理

2 结果
2.1 2组肠道菌群的OTU分析
正常组与模型组组共同含有575个OUT数据,除共有的OUT之外正常组有12个不同的OUT数据,模型组有12个不同的OUT数据(图1)。
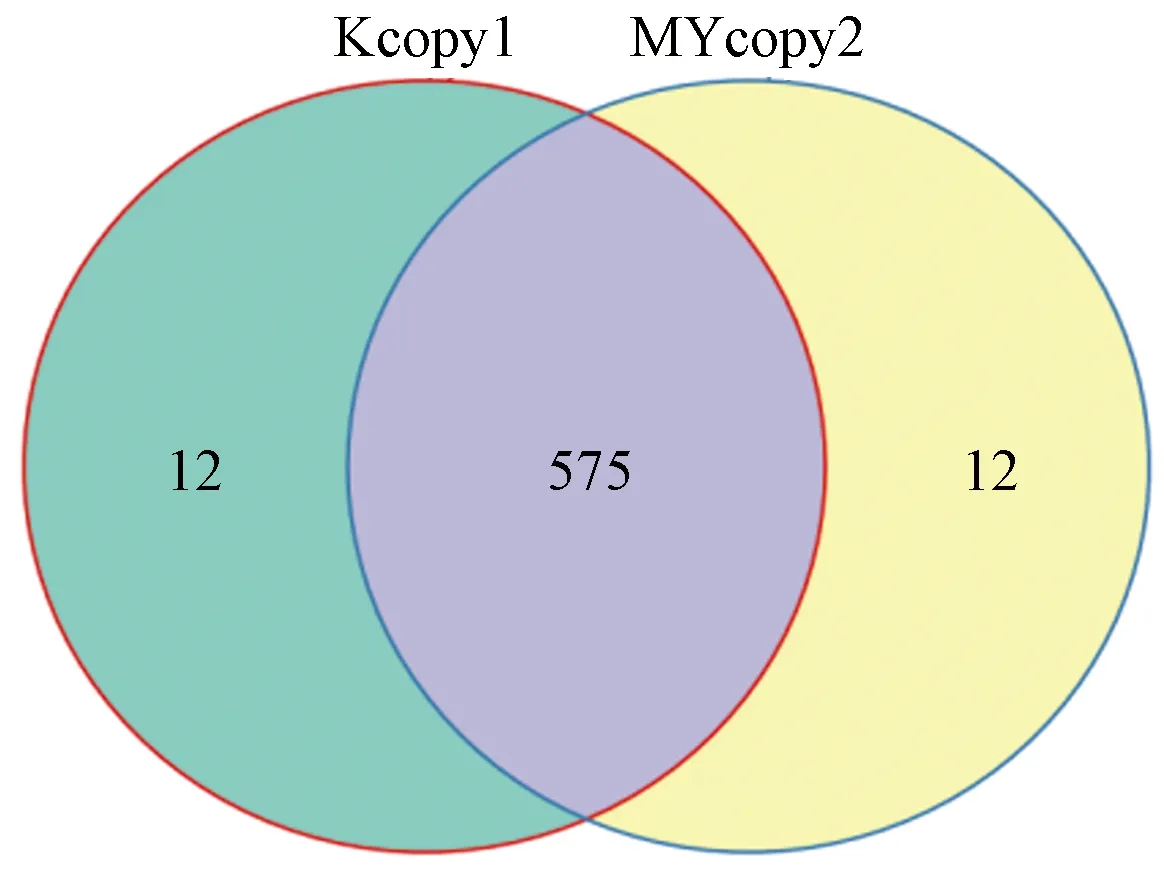
图1 2组大鼠肠道菌群的OTU分布的维恩(Venn)图Fig.1 Venn diagram of OTU distribution of intestinal microflora in two groups of rats
2.2 2组样本肠道菌群香农指数曲线
当香农指数为3~4时,各样本从随机抽取的测序条数发现的物种趋于饱和(图2)。
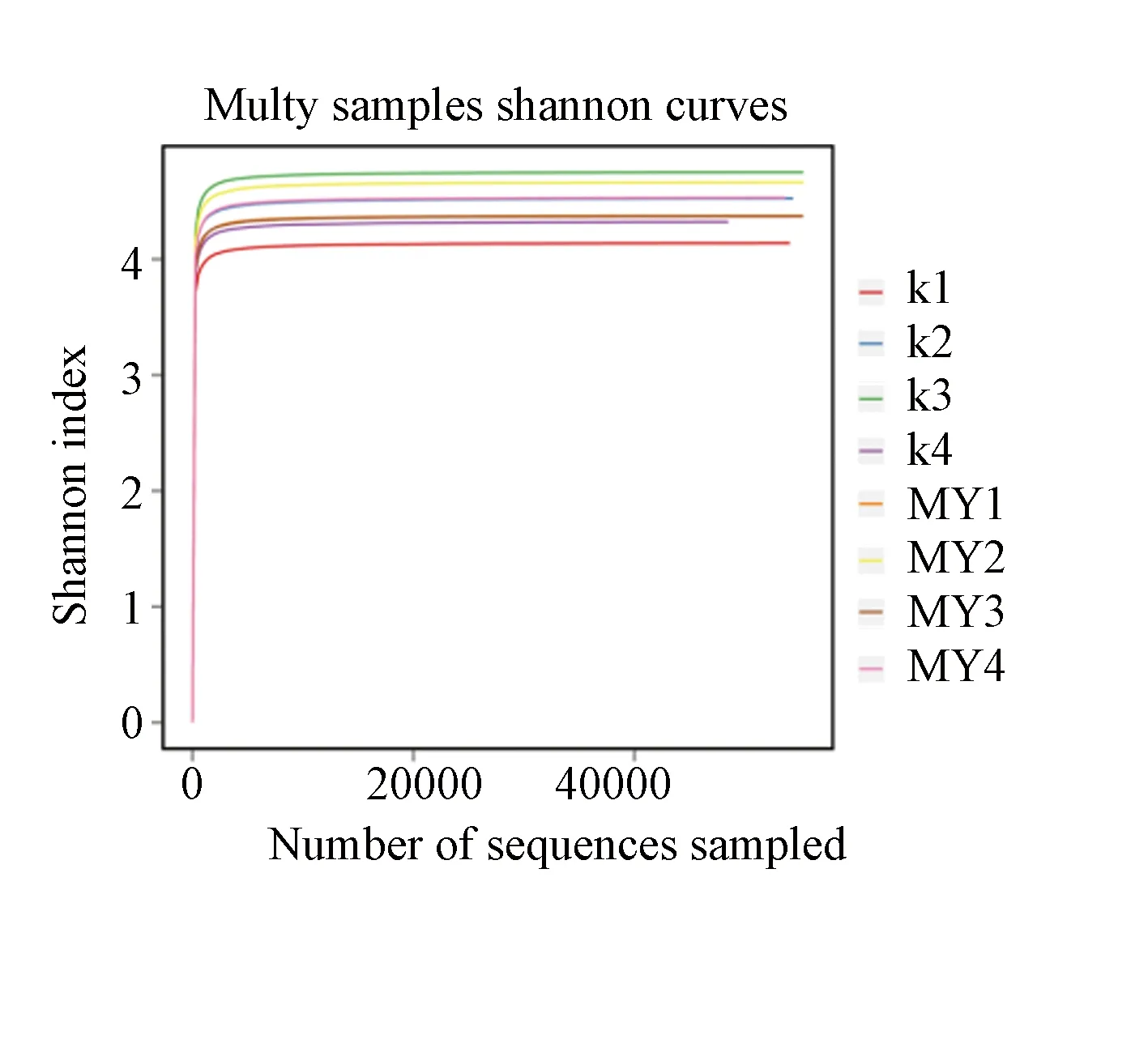
图2 2组样本肠道菌群香农指数曲线Fig.2 Shannon index curve of intestinal flora in two groups of samples
2.3 NMDS分析
由图可见,组间样本距离较近组内差异性小,而各组距离较远,组间差异较大,并且Stress=0.05<0.2,故此分析较可靠(图3)。
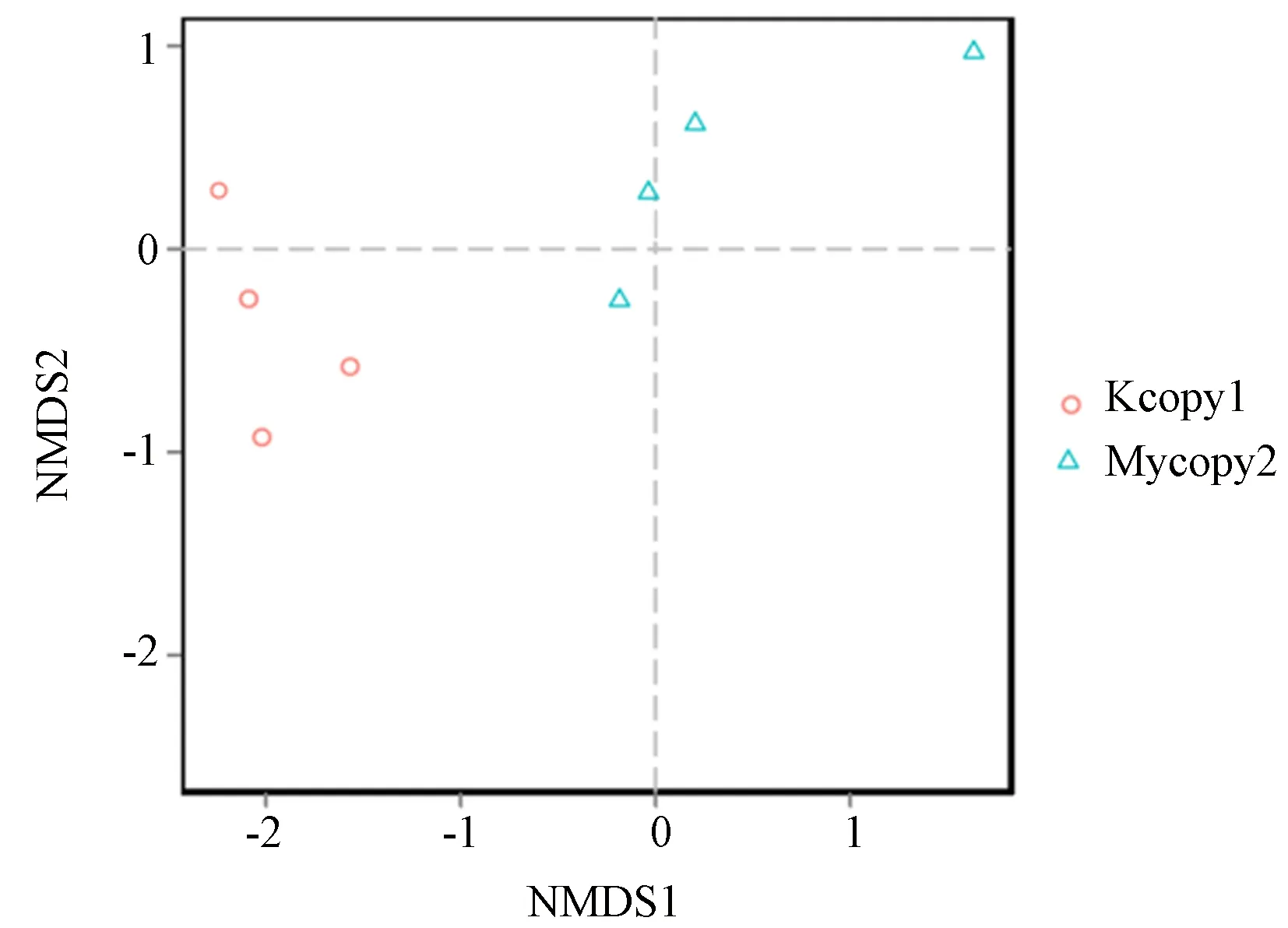
图3 NMDS分析图注:图中三角形代表正常组各样本、圆圈代表模型组各样本,当Stress<0.2时,表明NMDS分析具有可靠性,在坐标图上两组中各样本间的距离越近说明该组样本间的相似性越高。Fig.3 NMDS analysis chart
2.4 物种分布柱状图
如图4所示,图A为门水平(Phylum)、B为纲水平(Class)、C为目水平(Order)、D为科水平(Family)、E为属水平(Genus)、F种水平(Species);模型组大鼠在菌群结构上发生了较大的改变,其中在门、纲、目水平螺旋菌(Spirochaetae)的相对丰度较正常组低,在纲、目、科水平丹毒丝菌(Erysipelotrichia)的相对丰度较正常组高,在门水平变形杆菌(Proteobacteria)、柔膜菌门(Tenericutes)的相对丰度较正常组高,在种、属水平毛螺科菌(Uncultured-bacterium-f-lachnospiraceae)的相对丰度低于正常组,在属水平疣微菌科UCG-005(Ruminococcaceae-UCG-005)、普雷沃菌科NK3B31群(Prevotellaceae-NK3B31-group)的相对丰度高于正常组,在种水平巴氏酵母种菌(Uncultured-balterium-f-Lachnospirraceae)、巴氏杆种菌(Uncultured-balterium-g-prevotella)的相对丰度高于正常组、而巴氏-G-罗马尼亚梭菌-9(Uncultured-balterium-g-Ruminiclostridium-9)的相对丰度低于正常组,差异具有统计学意义(P<0.05)。

图4 各个分类水平上各组物种的分布图Fig.4 Percentile bar chart of species distribution at each taxonomic level
2.5 16S功能基因预测分析
2.5.1KEGG功能预测:通过KEGG代谢途径的差异分析可见,模型组差异较明显的途径有外源性物质的降解和代谢(xenobiotics biodegradation and metabolism),细胞运动(cell motility),碳水化合物代谢(carbohydrate metabolism),运输和分解代谢(transport and catabolism),信号传输(signal tranabolism),膜转运(membrane transport),神经系统(nervous system),神经退行性疾病(neurodegenerative disease)(图5)。

图5 KEGG功能预测图Fig.5 KEGG function prediction chart注:图5为不同功能在两个样品或者两组样品中的丰度比例,中间所示为95%置信度区间内功能丰度的差异比例,最右边的值为P值。
2.5.2COG功能预测:通过COG功能预测分析显示,模型组差异较明显的功能有细胞运动(cell motility)、能量生产预测和转换(energy production prediction and conversion)、防御机制(defense mechanisms)、未知功能(function unknown)、转录(transcription)、碳水化合物转运和代谢(carbohydrate transport and metabolism)(图6)。

图6 COG功能预测图Fig.6 COG function prediction chart注:通过比较图5与图6,发现每组有37个KEGG与22个COG功能预测分析的结果,且这些预测的结果在两组中差异都具有统计学意义(P<0.05)。
3 讨论
内源性糖皮质激素连接内分泌和免疫系统,并通过基因组和快速非基因组途径确保组织修复、再生和病原体清除过程中的炎症反应而发挥功能,由于GC对免疫细胞、组织和器官有很强的免疫抑制、抗炎和抗过敏作用,尽管GC易导致OP等严重的并发症,但由于其在临床上的有效性和经济实用性,其仍然广泛应用于临床[8-9]。研究发现,GC受体分布在成骨细胞上,该受体是GC作用于骨结构的重要部位,GC的过度表达会使骨表面变厚而损害骨组织矿化,高于生理浓度的GC可抑制成骨细胞分化和增殖,加速成骨细胞凋亡,并导致骨形成延迟[10]。肠道细菌在人体健康中起着重要作用,共生肠道细菌对宿主有多种有益作用,包括促进食物消化、产生必需营养素、增强肠道屏障完整性、完善宿主免疫系统和其他功能,GC能降低宿主的免疫力,导致肠道微生物群落组成及功能等实质性变化,增加对病原体的敏感性[11],而肠道菌群通过对钙磷吸收、能量代谢、分解脂肪酸等复杂的途径参与骨代谢的调节[12],但是GC作用与肠道菌群对骨代谢产生影响进而导致OP的发病机制尚未见报道。
为了进一步探讨GIOP与肠道微生物之间的关系,本研究采用16SrRNA技术,分析了地塞米松喂养建立骨质疏松模型大鼠肠道菌群的结构变化及功能变化,从肠道微生态角度对GIOP的发生机制做以探讨。分析结果显示,模型组大鼠在菌群结构个水平上发生了较大的变化,其中在门、纲、目水平Spirochaetae的相对丰度较正常组低,在纲、目、科水平Erysipelotrichia的相对丰度较正常组高,在门水平Proteobacteria、Tenericutes的相对丰度较正常组高,在种、属水平Uncultured-bacterium-f-lachnospiraceae的相对丰度低于正常组,在属水平Ruminococcaceae-UCG-005、Prevotellaceae-NK3B31-group的相对丰度高于正常组,在种水平Uncultured-balterium-f-Lachnospirraceae、Uncultured-balterium-g-prevotella的相对丰度高于正常组、Uncultured-balterium-g-Ruminiclostridium-9的相对丰度低于正常组,差异具有统计学意义(P<0.05)。长期服用GC后在肠道菌群中拟杆菌和普雷沃菌处于高水平,这与它们摄取高蛋白及碳水化合物的代谢途径相关[13],而本研究中普雷沃菌与正常组比较处于高水平,并且其代谢途径和功能都涉及到碳水化合物。长期服用GC可引起体内脂质积聚、肠道菌群结构改变和结肠黏液分泌减少,这些生理变化的机制可能包括昼夜节律紊乱和糖皮质激素受体(glucocorticoid receptor,GR)表达失调。Wu 等[15]研究显示,长期外源性GC导致下丘脑-垂体-肾上腺轴(he hypothalamic-pituitary-adrenal axis,HPA axis)的长期激活状态是内源性GC的分泌发生改变,这与肠道微生物群变化有关,GC治疗导致了高丰度水平的变形杆菌、酵母菌、螺旋菌,这与“促炎症及免疫”相关;另一方面,GC导致肠道菌群的变化使肠组织中黏液分泌水平发生变化,进而上调结肠抗菌肽相关基因(如TLR-2和defa8)的转录水平,GC诱导的炎症与免疫反应是肠道微生物群结构变化的直接因素[15],而OP的发生与肠道免疫系统密切相关[16]。
模型组差异较明显的KEGG代谢途径有xenobiotics biodegradation and metabolism、cell motility、carbohydrate metabolism、transport and catabolism、signal tranabolism、membrane transport、nervous system、neurodegenerative disease等,差异较明显的COG功能有cell motility、energy production prediction and conversion、defense mechanisms、function unknown、transcription、carbohydrate transport and metabolism等。研究显示,碳水化合物参与的能量转运与代谢在GIOP的发生过程中具有重要的作用,而骨钙素的能量转运与代谢调节作用参与了在这一过程中[17];在GIOP的病理过程中神经-内分泌-免疫网络发挥了重要作用,神经系统可通过多种骨代谢相关信号通路(如OPG/RANK/RANKL信号通路)P物质、神经肽Y促进骨髓间充质干细胞增殖及向成骨细胞的分化和矿化以促进成骨作用、通过β2肾上腺素受体,参与交感神经系统对骨重建的调控作用,以抑制骨量的丢失[18];而免疫细胞本身作为破骨细胞的前体参与骨代谢[19];在本研究中16S rRNA分析得出GIOP模型大鼠肠道菌群的功能及通路主要有能量转运与代谢、神经系统及免疫功能等,与上述研究相符合。
综上,本研究成功复制糖皮质激素诱导大鼠骨质疏松模型,应用16S rRNA技术,分析了模型组和正常组大鼠肠道菌群结构及功能的变化情况,对从肠道菌群方面阐明GIOP发病、病理变化机制和进一步深入研究及指导治疗具有重要意义。随着肠道菌群对机体健康机制的逐步阐明,从肠道菌群方面预防和治疗疾病的思路及方法受到越来越多学者的关注与重视,这为进一步从“肠-骨轴”方面研究防治OP提供了便利。但是,肠道菌群本身是一个非常复杂的器官,其对机体的调节更是全方位、多途实现的,所以其对GIOP复杂的调节及防治机制仍需要进一步深入研究。

