多指标综合评分法正交实验优选菊花的炒制工艺*
张姗姗 ,姚梦雪 ,范兰兰 ,江 瑜 ,苏 敏 ,汪小莉 ,洪 燕 ,韩燕全 ,吴德玲
(1.安徽中医药大学第一附属医院,国家中医药管理局中药制剂三级实验室,中药复方安徽省重点实验室,现代药物制剂安徽省工程技术中心,合肥 230031;2.安徽中医药大学,合肥 230031)
菊花为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序,其味苦、甘,性微寒,归肺、肝经,具有疏风清热、平肝明目、解毒消肿的功效[1]。菊花主要含有黄酮类、有机酸类、挥发油类等活性成分。现代药理研究表明菊花具有抗炎、抗菌、抗肿瘤、抗病毒和抗氧化等多种作用,目前临床多用于风热感冒、眩晕、目赤昏花等病症的治疗[2-4]。
炒菊花最先出现在宋代《类编朱氏集验医方》[5],后在明清时期发展成炒黑《药笼小品》[6]和煨炭《本草害利》[7]。清代《本草便读》[8]记载生菊花味甘性寒,善于平息肝风和肝火。脾胃虚寒,食少泄泻之病,应该少用(《本草汇言》)[9]。《实用中药炮制学》中指出菊花采用文火炒至微黄色,可以降低其寒性[10]。清代《外科大成》[11]记载“烧炭存性”,菊花炒炭后具有制寒止血的功效,而疏散风热等作用减弱(《新编中药志》)[12]。历版《中华人民共和国药典》(简称“中国药典”)均未收录炒菊花,而上海市2008年版《中药饮片炮制规范》和浙江省1986年版《中药饮片炮制规范》等[13-16]炮制规范收录了炒菊花,其炮制程度类似,以炒至表面微具焦斑或呈焦黑色为准。在菊花实际炒制过程中,具体的炮制工艺参数不清楚,炮制终点主要靠个人经验判断,导致炒菊花的质量参差不齐,进而影响其临床疗效。本实验采用多指标综合评分法正交实验,同时测定绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素、总黄酮含量,并以这6种成分和总黄酮含量为考察指标,对菊花炒制工艺进行优化,以期为菊花炒制工艺的建立提供参考。
1 仪器及试剂与药品
1.1 仪器 Aglient-8453型紫外分光光度计(济南赛场科学仪器有限公司),KDC-16H型离心机(科大创新股份有限公司中佳分公司),BZF-6050型真空干燥箱(上海博讯实业有限公司),BP211D型电子天平(德国Sartorius公司),KQ3200D型超声波清洗仪(江苏省昆山超声仪器有限公司),Waters Acquity型超高效液相色谱(UPLC)柱(美国Waters公司),AS-D400A红外线测温仪(武汉中测宏图测量仪器有限公司)。
1.2 试剂与药品 绿原酸(批号:327-97-9),木犀草苷(批号:5373-11-5),3,4-二咖啡酰基奎宁酸(批号:12041114),3,5-二咖啡酰基奎宁酸(批号:2450-53-5),木犀草素(批号:491-70-3),芹菜素(批号:520-36-5),芦丁(批号:100080-200707),对照品均购买自成都曼思特生物科技有限公司,甲醇和乙腈均是色谱纯,水为屈臣氏蒸馏水,其他实验试剂均为分析纯。菊花购自亳州市佰世信中药饮片有限公司,批号:170803,经文章通讯作者韩燕全主任中药师鉴定为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序。采用UPLC法对菊花中绿原酸、木犀草苷、3,5-二咖啡酰基奎宁酸含量进行测定,结果均符合2015年版《中国药典》规定。
2 方法与结果
2.1 炒菊花的制备 称取干净的菊花15 g,放入炒制容器内,按照2015年版《中国药典》(四部)炮制通则“0213”项下清炒法炮制,采用文火炒制,炒至菊花颜色呈现深黄色时取出,放置摊凉,筛去多余的碎屑,放于粉碎机中粉碎,留存备用。
2.2 方法学考察
2.2.1 色谱条件 色谱柱:Waters Acquity BEH C18(2.1mm×100mm,1.7μm);柱温30℃,流速0.2mL/min,进样量为 1 μL,以乙腈(A)-0.1%的磷酸(C)为流动相,检测波长为 348 nm,梯度洗脱(0-4 min,18%~20%A;4-9 min,20%A;9-11 min,20%~25%A;11-13 min,25%~35%A;13-18 min,35%~10%A;18-20 min,10%~18%A;20-22 min,18%A)。在该色谱条件下,炒菊花与混合对照品色谱图见图1。
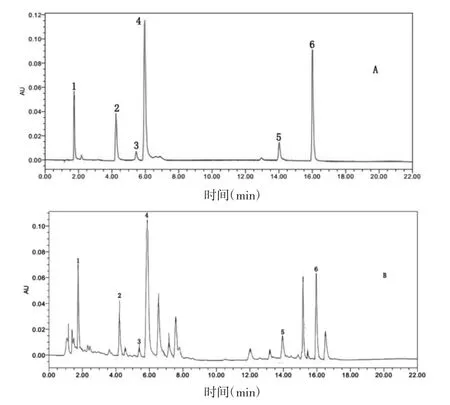
图1 混合对照品与炒菊花的UPLC图
2.2.2 混合对照品溶液的制备 分别精密称取绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素对照品适量,置于10 mL容量瓶中,加70%甲醇定容至刻度,制成浓度分别为51 μg/mL绿原酸、25 μg/mL木犀草苷、8.3 μg/mL 3,4-二咖啡酰基奎宁酸、129 μg/mL 3,5-二咖啡酰基奎宁酸、7.2 μg/mL 木犀草素、35 μg/mL芹菜素的混合对照品溶液。
2.2.3 供试品溶液的制备 精密称取菊花粉末(过1号筛)0.25 g,置于50 mL具塞锥形瓶中,再精确量取70%甲醇25 mL,加入锥形瓶中,密封塞紧,称取重量,在功率为300 W,频率为45 kHz条件下超声提取40 min,放冷后,称取重量,采用浓度为70%甲醇补足减失的重量,混匀后,经0.22 μm的微孔滤膜过滤,然后取续滤液,即得。
2.2.4 线性关系考察 分别精密吸取混合对照品溶液 0.5、1、2、3、4、5 μL,根据上述色谱条件进样,以绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素各对照品的浓度(μg/mL)为横坐标(X),以峰面积为纵坐标(Y)进行线性回归,结果见表1。
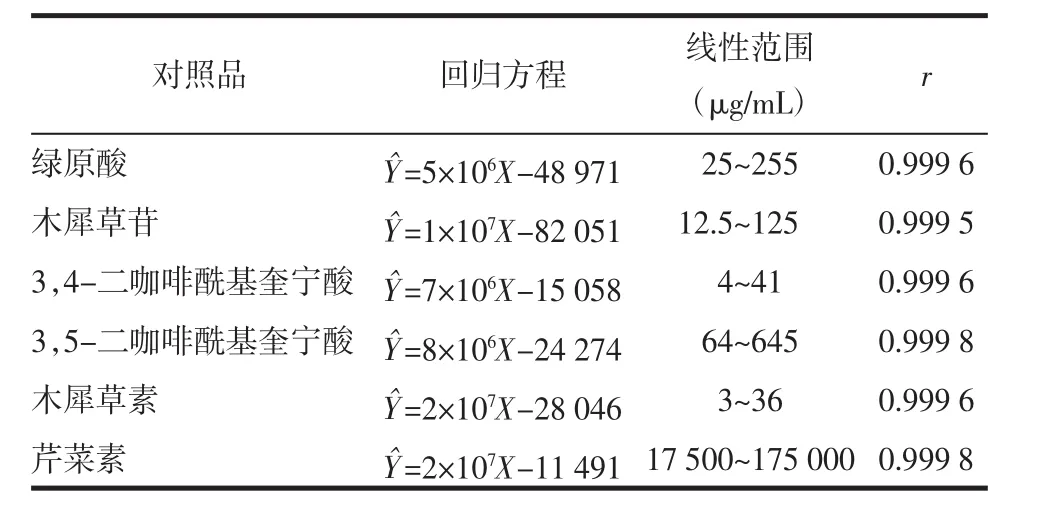
表1 6种成分的线性回归方程
2.2.5 精密度实验 精密吸取上述混合对照品溶液1 μL,按照上述色谱条件进样,重复进样6次,记录6种成分的峰面积,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素峰面积的相对标准偏差(RSD)值在0.12%~0.41%之间,表明仪器精密度良好。
2.2.6 稳定性实验 分别精密吸取同一份炒菊花供试品溶液,分别在 0、4、8、12、16、24 h 进样,按照上述色谱条件测定,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素峰面积的RSD值在0.20%~1.06%之间,表明样品溶液在24 h内稳定。
2.2.7 重复性实验 取同一份炮制品炒菊花分为6份,按照上述条件制备6份供试品溶液。按照上述色谱条件进样测定,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素和芹菜素6种指标成分含量的RSD值在0.19%~1.01%之间,说明供试品样品处理方法重复性良好。
2.2.8 加样回收率实验 准备已明确其含量的6份炒菊花,根据上述条件制备6份供试品溶液,每份供试品精确吸取0.5 mL,在每份供试品中加入与样品中成分含量接近的对照品,混匀后,选择0.2 μm微孔滤膜过滤,根据上述色谱条件进样测定,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素和芹菜素的平均加样回收率在96.88%~110.3%之间,RSD在0.00%~0.48%之间,说明该方法准确良好。
2.3 总黄酮含量测定 精密称取芦丁对照品5 mg,放于25 mL容量瓶中,加甲醇定容至刻度,混匀,即制备成浓度为200 μg/mL的芦丁对照品溶液,放置于冰箱保存,待用。
用移液管精确量取芦丁对照品溶液0、1、2、3、4、5 mL,各自放于25 mL容量瓶里,加蒸馏水6 mL,加5%亚硝酸钠(NaNO2)溶液1.0mL,摇匀放置6min,加 10%硝酸铝[Al(NO3)3]溶液 1.0 mL,摇匀放置6 min,加 4%氢氧化钠(NaOH)溶液 10 mL,加蒸馏水至刻度,摇匀,放置15 min。以第1管为空白对照,在510nm波长处用紫外分光光度计测定A值[17]。以芦丁浓度为横坐标(X),A值为纵坐标(Y^),得到线性回归方程为Y^=16.03X-0.015 4,r=0.999 2。
精密量取样品溶液2 mL,按照上述方法进行操作,把波长设置成510 nm,依次用紫外分光光度计测定各个样品的A值,每个样品均需测3次,把样品的A值代入线性回归方程中,计算得到样品中总黄酮的含量。
2.4 数据处理与分析 采用综合加权评分法评估菊花炒制工艺,根据其药理作用及药效方面的药用价值,将总黄酮的权重系数设为0.4,其他6个成分的权重系数分别设为0.1。综合评分=(总黄酮含量/总黄酮最大含量)×100×0.4+(绿原酸含量/绿原酸最大含量)×100×0.1+(木犀草苷含量/木犀草苷最大含量)×100×0.1+(3,4-二咖啡酰基奎宁酸含量/3,4-二咖啡酰基奎宁酸最大含量)×100×0.1+(3,5-二咖啡酰基奎宁酸含量/3,5二咖啡酰基奎宁酸最大含量)×100×0.1+(木犀草素含量/木犀草素最大含量)×100×0.1+(芹菜素含量/芹菜素最大含量)×100×0.1,优化菊花炒制工艺。
2.5 单因素实验
2.5.1 炒制温度考察 称取干净的菊花饮片7份,每份15 g。将菊花放入炒制容器内,炒制温度分别设置成 90、110、130、150、170、190、210 ℃,炒制时间为5 min。根据上述条件制备供试品溶液,根据上述色谱条件进样,计算各个样品中总黄酮和上述6个成分含量,并进行综合评分,结果见表2。结果显示在炒制温度为130℃时,炒菊花的综合评分最高。
2.5.2 炒制时间考察 依据安徽中医药大学第一附属医院院内临方炮制炒菊花,以炒至深黄色为准,及2015年版《中国药典》(四部)炮制通则“0213”项下清炒法炒至微黄色或深黄色规定,把炒制时间设置为 6 个水平(5、6、7、8、9、10 min)。分别称取干净的菊花饮片6份,每份15 g。将菊花放入炒制容器内,分别炒制 5、6、7、8、9、10 min。根据上述条件制备供试品溶液,根据上述色谱条件进样,计算各个样品中总黄酮和上述6个成分的含量,并进行综合评分,结果见表3。结果表明当炒制时间为8 min时,综合评分最高。
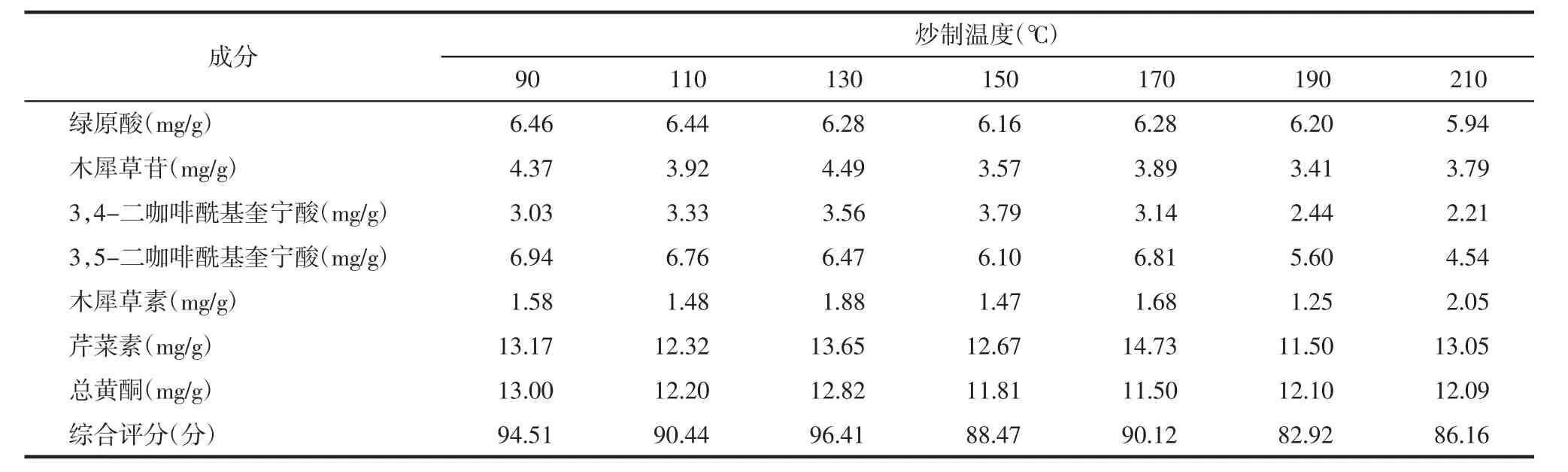
表2 炒制温度考察结果
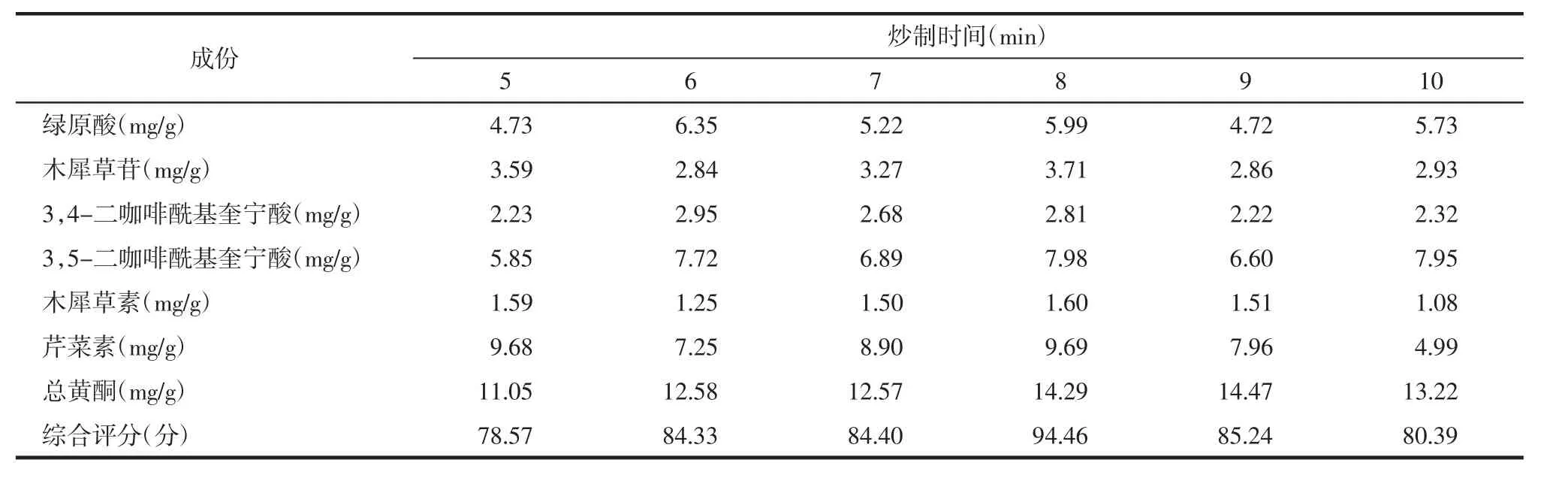
表3 炒制时间考察的结果
2.6 正交实验设计 在单因素实验的基础上,以炒制温度和炒制时间为考察因素,每个因素选择3个水平,以菊花6种成分和总黄酮含量为综合评分指标。采用多指标正交实验法,优化菊花炒制工艺[18-20],因素水平见表4。

表4 因素水平表
2.7 正交实验结果按照L9(34)正交表进行正交实验,按照上述条件制备供试品溶液,根据上述色谱条件进样,计算6种成分的含量。按照“2.3”项下方法计算总黄酮的含量。采用综合加权评分法,优化菊花炒制工艺,结果见表5及表6。
表5和表6结果显示,各因素对实验影响程度为炒制温度>炒制时间,在6~10 min炒制时间范围内,炒制时间对实验结果无显著影响,而炒制温度对实验结果有显著影响,差异具有统计学意义(P<0.05)。正交实验的结果表明菊花的最佳炒制工艺为炒制温度130℃,炒制时间8 min。
2.8 验证实验 根据优选出的菊花炒制工艺制备3组炒菊花,对每组样品6种成分和总黄酮含量进行测定,得到3组验证实验的综合评分值,其综合评分值的RSD值为0.2%,说明此炒制方法稳定可行,结果如表7所示。
3 讨论与结论
实验考察了色谱柱、波长、柱温、进样量、流速和流动相等对色谱峰分离度的影响,最终确定色谱柱为WatersAcquityBEHC18(2.1mm×100mm,1.7μm),波长为348 nm,柱温为30℃,进样量为1 μL,流速为0.2 mL/min,流动相为0.1%磷酸-乙腈。在此条件下各色谱峰基线平稳,分离度良好。本实验选择的检测方法可靠稳定。
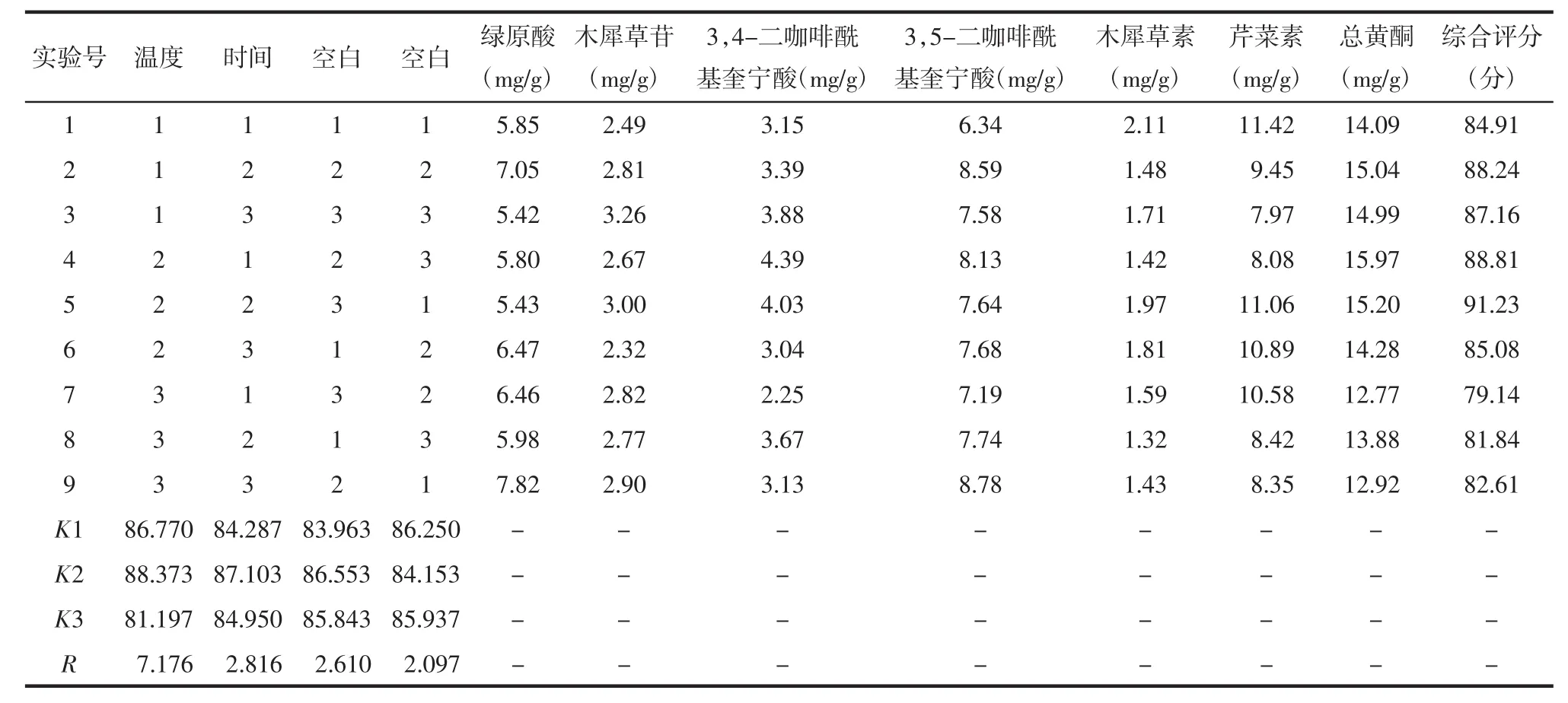
表5 正交实验设计与结果
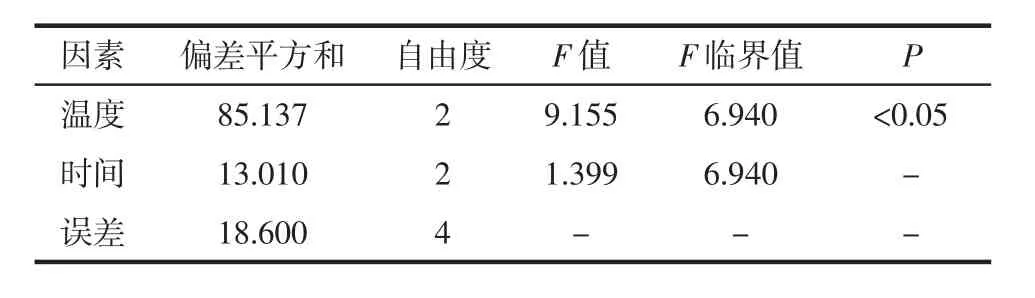
表6 方差分析表
炒菊花是安徽中医药大学第一附属医院特色临方炮制品种之一,其炒制工艺及炒制相关参数未见报道。炒制温度和炒制时间等炮制因素可能对饮片的质量产生影响。本实验通过单因素实验,确定炒制温度和炒制时间为影响菊花质量的主要因素。黄酮类和有机酸类等成分是菊花的主要活性成分,在菊花中含量较高。文献报道,黄酮类成分中木犀草素、芹菜素和木犀草苷具有抗氧化、清除自由基和修复肝细胞损伤等药理作用。有机酸类成分中3,4-二咖啡酰基奎宁酸和3,5-二咖啡酰基奎宁酸具有清除超氧化物阴离子自由基和抗氧化作用[21]。而且2015年版《中国药典》将绿原酸、木犀草苷、3,5-二咖啡酰基奎宁酸作为菊花的主要活性成分。因此,本课题选择炒制温度和炒制时间为考察因素,选择绿原酸、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草苷、木犀草素、芹菜素、总黄酮含量为考察指标,最终优选出菊花炒制工艺为炒制温度130℃,炒制时间8 min。同时对工艺进行验证,得到3组验证实验的综合评分值,其综合评分值的RSD值为0.2%,说明此炒制方法稳定可行。
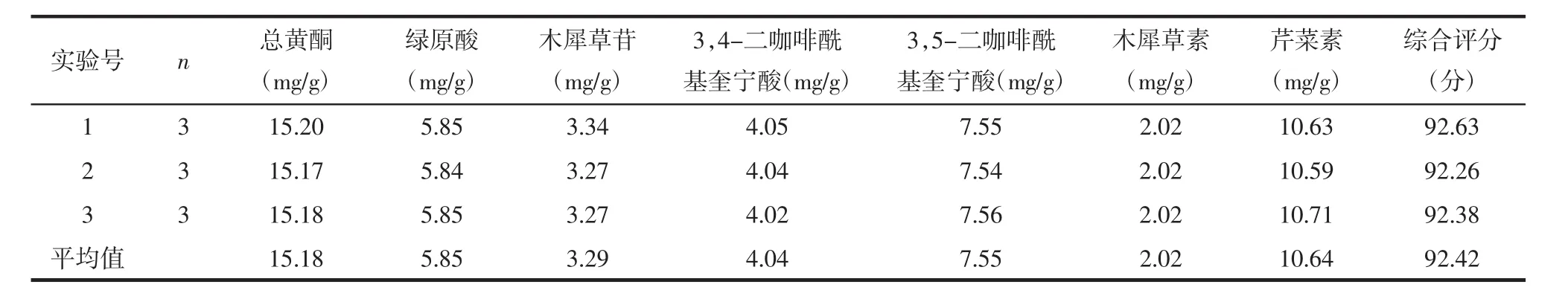
表7 最佳工艺结果分析

