养阴扶正方对PD-L1+Lewis肺癌细胞凋亡影响及作用机制
孙玺媛, 陈宏, 姜梅, 魏冬梅, 尹钢, 陈沫岚, 刘玲玲, 张杰
齐齐哈尔市第一医院暨南方医科大学附属齐齐哈尔医院,黑龙江 齐齐哈尔 161000
程序性死亡分子1(programmedcelldeath1,PD-1)及其配体程序性死亡分子配体1(programmed cell death ligand 1,PD-L1)在肿瘤细胞免疫逃逸中发挥重要作用,是肺癌发生发展的机制之一,伴随PD-1/PD-L1抗体在肺癌中的广泛应用,使肺癌患者的无病进展生存期、总生存期得到了延长。PDL1 在肿瘤细胞高表达与T 细胞表面的PD-1 结合,使T细胞失能、耗竭,肿瘤细胞逃避T细胞的免疫监视和杀伤,进而增殖,病情恶化。肿瘤细胞的增殖、分化、凋亡受细胞周期的调控[1]。养阴扶正方为临床经验总结方,由《温病条辨》中的沙参麦冬汤化裁而来,具有益气养阴、化痰通络、散瘀解毒的功效。经过十余年的临床使用,表明养阴扶正方能够改善非小细胞肺癌患者的临床症状、生存质量和稳定瘤灶,基础研究也证明其具有明确的抗肺癌的作用[2-5]。因此,本研究应用免疫磁珠筛选PD-L1+Lewis 肺癌细胞,经过流式细胞术验证后,建立移植瘤模型,研究其与原代Lewis 肺癌细胞在细胞凋亡以及细胞周期的差异及养阴扶正方的调控作用,为养阴扶正方的临床应用提供依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞与动物
Lewis 肺癌细胞株:购自美国ATCC 公司;C57BL/6 小鼠,雄性,48 只,鼠龄6 ~8 周,20 ±2 g/只,SPF 级,购于青岛实验动物中心(证书编号:SCXK 2014-0001),实验动物使用许可证:SYXK(黑)2016004,本实验通过《齐齐哈尔市第一医院实验动物管理办法(试行)》伦理审核,伦理编号为NO.2018-01。
1.1.2 药品
养阴扶正方由黄芪、党参、沙参、天冬、麦冬、生白术、山药、白花蛇舌草、拳参、绞股蓝、茯苓、莪术组成,取以上药加水煎煮二次,每次加10 倍量水,提取2 小时,滤过后合并滤液,制成5.25 克(生药)/ml,以上药品由齐齐哈尔市第一医院试剂室提供。 阿特珠单抗(Atezolizumab,PD-L1 抑制剂)购自于美国基因工程技术公司。
1.1.3 试剂与仪器
细胞凋亡检测试剂盒(批号:WLA001a)、细胞周期检测试剂盒(批号:WLA010a)、全蛋白提取试剂盒(批号:WLA019)、BCA蛋白浓度测定试剂盒(批号:WLA004)、SDS-PAGE 凝胶快速制备试剂盒(批号:WLA013)、SDS-PAGE 电泳液(干粉)(批号:WLA026)、SDS-PAGE 蛋白上样缓冲液(批号:WLA005)、Bax antibody(批号:WL01637)、Bcl-2 antibody(批号:WL01556)、脱脂奶粉(批号:Q/NYLB 0039S)、羊抗兔IgG-HRP(批号:WLA023)、内参抗体β-actin(批号:WL01845)。
流式细胞仪(美国艾森生物公司)、Fresco低温冷冻离心机、MultiSkan3酶标(Thermo公司);Mini P-4 电泳槽、湿转电泳槽(Cavoy);分光光度计(Therno scientific);凝胶成像系统(上海天能科技有限公司);荧光定量PCR仪(Applied Biosystem)。
1.2 方法
1.2.1 PD-L1+Lewis 肺癌及Lewis 肺癌荷瘤鼠模型的建立
体外培养Lewis 肺癌细胞系,待细胞至增殖期,应用免疫磁珠分选出PD-L1+Lewis 肺癌细胞系。将PD-L1+Lewis 肺癌细胞系及Lewis 肺癌细胞系分别传代培养,将密度为2×107个/L 的PD-L1+Lewis 肺癌细胞悬液及Lewis 肺癌细胞悬液分别接种于小鼠右侧腋窝皮下(0.2 ml/只),分别构建PDL1+Lewis 肺癌/Lewis 肺癌荷瘤鼠模型。接种10 d后,待皮下移植瘤长至1 cm3左右,剥取1 只皮下移植瘤行病理检测均为癌细胞,说明造模成功。
1.2.2 实验分组
将造模成功的荷瘤鼠按随机数字表法分为以下8 组,每组6 只。PD-L1+Lewis 肺癌荷瘤鼠分组:模型组(Control 1 组)、PD-L1 抑制剂组(阿特珠单抗,ATZ组)、养阴扶正方组(YYFZD组)、联合组(养阴扶正方+阿特珠单抗,ATZ+YYFZD组)。Lewis 肺癌荷瘤鼠分组:模型组(Control 2组)、PD-L1抑制剂组(阿特珠单抗,ATZ组))、养阴扶正方组(YYFZD 组)、联合组(养阴扶正汤+阿特珠单抗,ATZ+YYFZD组)。
1.2.3 给药方式
1.2.3.1 模型组(Control 1组、Control 2组) 0.2 mL生理盐水灌胃,共10 d,第1 d、3 d、5 d 0.4 mL生理盐水腹腔注射。
1.2.3.2 PD-L1 抑制剂组(ATZ 组) 0.2 mL 生理盐水灌胃,共10 d,第1 d、3 d、5 d 0.4 ml阿特珠单抗(60 mg/kg)腹腔注射。
1.2.3.3 养阴扶正汤组(YYFZD 组) 0.2 ml养阴扶正汤(52 g/kg/d)灌胃,共10 d,第1 d、3 d、5 d 0.4 mL生理盐水腹腔注射。
1.2.3.4 联合组(ATZ+YYFZD 组) 0.2 ml 养阴扶正汤(52 g/kg/d)灌胃,共10 d,第1 d、3 d、5 d 0.4 ml阿特珠单抗(60 mg/kg)腹腔注射。
1.3 流式细胞术检测肺癌细胞调亡
停药第2日颈椎脱臼处死各组荷瘤小鼠,无菌剥取瘤组织,PBS冲洗,制成单细胞悬液,分别收集每组细胞至离心管中,4 ℃下离心2 000 r/min 离心6 min,用预冷的PBS 洗涤细胞3 次,低温下离心5 min,弃上清后加入结合缓冲液Bingbuffer重悬细胞,调整细胞浓度为2×105个细胞,加入5 ul膜联蛋白V-FITC(AnnexinV-FITC)结合液轻轻混匀,在室温下避光孵育10 min,加入5 ul碘化丙啶染色液,置于冰上遮光反应15 min,转入流式细胞仪进行上机检测,分析各组肺癌细胞凋亡率。
1.4 流式细胞术检测肺癌细胞周期。
将1.3 制成的单细胞悬液,调整细胞浓度1 ×106/ml,1 000 g,5 min ,沉淀细胞加入1 ml 70%的冷乙醇固定2 h至过夜,染色前用预冷的PBS 洗去固定液。加入100 μl RNase A,37 ℃水浴30 min,加入500 μl 碘化丙啶染色液混匀,4 ℃避光30 min。流式仪检测分析记录激发波长488 nm 处红色荧光。荧光信号变成电信号输出至计算机,荧光染料与细胞DNA 特异性结合,检测出细胞周期各个时像细胞比例。
1.5 Western-blot检测瘤组织中Bcl-2、Bax的表达
瘤组织匀浆,抽提组织蛋白,测定蛋白浓度,加入电泳缓冲液,混匀,100 ℃煮沸5 min,每个样分别取25 ug 上样,4% ~10% SDS-PAGE凝胶电泳分离,转印至PVDF 膜,50 g/L 脱脂奶粉室温封闭1h 后加入相应一抗,4℃孵育过夜,PBS-T 洗涤3 次,每次5 min,分别加入羊抗兔或羊抗鼠二抗室温孵育2 h,PBS-T 洗涤3 次,每次10 min,ECL 显影,以目的蛋白与内参蛋白βactin 光密度的比值表示目的蛋白的相对表达量。
1.6 RT-PCR检测瘤组织中Bcl-2、Bax的基因表达
①提取样本总RNA。②紫外吸收测定法检测浓度和纯度,RNA的纯度在1.8~2.2之间。③逆转录合成cDNA。④将所有cDNA 样品分别配置Realtime PCR 反应体系。体系配置如下:2×Master Mix10 μl,10 uM 的PCR 特异引物F0.5 μl,10 uM的PCR 特异引物R0.5 μl,加水至总体积为18 μl,轻弹管底将溶液混合,5 000 rpm 短暂离心。⑤加样:a将18 ul混合液加到96-PCR 板对应的每个孔中。b. 再加入对应的2 μl cDNA。c. 小心粘上Sealing Film 封口膜,并短暂离心混合。d.在设置PCR 程序前将准备好的PCR 板放在冰上。⑥将上述96-PCR 板置于Realtime PCR 仪上进行PCR 反应。按以下程序进行:95℃,30 秒;40 个PCR 循环(95 ℃,5 秒;60 ℃,40 秒)。为了建立PCR 产物的熔解曲线,扩增反应结束后,按95 ℃,10秒;60 ℃,60秒;95 ℃,15秒进行延伸;并从60 ℃缓慢加热到99 ℃(仪器自动进行-Ramp Rate 为0.05 ℃/秒)。⑦各样品的目的基因和内参分别进行Realtime PCR 反应,每个样本检测3个复孔。数据采用2-△△CT法进行分析。
2 统计分析
3 结果
3.1 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞凋亡的影响
如表1、图1 所示,Control 1 组凋亡率(88.35±1.64)%,Control 2 组凋亡率(87.16±1.85)%,两组比较,差异无统计学意义(P >0.05);在PD-L1+Lewis 肺癌中,与Control 1 组凋亡率比较,ATZ 组凋亡率升高,YYFZD 组凋亡率升高,差异有统计学意义(P <0.05);与ATZ 组凋亡率比较,ATZ+YYFZD 组凋亡率升高,差异有统计学意义(P <0.05)。在Lewis 肺癌,与Control 2 组凋亡率比较,ATZ 组凋亡率升高,YYFZD 组凋亡率升高,差异有统计学意义(P <0.05);与ATZ 组凋亡率比较,ATZ+YYFZD 组凋亡率升高,差异有统计学意义(P <0.05)。
表1 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞凋亡的影响(±s,%)Table 1 Effect of Yangyin Fuzheng Recipe on the apoptosis of PD-L1+Lewis/Lewis lung cancer cells

表1 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞凋亡的影响(±s,%)Table 1 Effect of Yangyin Fuzheng Recipe on the apoptosis of PD-L1+Lewis/Lewis lung cancer cells
注:①与Control 1组比较P <0.05;②与Control 2组比较,P <0.05;③与ATZ组比较,P <0.05
凋亡率PD-L1+Lewis肺癌(n=24)Control 1组88.35±1.64 YYFZD组96.08±1.85①ATZ组94.4±1.25①ATZ+YYFZD组95.32±1.45③Lewis肺癌(n=24)Control 2组87.16±1.85 ATZ+YYFZD组97.81±0.69③ATZ组95.46±1.18②YYFZD组96.67±0.90②
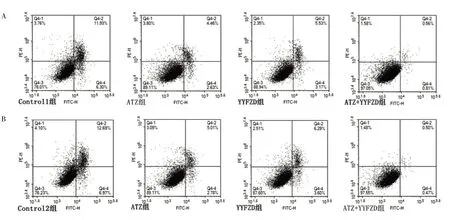
图1 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞凋亡的影响Figure 1 Effect of Yangyin Fuzheng Recipe on the apoptosis of PD-L1+Lewis lung cancer cell/Lewis lung cancer cell
3.2 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞周期的影响
如表2、图2 所示,Control 1 组G1 期细胞数(54.26±1.02)%、S 期细胞数(22.23±1.10)%、G2期细胞数(22.85 ± 0.76)%,Control 2 组G1 期细胞数(54.69 ± 1.10)%、S 期细胞数(21.26 ± 0.54)%、G2 期细胞数(23.66±0.60)%,两组比较,差异无统计学意义(P >0.05)。在PD-L1+Lewis 肺癌中,与Control 1 组比较,ATZ 组G1 期细胞数增多、S期、G2 期细胞数减少,差异有统计学意义(P <0.05);与Control 1组比较,YYFZD组G1期细胞数增多、S 期细胞数减少,差异有统计学意义(P <0.05);与ATZ 比较,ATZ+YYFZD 组G1 期细胞数增多,S 期、G2 期细胞数减少,差异有统计学意义(P <0.05)。在Lewis 肺癌,与Control 2 组比较,ATZ 组G1 期细胞数增多、S 期、G2 期细胞数减少,差异有统计学意义(P <0.05);与Control 2 组比较,YYFZD 组G1 期细胞数增多、S 期细胞数减少,差异有统计学意义(P <0.05);与ATZ 比较,ATZ+YYFZD组G1期细胞数增多、S期、G2期细胞数减少,差异有统计学意义(P <0.05)。
表2 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞周期的影响(±s,%)Table 2 Effect of Yangyin Fuzheng Recipe on cell cycle of PD-L1+Lewis/Lewis lung cancer cells

表2 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞周期的影响(±s,%)Table 2 Effect of Yangyin Fuzheng Recipe on cell cycle of PD-L1+Lewis/Lewis lung cancer cells
注:①与Control 1组比较,P <0.05;②与Control 2组比较,P <0.05;③与ATZ组比较,P <0.05。
Lewis肺癌(n=24)Control组ATZ组YYFZD组ATZ+YYFZD组PD-L1+Lewis肺癌(n=24)G1期54.26±1.02 66.02±0.78①59.65±0.78①76.57±0.63①G2期23.66±0.60 20.43±0.62②17.77±6.01 12.60±0.69③S期22.23±1.10 13.64±1.02①17.16±0.52①8.03±0.71①G2期22.85±0.76 18.69±0.93①22.79±0.40 13.73±0.04③G1期54.69±1.10 65.36±0.59②61.61±1.31②77.69±1.23②S期21.26±0.54 12.85±0.85②15.92±0.57②7.23±0.40②
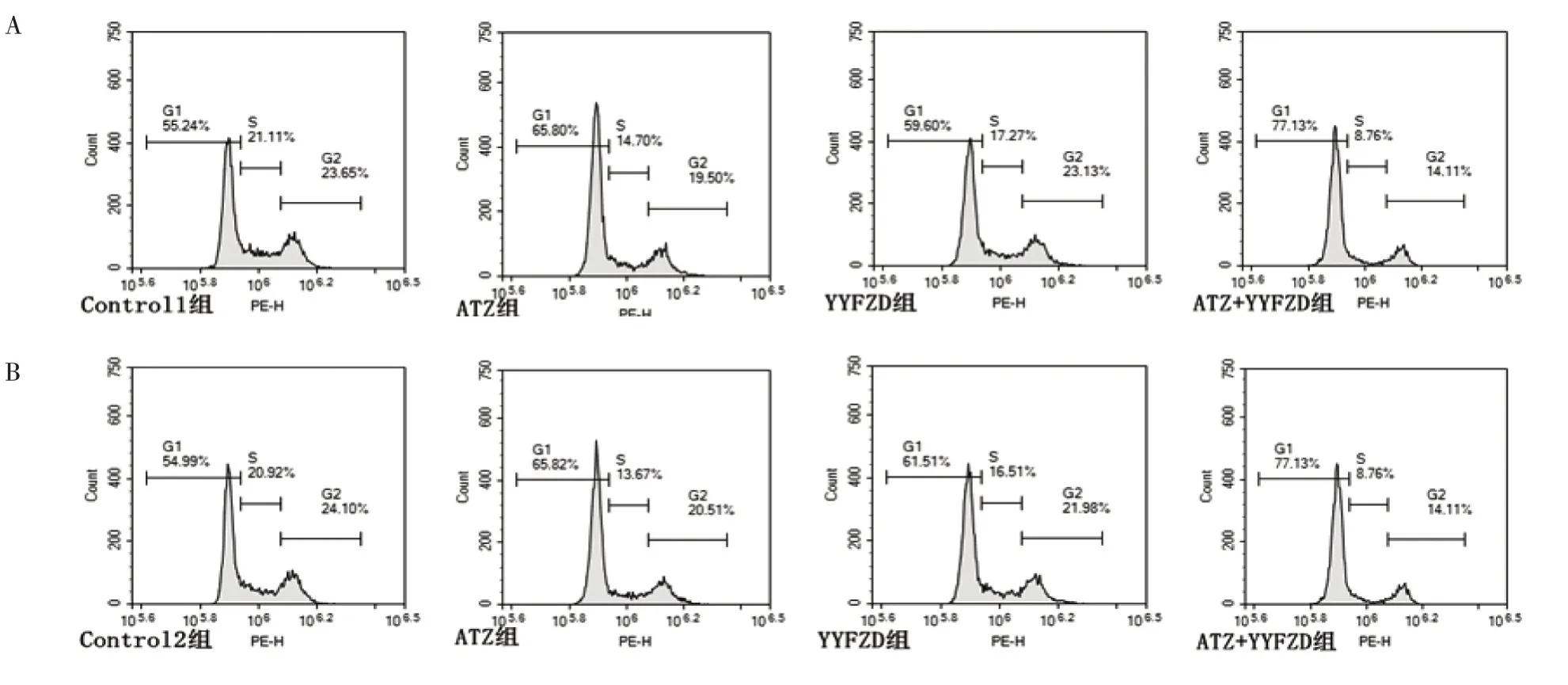
图2 养阴扶正方对PD-L1+Lewis肺癌/Lewis肺癌细胞周期的影响Figure 2 Effect of Yangyin Fuzheng Recipe on cell cycle of PD-L1+Lewis lung cancer cell/Lewis lung cancer cell
图3 PD-L1+Lewis肺癌/Lewis肺癌各组荷瘤鼠Bax、Bcl-2蛋白相对表达量的影响。Figure 3 Relative expression of Bcl-2 and Bax protein in lung carcinoma xenograft C57BL/6 mouse models of PD-L1+Lewis and Lewis lung cancer
3.3 养阴扶正方对PD-L1+ Lewis 肺癌/Lewis 肺癌Bax、Bcl-2蛋白表达的影响
如图3、图4 所示,Control 1 组和Control 2 组的Bcl-2、Bax 蛋白的相对表达量为(0.93 ± 0.04,0.85 ± 0.07)、(0.24 ± 0.06,0.20 ± 0.06),两组比较,差异无统计学意义(P >0.05)。
在PD-L1+Lewis 肺癌中,与Control 1 组比较,ATZ 组Bcl-2 蛋白相对表达量(0.37 ± 0.06)减少,Bax 蛋白相对表达量(0.94±0.12)增多,差异有统计学意义(P <0.05)。YYFZD 组Bcl-2 蛋白相对表达量(0.57±0.11)减少,Bax 蛋白相对表达量(0.61± 0.03)增多,差异有统计学意义(P <0.05)。与ATZ 组比较,ATZ+YYFZD 组Bcl-2 蛋白相对表达量(0.22 ± 0.06)减少,差异有统计学意义(P <0.05)。在Lewis 肺癌中,与Control 2比较,ATZ 组Bcl-2蛋白表相对达量(0.38±0.08)减少,Bax蛋白相对表达量(0.97±0.13)增多,差异有统计学意义(P <0.05)。YYFZD 组Bcl-2 蛋白相对表达量(0.6±0.11)减少,Bax 蛋白相对表达量(0.99±0.12)增多,差异有统计学意义(P <0.05)。与ATZ 组比较,Bcl-2 蛋白相对表达量(0.16 ± 0.04)减少,差异有统计学意义(P <0.05)。
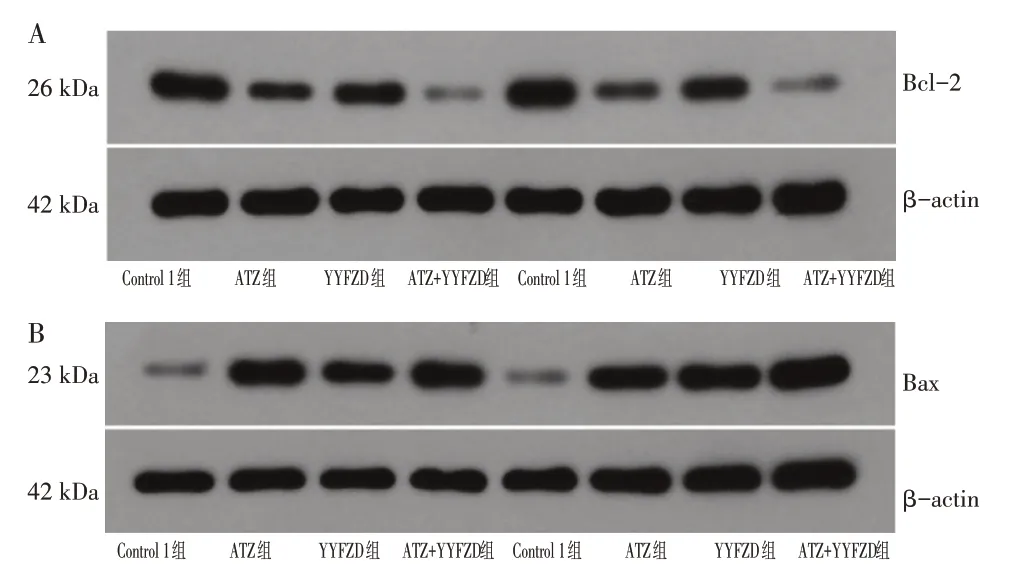
图4 West-blot检测PD-L1+Lewis肺癌/Lewis肺癌各组荷瘤鼠Bax、Bcl-2蛋白的水平Figure 4 Westblot analysis of Bcl-2 and Bax protein in lung carcinoma xenograft C57BL/6 mouse models of PD-L1+Lewis and Lewis lung cancer
3.4 养阴扶正方对PD-L1+ Lewis 肺癌/Lewis 肺癌Bax、Bcl-2基因表达的影响
如 图5 所 示,Control 1 组 与Control 2 组 的Bax、Bcl-2 的mRNA 的相对表达量分别为(1.00 ±0.07,1.01±0.18)、(1.0±0.08,1.00±0.07),两组比较,差异无统计学意义(P >0.05)。在PD-L1+Lewis 肺癌中,与Control 1 组比较,ATZ 组Bcl-2mRNA 相对表达量(0.43 ± 0.03)减少,BaxmRNA相对表达量(4.2±0.43)增多,差异有统计学意义(P <0.05);YYFZD 组Bcl-2mRNA 相对表达量(0.72 ± 0.05)减少,BaxmRNA 相对表达量(2.62 ±0.22)增多,差异有统计学意义(P <0.05)。与ATZ组比较,ATZ+YYFZD 组BaxmRNA 相对表达量(8.35 ± 0.40)增多,差异有统计学意义(P <0.05)。在Lewis 肺癌中,与Control 2比较,ATZ 组Bcl- 2mRNA 表 相 对 达 量(0.29 ± 0.02)减 少,BaxmRNA相对表达量(4.23±0.49)增多,差异有统计学意义(P <0.05),YYFZD 组Bcl-2 mRNA 相对表达量(0.65 ± 0.07)减少,BaxmRNA 相对表达量(2.62±0.07)增多,差异有统计学意义(P <0.05)。与ATZ 组比较,BaxmRNA 相对表达量(6.25±0.4)增多,差异有统计学意义(P <0.05)。
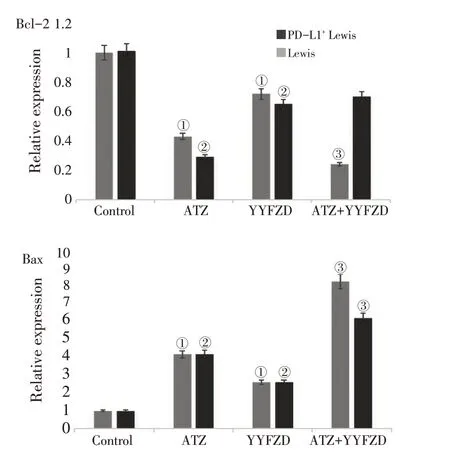
图5 PD-L1+Lewis肺癌/Lewis肺癌各组荷瘤鼠Bax、Bcl-2mRNA相对表达量的影响Figure 5 Relative expression of Bcl-2 and Bax mRNA in lung carcinoma xenograft C57BL/6 mouse models of PD-L1+Lewis and Lewis lung cancer
4 讨论
肺癌是世界上发病率和死亡率居均首位的恶性肿瘤,是导致癌症相关死亡的最主要原因[6]。在恶性肿瘤中,我国的肺癌男性发病率居第一位,女性发病率居第二位,死亡率男、女均第一位[7]。肺癌的整体疗效差,其原因之一仍在于肺癌细胞逃避了宿主的免疫监视和杀伤,导致了免疫逃逸的发生。PD-1及PD-L1 可表达于多种肿瘤表面的共抑制分子,其与肿瘤的发生、发展密切相关。研究表明,其在介导多种实体肿瘤细胞免疫逃逸中发挥重要作用。PD-1单抗以及PD-L1单抗在肺癌的治疗中取得了较好的临床疗效,因此,本研究应用免疫磁珠法分选出PD-L1+Lewis细胞,研究其与Lewis细胞的生物学行为的差异。本研究结果显示PD-L1+Lewis 细胞和Lewis 细胞在凋亡率、细胞周期、凋亡蛋白和抗凋亡蛋白的表达方面无差异,表明PD-L1+Lewis 细胞和Lewis 细胞的生物学行为相同,也就是说肺癌细胞表达PD-L1 并没有增加肺癌细胞的恶性行为。
中医理论认为肿瘤的本质是细胞水平上阴阳平衡失调,肿瘤细胞增殖失控(阳盛),凋亡不足(阴衰),细胞凋亡过少而增殖过多,阳盛阴衰形成肿瘤;当凋亡速度大于增殖速度,即阴阳趋向于动态平衡态,则恶性肿瘤消退[8]。本研究表明养阴扶正方促进PD-L1+Lewis 细胞和Lewis 细胞的凋亡,细胞周期阻滞于G1期,降低Bcl-2、增加Bax蛋白及mRNA 的表达。养阴扶正方通过益气养阴,解毒散结,纠正了荷瘤的“阴衰”,促进了肺癌细胞的凋亡,即细胞增殖与凋亡趋向于“阴平阳秘”的动态平衡态,则恶性肿瘤自然消退。同时养阴扶正方可能作用G1、S 期的限制点,G1 期细胞数增多,S期细胞数减少,使细胞周期阻滞于G1 期,进入细胞周期的细胞数减少,发生凋亡的细胞数增多,抑制了肿瘤细胞的增殖。
阿特珠单抗是一种针对PD-L1 的选择性人源化单克隆IgG1 抗体,作用于PD-L1,阻止其与PD-1的相互作用,阻断T淋巴细胞负性调控的来源,逆转肿瘤免疫耐受性并重新建立针对肿瘤细胞的适应性免疫应答,以此来达到免疫治疗的目的。该药用于Ⅲ、Ⅳ期NSCLC、无中枢神经系统转移的NSCLC、经含铂双药治疗后进展的晚期非小细胞肺癌、Ⅳ期及新发转移的非鳞NSCLC 的治疗[9]。本研究表明阿特珠单抗可促进PD-L1+Lewis、Lewis 细胞的凋亡,将细胞周期阻滞于G1期,降低Bcl-2 的蛋白及mRNA 的表达,促进Bax的蛋白及mRNA 的表达,与养阴扶正方联合应用,上述作用得到了加强,推测其机制可能是阿特珠单抗阻止肺癌细胞上的PD-L1与T细胞上PD-1 的相互作用,逆转了肺癌细胞的免疫耐受,T 细胞的免疫功能得到了有效的发挥,同时养阴扶正方增强了阿特珠的功效,其机制将在后续的实验中证实。
综上所述,PD-L1+Lewis 肺癌、Lewis 肺癌细胞的生物学行为相同,养阴扶正方通过调节Bax、Bcl-2 蛋白及mRNA 表达,促进PD-L1+Lewis 肺癌细胞、Lewis肺癌细胞凋亡,使细胞周期阻滞于G1期,增加了阿特珠单抗的疗效,养阴扶正方与PD-L1抗体的联合应用,为肺癌的治疗提供了新的思路。
——养阴为上 少辛多酸

