基于PEDOT:PSS和HRP的电化学酶传感器的制备与电催化应用
邵 波,闫丽君,李晓燕,朱俊怡,杨翁琳,习亚茹,党文迪,孙 伟
(海南师范大学 化学与化工学院,海口市功能材料与光电化学重点实验室,海南 海口 571158)
导电聚合物是一类具有多孔结构的高导电性的聚合物[1,2],可以在多种氧化态之间相互转化,常用于固定生物分子构建电化学传感器。聚(3,4-乙烯二氧噻吩)(PEDOT)是一种不溶于水的热塑聚合物,具有良好的导电性、稳定性、高度透明性等独特性质[3,4]。由于PEDOT不溶于大多数有机溶剂,故在PEDOT分子聚合过程中掺入聚乙烯苯磺酸(PSS)可得到在有机溶剂中稳定存在且保持良好导电性的有机高分子聚合物材料聚(3,4-乙烯二氧噻吩)/聚乙烯苯磺酸(PEDOT:PSS)[5]。PEDOT:PSS具有很好的成膜性、高透明性、化学稳定性以及易制备等特点,已被应用于电化学传感器、超级电容器、石墨烯薄膜等领域[6,7]。
辣根过氧化物酶(HRP)是由酶蛋白和铁卟啉组成,内含有活性中心亚铁红素,可以用于研究酶催化反应的热力学性质、动力学性质以及分子结构性质。由于HRP的活性中心被包埋在蛋白质外壳中导致它的电活性中心与电极间的传递速度较慢,因此可采用修饰剂和促进剂来加速电子转移的进程[8,9]。
电化学生物传感器是由电化学分析法和生物传感技术相结合,具有灵敏度高、检测成本低、操作简便等优良特性,在医学、农业、工业等方面受到了广泛关注,开发高性能电化学生物传感器成为当今发展趋势。本文开展了基于PEDOT:PSS-HRP的电化学酶传感器的研究,并将其应用于电催化分析及药物样品的检测。
1 材料与方法
1.1 仪器与试剂
CHI 1210A型电化学工作站,上海辰华仪器公司;Nicolet 6700傅里叶红外光谱仪,美国Thermo Scientific公司;Hitachi U-3900型紫外分光光度计,日本Hitachi仪器公司;三电极系统:自制修饰电极为工作电极、银-氯化银电极为参比电极、铂丝电极为对电极。
聚(3,4-乙烯二氧噻吩)/聚乙烯苯磺酸(PEDOT:PSS),酷尔化学科技有限公司;辣根过氧化氢酶(HRP),上海雪满生物科技有限公司;三氯乙酸(TCA),科密欧试剂化学有限公司;医用换肤液(35%TCA),上海伊卡生物技术有限公司;石墨粉(30 μm),上海华谊集团华原化工有限公司;N-己基吡啶六氟磷酸盐(HPPF6),兰州雨陆精细化工有限公司;亚硝酸钠(NaNO2),上海化学试剂厂;PBS溶液作为支持电解质,在进行实验前需通入N2除氧处理约30 min。
1.2 材料与修饰电极的制备
按照文献制备CILE电极[10],具体如下:将HPPF6和石墨粉按比例混合,研磨均匀后填充至玻璃管内(φ=4 mm),在打磨纸上将电极界面打磨光滑即可使用。
将100 μL 30 mg/mL 的HRP 溶液与100 μL 9 mg/mL PEDOT:PSS 溶液混合振荡3 min 后,采用滴涂法在CILE的表面滴涂6 μL的混合液,自然晾干后得到电化学酶传感器(PEDOT:PSS-HRP/CILE)。
2 结果与讨论
2.1 PEDOT:PSS-HRP复合材料的光谱表征
图1(A)是PEDOT:PSS-HRP与HRP的FT-IR图。天然酶HRP结构中酰胺在1700~1600 cm-1和1640~1500 cm-1有振动吸收峰[11],PEDOT:PSS-HRP复合材料红外光谱图中酰胺在1652.78 cm-1和1572.42 cm-1有明显吸收峰,与天然HRP吸收峰位置重合,说明HRP在PEDOT:PSS中能保持正常的天然结构。
图1(B)是PEDOT:PSS-HRP 与HRP 的UV-vis 谱图,由图1(B)可知PEDOT:PSS-HRP 混合溶液的吸收峰与HRP 的Soret 特征吸收峰均出现在401 nm,说明HRP 在PEDOT:PSS 溶液中可以稳定地存在,没有发生变性。
2.2 电化学表征
利用循环伏安法(CV)研究了PEDOT:PSS-HRP/CILE的电化学响应,结果如图2(A)所示,在PEDOT:PSS/CILE(曲线b)上未出现氧化还原峰,表现出稳定的背景电流。在PEDOT:PSS-HRP/CILE(曲线a)上有明显的氧化还原特征峰,且对称性良好,氧化峰电位(Epa)为-0.111 V,还原峰电位(Epc)为-0.145 V,说明HRP在修饰电极表面的直接电子转移得以实现。
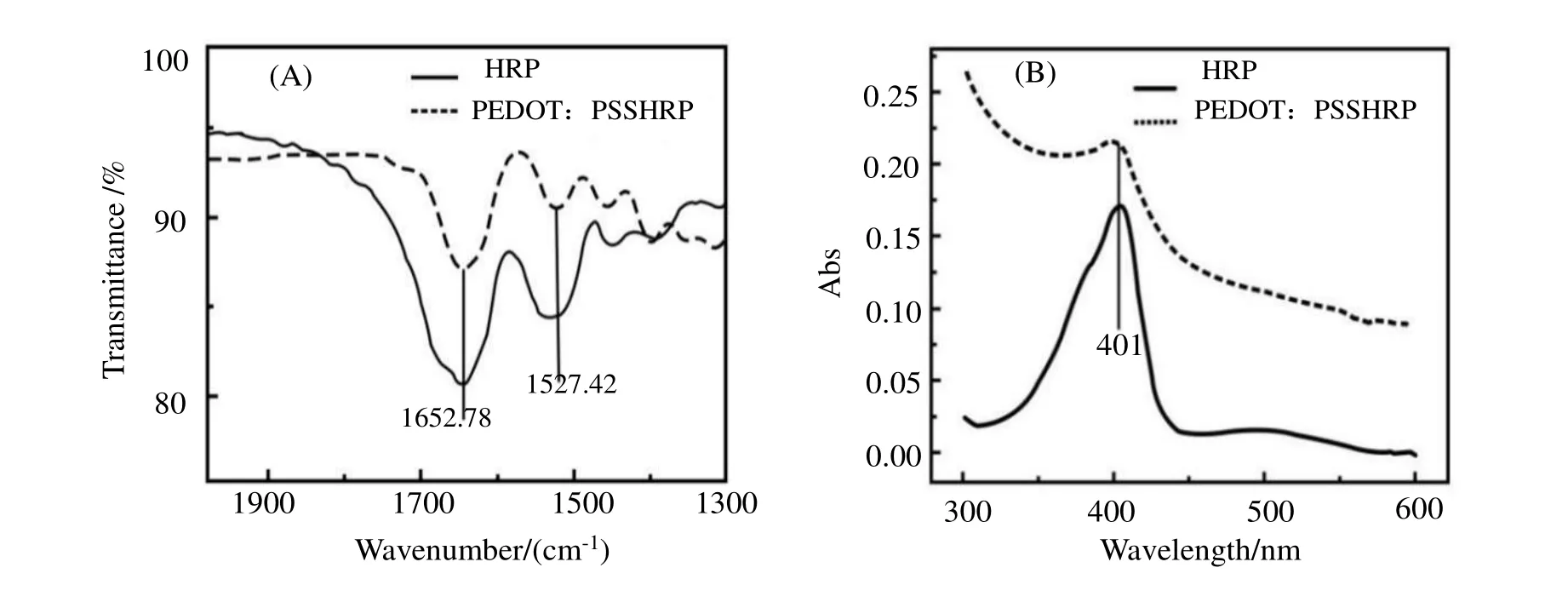
图1 PEDOT:PSS-HRP与HRP的FT-IR(A)和UV-vis吸收光谱图(B)Figure 1 (A)FT-IR spectra and(B)UV-visible absorption spectra of HRP and PEDOT:PSS-HRP solution
电化学交流阻抗谱图(EIS)能够有效地反映电极界面阻抗信息,电子转移电阻(Ret)可以通过测量阻抗谱的半圆弧直径求得。本研究考察了不同修饰电极在0.1 mol/L KCl和10.0 mmol/L K3[Fe(CN)6]混合液中的交流阻抗谱,结果如图2(B)所示,三种电极的电阻值分别为:34.178 Ω(PEDOT:PSS/CILE,曲线a)、109.749 Ω(CILE,曲线b)和53.486 Ω(PEDOT:PSS-HRP/CILE,曲线c),这是由于PEDOT:PSS具有高导电性可以有效提高电子的传递速率,减少了电子转移界面电阻,而生物大分子HRP在电极表面的存在阻碍了电子转移,增大了界面电阻。
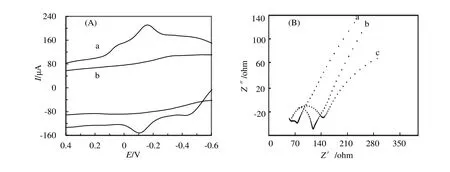
图2 (A)PEDOT:PSS-HRP/CILE(a)与PEDOT:PSS/CILE(b)在pH 2.0的PBS溶液中的循环伏安图(扫速为0.1 V/s);(B)PEDOT:PSS/CILE(a),CILE(b),PEDOT:PSS-HRP/CILE(c)在0.1 mol/L KCl和10.0 mmol/L K3[Fe(CN)6]混合液中的交流阻抗谱Figure 2 (A)Cyclic voltammogram of PEDOT:PSS-HRP/CILE(a)and PEDOT:PSS/CILE(b)in PBS at the scan rate of 0.1V/s;(B)Electrochemical impedance spectra of PEDOT:PSS/CILE(a),CILE(b),PEDOT:PSS-HRP/CILE(c)in 0.1 mol/L KCl and 10 mmol/L K3[Fe(CN)6]mixture
2.3 扫速对电化学行为影响的研究
在0.1~0.9 V/s范围内研究了PEDOT:PSS-HRP/CILE上扫速对电化学行为的影响,结果如图3(A)所示。峰电流随着扫速的增加而增大,氧化峰的电位向正方向移动,还原峰电位则向负方向移动;Ipa和Ipc与扫速呈良好的线性关系(如图3-B所示),线性回归方程分别为Ipc=245.34υ+8.58(γ=0.991)和Ipa=-137.2υ-0.98(γ=0.988),表明该电极反应是一个表面控制过程。Ep 和lnv 的关系如图3(C)所示,线性方程表示为Epa(V)=0.020 lnυ-0.045(γ=0.974)和Epc(V)=-0.018 lnυ-0.235(γ=0.973)。通过Laviron 方程[12]求出电子转移数(n)、电子转移系数(α)和电子转移速率常数(ks)的值分别为:n=1.05,α=0.51,ks=3.52 s-1。本体系的ks值大于文献中所报道的电极体系,如ZnO-graphene-Nafion-HRP(1.94)[13],Nafion/HRP/Co3O4-GR/CILE(2.90)[14]和Nafion-songel-carbon-HRP/GCE(1.29)[15],表明具有较快的转移速率。
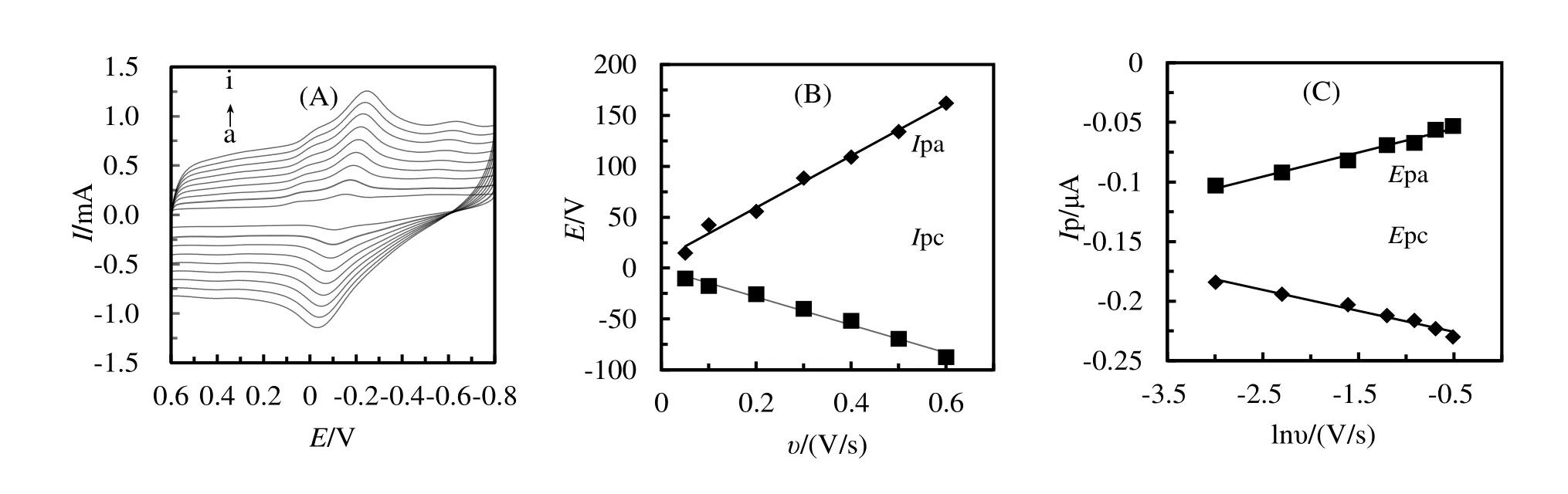
图3 (A)EDOT:PSS-HRP/CILE在不同扫速下的循环伏安曲线(a-i:0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 V/s);(B)Ipa和Ipc与扫速的关系图;(c)Ep和lnυ的关系图Figure 3 (A)Cyclic voltamograms at different scan rate(a-i:0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 V/s);(B)the linear relationship between peak current and scan rate;(C)the linear relationship between Ep and lnυ
2.4 电催化性能
运用循环伏安法考察了修饰电极在pH=2的PBS中对不同浓度下TCA的催化性能。如图4(A)所示,随着体系中TCA浓度的增大,还原峰逐渐增大,氧化峰逐渐减小且最后消失。
还原峰电流值与TCA 浓度在0.0~300.0 mmol/L 范围内呈线性关系(如图4B 所示),线性回归方程为I(mA)=0.003C+0.006(γ=0.998),检测限为0.67 mmol/L(3σ)。当TCA浓度大于300.0 mmol/L时,还原峰的电流趋于稳定,表明反应过程符合Michaelis-Menten动力学方程。通过表观米氏常数(KappM)可以了解HRP在修饰电极上的催化效果,利用Lineweaver-Burk 方程[16]和双倒数作图法求得KappM为3.51 mmol/L,该数据小于文献报道的体系,如HRP–PVA–C12–C12–C12/GCE(5.66 mmol/L)[17],HRP-agarosehydrogel-[bmim][PF6]/GCE(52.0 mmol/L)[18],说明HRP表现出较好的催化性能。该催化反应方程式如下所示。
HRP Fe(Ⅲ)+e →HRP Fe(Ⅱ)
2 HRP Fe(Ⅱ)+Cl3CCOOH+H+→2 HRP Fe(Ⅲ)+Cl2CHCOOH+Cl-
HRP Fe(Ⅱ)+e →HRP Fe(Ⅰ)
2 HRP Fe(Ⅰ)+Cl2CCOOH+H+→2 HRP Fe(Ⅱ)+ClCH2COOH+Cl-
2 HRP Fe(Ⅰ)+ClCH2COOH+H+→2 HRP Fe(Ⅱ)+CH3COOH+Cl-
同时通过循环伏安法对NaNO2进行了研究,如图4(C)所示。随着NaNO2浓度的增加,在-0.55 V处还原峰明显增大,氧化峰逐渐减小最终消失。由图4(D)可知NaNO2在0.5~9.0 mmol/L范围内浓度与还原峰电流呈线性关系,线性方程为:I(mA)=0.047C+0.14(γ=0.991),检测限为0.01 mmol/L,KappM为18.47 mmol/L,表明PEDOT:PSS-HRP/CILE对NaNO2也有良好的电化学响应。
2.5 实际样品的检测
采用标准曲线法和标准加入法[19]将PEDOT:PSS-HRP/CILE 用于医用换肤液(含35%TCA)中TCA 的含量检测,结果如表1,回收率在94.0%~105.6%之间,表明该检测方法可用于实际样品中TCA的分析,具有较好的测定结果。
3 结论
采用HPPF6修饰的碳糊电极作为基底电极,以PEDOT:PSS和HRP作为修饰剂制备了电化学生物传感器(PEDOT:PSS-HRP/CILE)。傅立叶变换红外光谱和紫外光谱测定结果表明HRP 在PEDOT:PSS 中保持生物结构。PEDOT:PSS-HRP/CILE对TCA和NaNO2的检测具有较宽的检测范围,对实际样品中TCA的检测取得较好的结果。
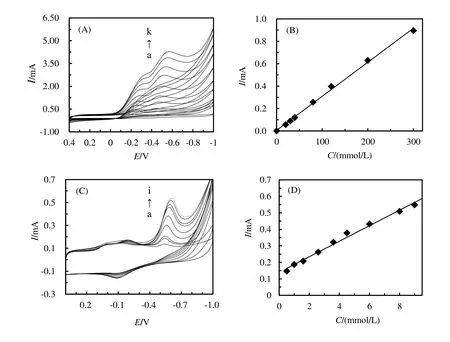
图4 (A)修饰电极在不同浓度下的TCA溶液中的循环伏安图;(B)还原峰电流随TCA浓度的变化曲线;(C)修饰电极在不同浓度下的NaNO2中的循环伏安图;(D)还原峰电流随NaNO2浓度的变化曲线Figure 4 (A)Cyclic voltammograms of modified electrodes in different concentrations of TCA solution(a-k is 0.1,0.2,0.3,0.4,0.8,1.2,2.0,3.0,4.0,5.0,6.0 mol/L,respectively);(B)peak current change with different concentrations of TCA;(C)Cyclic voltammograms of modified electrodes in different concentrations of NaNO2(a-i:0.5,1.0,1.6,2.6,3.6,4.5,6.0,8.0,9.0 mmol/L);(D)peak current change with different NaNO2 concentration

表1 生物样品中TCA的检测结果(n = 3)Table 1 Test results of TCA in biological samples(n = 3)

