蛔虫感染对过敏性哮喘小鼠免疫机制的影响*
★ 杨小军 白高波 金桂林 杨军平 彭国华(.江西中医药大学附属医院 南昌 330006;2.南昌市疾病预防控制中心 南昌 330038)
哮喘发病机制复杂[1],近年来的研究表明过敏性哮喘发病率的不断攀升与当地感染性疾病发病率的下降存在密切关系,两者呈正相关[2-6]。如近年报道:全世界范围哮喘分布表现为发达国家高于发展中国家,城市高于农村。根据疾病预防与控制中心的数据,美国近500 万儿童被确诊患有哮喘病。尽管采取了积极的研究和预防措施,在1980~1993 年间,美国儿童与哮喘病相关的死亡率仍上升了78%,而在我国北京市1990~2000 年l0年间儿童哮喘患病率也从0.78%上升到2.06%,增加了1.6 倍。对此有人认为哮喘发病率的增加可能是因为发达地区儿童与病原菌接触的机率减少,使Thl/Th2 免疫反应失衡并偏向于有利于哮喘发作的Th2 型反应所致,但对此平衡理论争论颇多。众所周知,过敏性疾病和蠕虫感染都是以IgE 水平增高,嗜酸性粒细胞浸润为特征的Th2 型反应为特征[2,7]。不同的是,对于前者Th2 反应是人体异常的免疫调节反应,对于后者它却是机体对抗蠕虫感染中的一种重要保护机,当蠕虫入侵人体时,Th2 型细胞通过产生IL-4 和IL-5 诱导体液免疫应答,产生多种高水平的抗体,来抑制蠕虫感染[7-8]。然而,大量流行病学调查资料显示,在蠕虫感染高发区,遗传性过敏症和哮喘等过敏性疾病的发病率较低[9],也就是说尽管蠕虫及过敏原皆可诱发Th2 反应,而前者却对后者有抑制作用。
1 材料与方法
1.1 蛔虫卵的收集与制备
1.1.1 采集 对蛔虫感染者驱虫治疗(均知情同意),选用噻嘧啶 10 mg/kg 剂量,一次顿服,从服药后的患者粪便中收集蛔虫成虫。
1.1.2 培养 自雌性蛔虫成虫子宫远端分离虫卵,保存于 0.1N 硫酸中,调整虫卵浓度大约为25 个/μL避光培养,每周摇动2~3 次,25 ℃左右避光培养3周左右,至在显微镜下观察90%以上的虫卵发育为感染期虫卵[10]。
1.1.3 蛔虫卵剂量的确定 将发育为感染期的蛔虫卵,经过两轮多次反复抽样后调定到2000 个/mL,吸取0.5 mL 预先分装于EP 管中,置5~10℃冰箱冷藏备用。
1.2 动物分组与模型建立
1.2.1 实验动物与分组 SPF 级别C57BL/6 近交小鼠(购自上海斯莱克实验动物中心)60 只,体重18~20g,雌雄兼用。60 只小鼠随机分为4 组,每组15 只(A 组:蛔虫感染组;B 组:过敏性哮喘组;C组:蛔虫感染合并过敏性哮喘组;D 组:正常对照组)。
1.2.2 动物饲养条件 小鼠在洁净室内饲养,使用购入的真空消毒包装饲料,饮用煮沸消毒开水,鼠笼垫料经高压灭菌消毒,以防其他病原体交叉感染。垫料每隔3~4 天更换以保持小鼠干燥生活环境。
1.2.3 建立感染蛔虫小鼠模型[11]小鼠感染前均饥饿12 h,可进水。次日早上进行灌胃感染。感染剂量均为每只小鼠1000 个卵/(0.5 mL,只)。感染后,将小鼠按A、C 组分笼饲养。
1.2.4 建立过敏性哮喘小鼠模型 模型组分别于第1 天、第8 天用新鲜配制的OVA(Grade V)1mg+氢氧化铝200mg+生理盐水1mL 混悬液在小鼠两腹股沟、腹、前足跖,共4 点做皮下注射,每点0.2mL、同时腹腔注射0.2 mL。正常对照组以生理盐水代替OVA 致敏。于实验第15 天,将小鼠置于20 cm×20 cm×15 cm 大小的密闭容器中,由PARI BOY 高频雾化器(CE,Germany)提供雾化动力,以1% OVA(Grade II)进行雾化吸入激发,每次雾化30min,连续6d。正常对照组以生理盐水代替OVA 激发。
1.2.5 建立蛔虫感染合并过敏性哮喘小鼠模型 将感染蛔虫的C 组小鼠按1.2.4 步骤造模。
1.3 外周血嗜酸性粒细胞直接计数(EOS) 造模21 天后(通过预实验此时免疫反应最强烈)对蛔虫感染组、过敏性哮喘组、蛔虫感染合并过敏性哮喘组以及正常对照组的小鼠,以10%异戊巴比妥钠腹腔麻醉(0.1 mL/kg),75%乙醇浸泡3min 消毒皮肤,取仰卧位固定于手术台上,打开胸腔,无菌心脏采血1.5 mL,其中0.5 mL 注入EDTA-K2 抗凝管中用于全自动血细胞分析仪(深圳迈瑞公司生产的6800)计数嗜酸性粒细胞;其余血液注入不加抗凝剂的干净EP 管中,离心分离出血清后放冰箱冷藏备用。
1.4 血清总IgE 测定 取备用血清0.2 mL,在日立生化仪((HITACHI 7180)上检测血清中总IgE 的浓度。
1.5 血清中IL-4、IL-10、TNF-α、INF-Υ 水平测定 采用ELISA 试剂盒测定各组小鼠血清中IL-4、IL-10、TNF-α、INF-Υ 的浓度。
1.6 T 淋巴细胞免疫分型测定 用流式分析仪(Beckman Coulter Cytomics FC500)检测外周血中CD3、CD4、CD8 淋巴细胞绝对数及CD4/CD8 比值。
1.7 统计学方法 对组间数据用SPSS17.0 软件进行t检验。
2 结果
2.1 外周血嗜酸性粒细胞直接计数(EOS)和总IgE 的测定 蛔虫感染组、过敏性哮喘组、蛔虫感染合并过敏性哮喘组和正常对照组的每只小鼠经心脏穿刺取血后,分别测定全血的EOS 及血清的总IgE 浓度。结果见表1。
表1 各组小鼠嗜酸性粒细胞计数(EOS)和总IgE结果比较(,n=15)
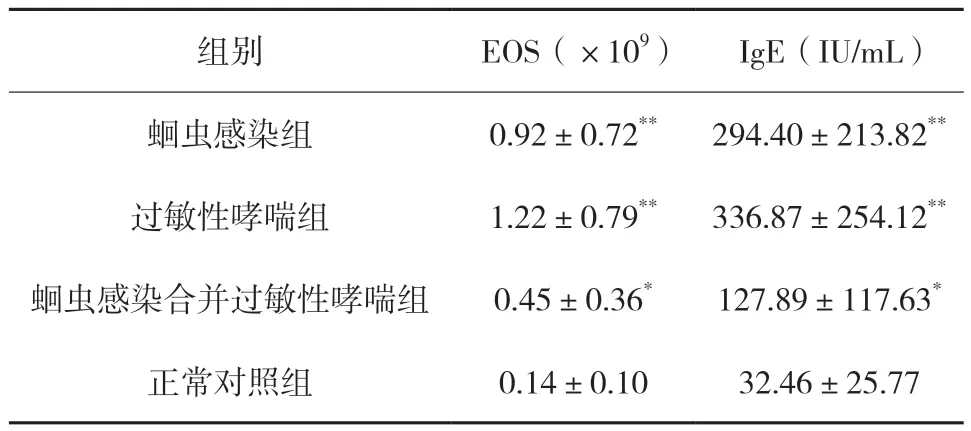
表1 各组小鼠嗜酸性粒细胞计数(EOS)和总IgE结果比较(,n=15)
注:与正常对照组相比较,*P<0.05;与正常对照组相比较,**P<0.01。
从表1 的结果中可以看出,各组实验动物EOS比较,蛔虫感染组、过敏性哮喘组明显高于正常对照组(P<0.01),蛔虫感染合并过敏性哮喘组高于正常对照组(P<0.05),过敏性哮喘组高于蛔虫感染组,但差异无统计学意义(P>0.05);蛔虫感染组和过敏性哮喘组均高于蛔虫感染合并过敏性哮喘组(P<0.05);各组实验动物总IgE 比较,蛔虫感染组、过敏性哮喘组明显高于正常对照组(P<0.01),蛔虫感染合并过敏性哮喘组高于正常对照组(P<0.05),过敏性哮喘组高于蛔虫感染组,但差异无统计学意义(P>0.05);蛔虫感染组和过敏性哮喘组均高于蛔虫感染合并过敏性哮喘组(P<0.05)。
2.2 血清中细胞因子的表达 蛔虫感染组、过敏性哮喘组、蛔虫感染合并过敏性哮喘组和正常对照组的每只小鼠经心脏穿刺取血后,测定血清中细胞因子的表达。结果见表2。
表2 各组小鼠血清细胞因子水平比较(,n=15) pg/ml

表2 各组小鼠血清细胞因子水平比较(,n=15) pg/ml
注:*与正常对照组相比较P<0.05;**与正常对照组相比较P<0.01。
由表2 结果可以看出,各组实验动物IL-4、IL-10、TNF-α 比较,蛔虫感染组、过敏性哮喘组明显高于正常对照组(P<0.01),蛔虫感染合并过敏性哮喘组高于正常对照组(P<0.05),过敏性哮喘组高于蛔虫感染组,但差异无统计学意义(P>0.05);蛔虫感染组和过敏性哮喘组均高于蛔虫感染合并过敏性哮喘组(P<0.05);各组实验动物INF-Υ 比较,蛔虫感染组、过敏性哮喘组、蛔虫感染合并过敏性哮喘组均高于正常对照组,但差异无统计学意义(P>0.05);蛔虫感染组和过敏性哮喘组均高于蛔虫感染合并过敏性哮喘组,但差异无统计学意义(P>0.05)。
2.3 T 淋巴细胞免疫分型测定 蛔虫感染组、过敏性哮喘组、蛔虫感染合并过敏性哮喘组和正常对照组的每只小鼠经心脏穿刺取血后,计数全血中的T淋巴细胞绝对数。结果见表3。
表3 各组小鼠全血CD细胞绝对计数结果比较(,n=15)

表3 各组小鼠全血CD细胞绝对计数结果比较(,n=15)
注:*与正常对照组相比较P<0.05;**与正常对照组相比较P<0.01。
由表3 结果可以看出,各组实验动物CD3、CD4、CD8 比较,蛔虫感染组、过敏性哮喘组明显高于正常对照组(P<0.01),蛔虫感染合并过敏性哮喘组高于正常对照组,但差异无统计学意义(P>0.05);蛔虫感染组和过敏性哮喘组均高于蛔虫感染合并过敏性哮喘组(P<0.05);各组实验动物CD4/CD8 比较,蛔虫感染组、过敏性哮喘组均高于正常对照组(P<0.05)、蛔虫感染合并过敏性哮喘组高于正常对照组,但差异无统计学意义(P>0.05)。
3 讨论
Araujo 等[12]研究显示,有寄生虫感染的患者血清总IgE 和寄生虫特异性IgE 水平高于未感染者,而未感染者的变应原特异性IgE 水平高于前者,变应原皮肤试验阳性率也高于感染者,提示寄生虫特异性IgE 可能对变应原特异性IgE 有抑制作用。本研究结果显示,蛔虫感染合并过敏性哮喘组血清总IgE 高于正常对照组,但低于蛔虫感染组和过敏性哮喘组,可能与蛔虫分泌的特异性抗体对过敏性哮喘产生的抑制作用有关。
过敏性哮喘总的来说存在Th 细胞功能失衡,Th2 细胞活化亢进的现象[13]。已有的研究表明,细胞因子、抗原、抗原递呈细胞(APC)、共刺激信号以及一些基因调控因子均为Thl/Th2 极化提供了重要信号[14]。本研究中各组实验动物IL-4、IL-10、TNF-α 比较,蛔虫感染组、过敏性哮喘组明显高于正常对照组(P<0.01),蛔虫感染合并过敏性哮喘组高于正常对照组(P<0.05),但低于蛔虫感染组和过敏性哮喘组,与Shirai 等[15]的研究结果相一致。
本研究结果显示,蛔虫感染组、过敏性哮喘组CD3、CD4 均明显高于蛔虫感染合并过敏性哮喘组和正常对照组,CD8 比较差异无统计学意义,提示寄生虫感染和过敏性疾病可刺激T 淋巴细胞分泌细胞因子,使机体的免疫功能亢进。而蛔虫感染合并过敏性哮喘可能使机体的免疫功能受到抑制,本研究的CD4/CD8 结果也符合这一推断。
通常认为,蠕虫感染可造成宿主明显的慢性免疫改变,一般是使Thl/Th2 极化向着强化Th2 的状态偏移,并伴随有高嗜酸细胞血症、高血清IgE 以及Th2类细胞因子如IL-4、IL-5和IL-10的表达[16]。蛔虫可能主要是通过免疫耐受和免疫剌激实现对过敏反应的抑制作用。虽然多数研究支持寄生虫感染对哮喘的抑制作用,但蠕虫种类繁多,各虫种间差异较大,抗原表位复杂,即使是同一虫种的不同阶段引起的免疫应答也不尽相同,多种因素可以影响其对过敏反应的结果,比如蛔虫感染组的各项指标会不会与其被感染的天数有关?这些有待于今后的实验去进一步证实。

