原发性肺肉瘤样癌的18F-FDG PET/CT特征及代谢特点
武含露,谢新立,晁芳芳,尚康康,程兵
郑州大学第一附属医院核医学科,河南郑州 450052; *通讯作者 程兵 chengbing@zzu.edu.cn
原发性肺肉瘤样癌(pulmonary sarcomatoid carcinoma,PSC)是一种罕见的、高度侵袭性的非小细胞肺癌(non-small cell lung cancer,NSCLC),占肺恶性肿瘤的0.1%~0.4%[1],其临床表现及影像学表现无特异性,故与其他亚型NSCLC 鉴别困难。PET/CT 是一种分子影像学检查方法,能够从解剖及代谢方面提供更加精确的诊断。目前关于PSC 的PET/CT 影像学表现的相关研究鲜有报道。本研究拟回顾性分析PSC 的18F-FDG PET/CT 影像学表现及代谢特点,以期为提高对PSC 的认识及诊断准确率提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2016年2月—2019年11月郑州大学第一附属医院经穿刺或术后病理确诊的PSC 患者27 例,其中男23 例,女4 例;年龄49~85 岁,平均(65.4±9.9)岁。纳入患者均在治疗前行18F-FDG PET/CT 检查,主要临床症状为咳嗽、咳痰、胸闷、胸痛、咯血等。2 例为体检时发现,19 例有长期吸烟史。按照国际肺癌研究学会发布的第8 版肺癌分期标准[2],27 例患者中,Ⅰ期6 例,Ⅱ~Ⅳ期21 例。随机选取同时期经病理确诊为NSCLC 患者200 例,其中Ⅰ期肺腺癌及肺鳞癌各50 例,Ⅱ~Ⅳ期腺癌及鳞癌各50 例。
1.2 仪器与方法 采用Siemens PET/CT 扫描仪(Biography 64 Truepoint)。18F-FDG 由日本住友集团医用回旋加速器生产并通过自动化合成模块自动化合成,放化纯度>98%。检查前患者禁食6 h 以上,血糖<8.0 mmol/L。经静脉注射显像剂18F-FDG,嘱患者于安静状态下休息60 min 后进行扫描。CT 扫描参数:管电压120 kV,管电流120~250 mAs,层厚3 mm。PET 采用3D 扫描模式,头部扫描3 min/床位,体部扫描1.5 min/床位,扫描范围从颅顶至股骨上段。用CT 进行衰减校正后进行迭代法重建。重建后的图像数据传入Syngo 工作站,并使用TrueD 软件将PET及CT 图像进行融合,重建后得到全身或局部轴位、冠状位及矢状位PET、CT、PET/CT 融合图像。
1.3 图像分析 由2 名具有10年以上工作经验的核医学科副主任医师采用盲法阅片,结论不一致时由第3 位医师做出分析。分别记录病灶的部位、大小、密度、边缘、胸膜受累情况、淋巴结转移及远处转移,同时测量病变部位的最大标准化摄取值(SUVmax)并记录代谢特点。
1.4 统计学方法 采用SPSS 21.0 软件,符合正态分布的计量资料采用±s表示,组间比较采用独立样本t检验。不符合正态分布的计量资料采用M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。通过受试者工作特征(ROC)曲线获得诊断PSC 的阈值。P<0.05 表示差异有统计学意义。
2 结果
2.1 影像学表现 26 例PSC 为肺内单发病灶,1 例同侧肺可见转移。27 枚病灶最大径1.5~11.8 cm,平均(5.36±2.62)cm。其中最大径≥3 cm 23 例,≥5 cm 14 例。淋巴结转移14 例,SUVmax 为2.6~33.2。病灶体积较小时密度多较均匀,FDG 摄取较均匀。肿瘤较大时内可见液化坏死区,FDG 摄取不均匀增高,液化坏死区放射性分布稀疏。27 例病灶SUVmax 为7.7~52.3,平均21.74±10.96。影像学表现见图1、2 及表1。

图2 女,55 岁,PSC。A 为三维最大密度投影图;右肺下叶软组织肿块,FDG 摄取不均匀性增高,SUVmax=35.2,内可见液化坏死区FDG 摄取减低(B~G);右侧胸膜多发软组织结节FDG 摄取增高,SUVmax=36.7(H);左侧肾上腺软组织结节,FDG 摄取增高,SUVmax=8.5(I);全身多处骨转移,FDG 摄取增高,SUVmax=18.8(J)

表1 27 例PSC 患者的影像学表现
2.2 PSC 组与其他NSCLC 组SUVmax 比较 Ⅰ期PSC 组患者SUVmax 高于肺腺癌及肺鳞癌组,差异有统计学意义(P<0.001);肿瘤最大径差异无统计学意义(P>0.05);Ⅱ~Ⅳ期PSC 组SUVmax 显著高于肺腺癌组,差异有统计学意义(P=0.003);Ⅱ~Ⅳ期PSC 组SUVmax 高于肺鳞癌组,但差异无统计学意义(P=0.192,表2)。SUVmax 诊断PSC 的ROC 曲线下面积为0.770。当SUVmax 临界值为19.85 时,诊断PSC 的敏感度为55.6%、特异度为89.0%(图3)。
表2 PSC 组与NSCLC 组肿瘤最大径及SUVmax 比较 (±s)

表2 PSC 组与NSCLC 组肿瘤最大径及SUVmax 比较 (±s)
注:与PSC 组比较,*P<0.05
?
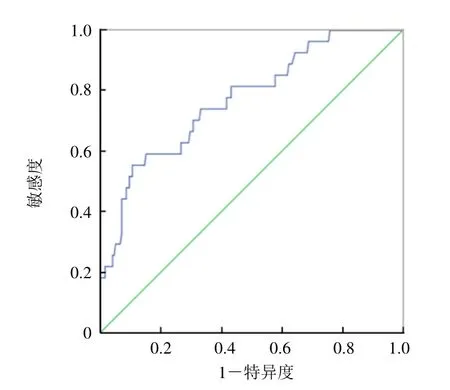
图3 SUVmax 诊断PSC 的ROC 曲线
3 讨论
2015年WHO 肺肿瘤分类法将肺肉瘤样癌定义为一组分化较差的伴有肉瘤成分或肉瘤样分化的NSCLC,包括多形性癌、巨细胞癌、梭形细胞癌、癌肉瘤和肺母细胞瘤5 种亚型[3]。PSC 是一种罕见的肺癌,多发生于60 岁以上长期吸烟的男性,本组患者中19 例有长期吸烟史,平均年龄(65.37±9.56)岁,与文献[4-6]报道相符。PSC 的临床表现及影像学表现均无特异性,诊断主要依靠病理和免疫组化检测。肉瘤样癌可表达上皮性标志物,如细胞角蛋白、抗细胞角蛋白单克隆抗体、上皮细胞膜抗原;同时也可表达间叶性标志物,如波形蛋白等[4,7]。仅当肉瘤样成分中肉瘤样组织所占比例>50%才可诊断为PSC;否则仍诊断为癌。因此,PSC 的影像学表现介于癌与肉瘤之间,既可表现为癌的毛刺、分叶,也可表现为肉瘤的体积大等特征,无特异性,较难鉴别。
PET/CT 能够从代谢方面提供诊断依据,在肿瘤的鉴别诊断中具有重要作用。然而,既往研究中PSC的影像学特点分析多为CT 及增强CT 表现,PET/CT代谢特点研究较少[8],且多数为个案报道。
PSC 好发于肺上叶,多为单发,且以周围型多见,本研究中周围型25 例(92.6%),与文献[5,9-10]报道相符。由于PSC 的侵袭性强,肿瘤生长速度较快,发现时肿瘤直径常较大[11]。本组肿瘤平均最大径为(5.36±2.62)cm,肿瘤直径≥5 cm 占51.9%。肿瘤体积较大时密度不均匀,内部可见液化坏死区。肿块边界一般较清楚,边缘可见分叶及毛刺,但钙化、胸膜凹陷征较少见[12-13]。肿块常以宽基底与胸膜相连,易侵犯胸膜、胸壁及邻近组织。肿块均可见FDG 摄取异常增高,体积小者代谢较为均匀,体积较大时内部可见液化坏死。本研究中,13 例肿块内部液化坏死区放射性分布稀疏。由于PSC 的恶性程度较高,病灶的SUVmax 可能高于其他类型的NSCLC。Rapicetta 等[14]纳入11 例Ⅰ期PSC 患者,其平均SUVmax 值明显高于其他亚型NSCLC Ⅰ期患者。尽管本研究仅纳入6 例Ⅰ期PSC 患者,但其SUVmax 明显高于其他Ⅰ期NSCLC 患者,差异有统计学意义(P<0.001)。本研究结果发现Ⅱ~Ⅳ期PSC 患者SUVmax 明显高于肺腺癌患者(P=0.003);与肺鳞癌组比较差异无统计学意义(P=0.192),但PSC 组的SUVmax 有高于肺鳞癌组的趋势。同时,本研究结果显示,以SUVmax>19.85 为界值,诊断PSC 的敏感度为55.6%,特异度为89.0%,提示PET/CT 检查结果中的SUVmax或许可作为诊断PSC 并与其他类型NSCLC 鉴别的重要指标[15];也反映了PSC 具有高度侵袭性,且在早期即有高转移潜力。在预后方面,Rapicetta 等[14]研究认为SUVmax 可能与临床、病理特征无相关性,无法预测患者的生存情况。PSC 的高代谢是否与病理及预后有关尚有待进一步研究。
PET/CT 在PSC 分期中具有重要价值。本组患者中PET/CT 提示淋巴结转移14 例,转移淋巴结SUVmax 为13.51±8.80;其中2 例伴有颈部淋巴结转移,1 例伴有腹膜后淋巴结转移;27 例PSC 中远处器官转移7 例,其中6 例均可见肾上腺转移,1 例见肝及双肾转移,1 例胃转移,4 例多处骨转移,PET 均表现为FDG 摄取不同程度增高。既往研究报道PSC可转移至淋巴结、骨、肺、肝脏、脑、肾上腺等组织,但转移至胃较少见[15-16]。本组中1 例PET/CT 提示胃底部胃壁增厚形成软组织结节摄取FDG 增高,SUVmax 约23.5,经手术切除后病理证实为肉瘤样癌转移。因此,当胃肠道中发现由癌和肉瘤成分组成的肿瘤时,应进一步检查是否肺内为原发病灶[17]。PET/CT 可以为寻找原发灶及诊断提供重要信息。
本研究的局限性为样本量较小,未对病例进行随访及预后分析,有待今后进一步研究PET 参数与PSC患者预后的相关性。
总之,PSC 患者的影像学表现缺乏特异性,但PET/CT 表现在诊断和分期上更具优势,PET/CT 多表现为直径较大的肿块,内可见片状液化坏死区,边缘可见毛刺及分叶,周围型多贴胸膜生长,多数伴有淋巴结转移及远处转移,转移病灶代谢活跃;与其他亚型NSCLC 相比,PSC 具有更高的糖代谢。当SUVmax临界值为19.85 时,可以更好地区分PSC 与其他类型的NSCLC,以提高PSC 的诊断准确性。PET/CT 可为PSC 的鉴别诊断提供更有力的证据,并对PSC 分期具有重要作用。

