药用植物草珊瑚快速繁殖体系的建立
李林轩 梁莹 覃犇 谷筱玉 韦范 韦坤华


摘要:对草珊瑚(Sarcandra glabra)进行组织培养快速繁殖技术研究,建立草珊瑚的快速繁殖体系。结果表明,草珊瑚外植体的最佳消毒灭菌方法为使用75%乙醇消毒30 s,再用无菌水涮洗1遍,然后置于0.1%HgCl2溶液(加1~2滴表面活性物质吐温-80)浸泡消毒8~9 min,用无菌水浸洗2次,每次浸洗5 min。草珊瑚不定芽诱导的最适培养基为MS+1.5 mg/L 6-BA+0.3 mg/L IAA+0.5 mg/L NAA;草珊瑚丛生芽继代增殖的最佳培养基为MS+1.5 mg/L 6-BA+0.3 mg/L IBA。诱导草珊瑚生根的最适宜培养基为1/2MS+1.0 mg/L IBA+0.3 mg/L NAA。草珊瑚试管苗移栽的最佳基质为泥炭土+蛭石,比例为1 ∶1。
关键词:草珊瑚;繁殖;丛生芽;生根;外植体消毒;不定芽诱导;培养基
中图分类号: S567.23+9.043文献标志码: A
文章编号:1002-1302(2020)18-0072-05
收稿日期:2019-09-25
基金项目:国家中药材产业技术体系建设专项(编号:CARS21);广西创新驱动发展专项资金(编号:桂科AA18242040);广西科技计划(编号:桂科AD17129044);广西科技基地和人才专项(编号:桂科AD1850002、桂科2017AD19001);“广西八桂学者”专项(编号:桂药创2019007;桂药创2019005);桂林市科技计划项目重大专项(编号:20180102-4)。
作者简介:李林轩(1986—),男,广西全州人,硕士,高级工程师,从事中药资源保护与开发利用研究。E-mail:175153419@qq.com。
通信作者:韦坤华,博士,研究员,主要从事药用植物生物技术研究。E-mail:divinekh@163.com。
草珊瑚[Sarcandra glabra (Thunb.) Nakai]别称肿节风、九节茶,为金粟兰科草珊瑚属多年生草本植物,整株入药,具有清热凉血、祛风通络、活血消斑等功效,用于治疗血热紫斑、紫癜、风湿痹痛、跌打损伤等症[1]。此外,草珊瑚也是瑶族用药的重点品种,是“五虎”“九牛”“十八钻”“七十二风”等瑶药老班药中的风药品种之一。在广西壮瑶地区,人们广泛使用草珊瑚进行清热凉血,散淤消肿,祛风通络[2]。鉴于草珊瑚的良好疗效,为了更好地开发和利用中药草珊瑚资源,笔者对草珊瑚优良植株进行组织培养快繁技术研究,以利于草珊瑚野生资源的保护和优良植株性状的保持,为草珊瑚遗传改良提高有效药用成分打好基础。
1 材料与方法
1.1 试验材料
样品采集自种植于广西药用植物园科研基地内的健壮无病虫害草珊瑚植株,原植物经广西药用植物园韦坤华研究员鉴定为金粟兰科植物草珊瑚[Sarcandra glabra (Thunb.) Nakai],选取其嫩芽为外植体,于天气晴朗的上午取样。
1.2 试验方法
1.2.1 外植体消毒
试验以嫩芽芽尖作为外植体进行初代诱导,首先将草珊瑚芽尖洗净,用75%乙醇灭菌30 s,再用无菌水冲洗1遍,将洗干净的草珊瑚芽尖置于0.1%HgCl2溶液(加1~2滴表面活性物质吐温-80)浸泡消毒5~10 min,用无菌水浸洗2次,每次浸洗5 min,用无菌纸将试验材料表层的水分吸干,然后接种到MS培养基上进行培养,培养条件如下:平均光照强度2 000 lx,光照时间12 h/d,温度(25±3) ℃。
1.2.2 不定芽诱导
草珊瑚不定芽的诱导采用正交试验设计,以MS培养基为基本培养基,添加NAA(0.1、0.3、0.5 mg/L)、IAA(0.1、0.3、0.5 mg/L)、6-BA(1.0、1.5、2.0 mg/L)进行外源激素筛选,以获得最佳的不定芽诱导条件,每个处理10瓶,每瓶4个外植体,培养30 d后记录不定芽的诱导情况,比较不同处理对不定芽诱导的影响。
1.2.3 丛生芽繁殖
草珊瑚丛生芽繁殖优化试验是在MS培养基中进行,采用正交试验设计,添加 6-BA(1.0、1.5、2.0 mg/L)、IBA(0.1、0.2、0.4 mg/L)、AC(0、0.3、0.5 mg/L)3种外源激素,篩选不同外源激素对草珊瑚丛生芽繁殖的影响因子,30 d后观察丛生芽的生长情况,统计增殖倍数;芽增殖倍数=(30 d后芽数-接种时芽数)/接种时芽数[3],通过丛生芽生长情况与增殖倍数指标来优化繁殖培养基。
1.2.4 生根培养
以1/2MS培养基为基本培养基筛选出草珊瑚组培苗生根最佳培养基配方。采用正交试验设计,在1/2MS培养基中添加IBA(0.2、0.5、1.0 mg/L)、NAA(0.1、0.3、0.5 mg/L)和AC(0、0.3、0.5 g/L)进行试验,每个处理10瓶,每瓶10个单芽,30 d后记录生根率与生根数平均值,其中生根率=生根株数/接种总数×100%,生根数平均值=总生根数/接种总数×100%[4],筛选草珊瑚试管苗生根效果最好的培养基。
1.2.5 炼苗及移栽
将生长旺盛、根系发达的草珊瑚试管苗移入常温室内放置,拧松瓶盖驯化2 d后,打开盖子让草珊瑚试管苗与空气完全接触再驯化 3 d,期间定时向瓶内的小苗喷雾以保持小苗叶片水分充足。驯化后,从瓶内取出幼苗,洗净根部培养基,移入到黄沙、蛭石、泥炭、泥炭+蛭石(1 ∶1)、泥炭+黄沙(1 ∶1)5种不同基质上,适度遮阴,并保持相对湿度在85%以上,30 d后统计不同基质中组培苗的成活率[5]。
2 结果与分析
2.1 消毒时间筛选
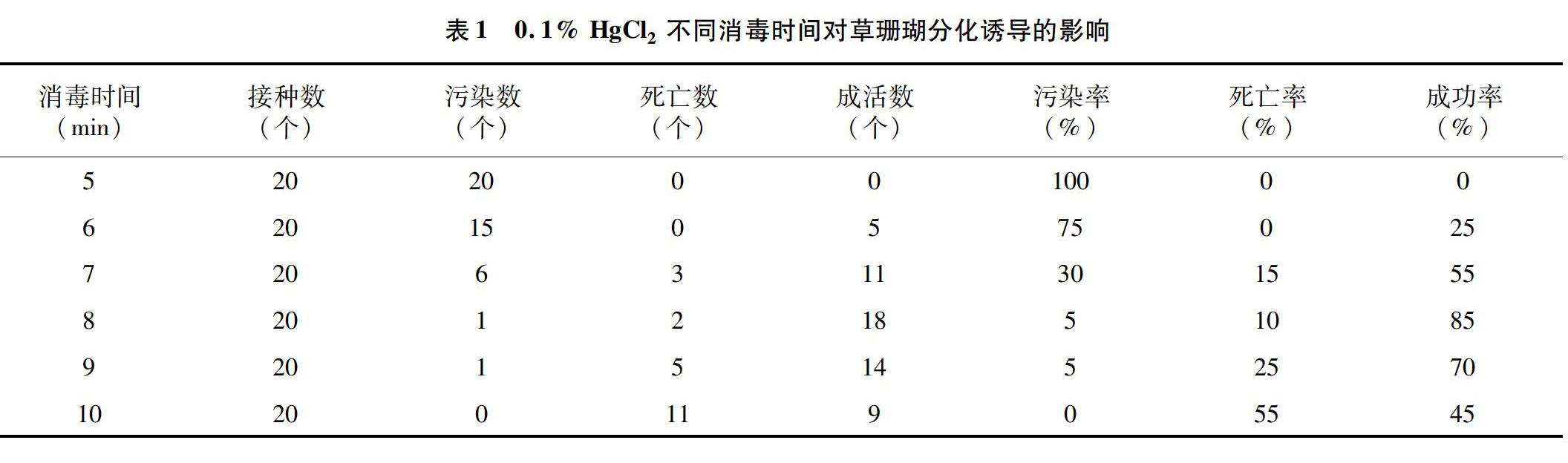
为了确定消毒剂0.1% HgCl2消毒时间对外植体消毒效果的影响,对5、6、7、8、9、10 min 6个时间的消毒效果进行比较研究,接种15 d后对试验对象的污染率与成活率进行统计与分析,结果见表1。
由表1可知,草珊瑚消毒效果受其消毒时间影响明显,随着消毒时间的延长,草珊瑚污染率明显下降。根据试验结果,5 min内草珊瑚的消毒效果不理想,污染率为100%;当消毒时间增加到8 min时;消毒效果较好,成功率高达85%,而消毒时间延长到10 min时,消毒效果最好,污染率为0。但是,除了考虑污染率外,植物外植体消毒还需综合考虑其存活率。根据试验结果,随着消毒时间的增加,成活率呈现先增加后下降的趋势,其中成活率在 8 min 时最好,达到90%。综合考虑不同消毒时间对草珊瑚外植体的污染率与成活率,当消毒时间为8 min时,消毒效果最佳。
2.2 不定芽诱导培养基筛选
将消毒后的芽尖接入不定芽诱导培养基中培养,7 d左右草珊瑚颜色逐渐变成乳黄色,其不定芽切口处开始增大并疏松,15 d左右在接触培养基的基部长出不定芽,20 d时草珊瑚不定芽逐渐长出翠绿色叶片并且成簇生长,30 d统计增殖不定芽数,结果与分析见表2和表3。根据统计结果,当6-BA浓度保持在1.0~1.5 mg/L的低浓度水平,不定芽数量随着浓度增加而增加,不定芽粗壮、颜色新鲜翠绿;但当6-BA浓度高于1.5 mg/L水平时,不定芽数量随着浓度的增加反而逐渐下降,不
定芽有玻璃化现象且颜色变为黄绿色,表明低浓度6-BA有利于草珊瑚不定芽的诱导,但高浓度对不定芽的诱导有抑制作用。根据试验结果,草珊瑚不定芽诱导的最佳培养基应为A2B2C3,即MS+1.5 mg/L 6-BA+0.3 mg/L IAA+0.5 mg/L NAA,以此培养基为基质获得的不定芽、粗壮、颜色呈翠绿色(图1)。
2.3 丛生芽继代
以0.5~1.0 cm的不定芽单芽为试验材料,对草珊瑚丛生芽繁殖培养基进行优化筛选(表4、表5)。结果显示,6-BA、IBA、AC 3种激素的影响顺序为A(6-BA)>B(IBA)>C(AC),其中6-BA对丛生芽繁殖有极显著影响,IBA产生显著影响,AC对草珊瑚丛生芽繁殖影响不显著。根据数据分析可见,3个因素的浓度对草珊瑚丛生芽增殖倍数的影响均具有先升高再降低的趋势。6-BA浓度为1.5 mg/L、IBA浓度为0.3 mg/L时草珊瑚丛生芽增殖倍数最高(10.4),且芽苗为翠绿色,长势较快,质量也较好,有利于后期诱导草珊瑚生根。因此,根据上述试验结果分析得出,草珊瑚丛生芽增殖的最适培养基应为MS+1.5 mg/L 6-BA+0.3 mg/L IBA。 重复试验发现在此培养基上丛生芽增殖频率高,增值倍数达到最高值108,此时丛生芽的质量也比其他处理好(图2)。
2.4 丛生芽诱导生根试验
为了筛选获得最佳的生根培养基,使用IBA、NAA和活性炭(AC)3个水平设计正交试验,将生长旺盛的单芽茎段接入草珊瑚生根培养基中,30 d后,统计草珊瑚生根率(表6、表7)。结果可知,3个因素对草珊瑚生根率的影响顺序为A(IBA)>B(NAA)>C(AC),IBA对草珊瑚试管苗的生根率具有极显著的影响(56.814),NAA对其生根率具有显著影响(16.489),但AC对草珊瑚生根率无显著影响(0.302)。IBA、NAA对草珊瑚生根率的影响呈现出在低浓度时促进生根,而在高浓度时抑制生根。当IBA浓度在0.5~1.0 mg/L、NAA浓度在0.1~0.3 mg/L浓度范围时,草珊瑚试管苗生根率随着浓度的上升而提高,但高于此浓度,生根率反而逐渐下降。经过重复验证,在1/2MS+1.0 mg/L IBA+0.3 mg/L NAA生根培养基上的生根率最高,达到100%(如图3),因此,草珊瑚组培苗生根的最适宜培养基为1/2MS+1.0 mg/L IBA+0.3 mg/L NAA。
2.5 试管苗的移栽
将试管苗的根洗净并移植到5种不同的基质上,分别为已消毒的黄沙、蛭石、泥炭、泥炭+蛭石(1 ∶1)、泥炭+黄沙(1 ∶1),适度遮阴,并保持一定的湿度,30 d后统计生根率,结果见表9。在5种不同的基质处理中,草珊瑚试管苗都能成活,但成活率有较大差异。结果显示,成活率高低的顺序依次为泥炭+蛭石(1 ∶1)>泥炭+黄沙(1 ∶1)>黄 沙> 蛭石>泥炭。因此,泥炭+蛭石(1 ∶1)是移栽试管苗的最佳基质,移栽30 d后成活率为96%(图4)。
3 结论与讨论
在植物组织培养中对试验材料灭菌消毒取得无菌材料是至关重要的,本试验对草珊瑚茎尖持续消毒灭菌处理在6~10 min范围内都能获得无菌材料,灭菌时间为8 min,能够到达最佳消毒灭菌效果,成功率为85%,灭菌时间高于或者低于8 min都不利于无菌材料的获得。
組织培养中添加的生长调节剂,是诱导植物生芽、生根的关键因素,同时也是植物组织培养快速生长所必需[6]。在组织培养快速繁殖中,不同植物所需的生长调节剂的类型和浓度也不同[7-8]。本试验通过对草珊瑚不定芽诱导、丛生芽繁殖及生根培养基进行L9(34)正交试验优化筛选,从而建立草珊瑚组培苗快速繁殖体系。6-BA是植物组织培养领域中非常重要的激素,可以促进植物细胞分裂、侧芽生长等[9],并且对在草珊瑚不定芽诱导和丛芽诱导增殖具有极显著影响,当6-BA浓度为 15 mg/L 时效果最佳,如果浓度过高,则会抑制草珊瑚生长,这与王爱勤等在研究6-BA浓度对芦荟组培苗增殖时发现高浓度6-BA会对芦荟增殖产生抑制的研究结果[10]相一致。NAA具有促进细胞分裂与扩大、诱导形成不定根等作用[11],NAA对草珊瑚不定芽诱导生根有着显著作用,低浓度NAA(低于0.3 mg/L)与生根率呈正相关关系,但大于0.3 mg/L,两者就会出现负相关,表明NAA浓度过高会抑制丛生芽生根。植物可以自身形成的内源生长素IBA,既可以促进植物细胞分裂和细胞生长,又可诱导不定根形成[12]。IBA对草珊瑚不定根诱导具有极显著影响,低浓度IBA对草珊瑚不定根诱导具有促进作用,但高浓度具有抑制作用。试验结果还表明,适宜的激素与生长素配比对草珊瑚不定根诱导与丛生芽增殖均具有良好的促进作用,其中 6-BA与IAA、NAA的联合应用能促进不定芽的诱导,6-BA 与IBA的联合应用能促进草珊瑚丛生芽的增殖,而IBA与NAA的联合应用能促进草珊瑚试管苗生根。
草珊瑚试管幼苗移植在不同基质上的成活率也有一定差异,成活效果顺序为泥炭+蛭石(1 ∶1)>泥炭+黄沙(1 ∶1)>黄沙>蛭石>泥炭。因此,草珊瑚试管苗移植到泥炭 ∶蛭石=1 ∶1的基质中最好。
参考文献:
[1]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2010.
[2]庞声航. 实用瑶药学[M]. 南宁:广西科学技术出版社,2008.
[3]周维燕. 植物细胞工程原理与技术[M]. 北京:中国农业大学出版社,2001.
[4]李林轩,韦 莹,黄 浩,等. 红芽大戟组织培养条件的优化[J]. 江苏农业科学,2014,42(4):60-62.
[5]李林轩,林 伟,李 翠,等. 半枝莲组织培养技术研究[J]. 广东农业科学,2014,42(2):38-40,2.
[6]Polanco M C,Peláez M I,Ruiz M L. Factors affecting callus and shoot formation from in vitro cultures of Lens culinaris Medik[J]. Plant Cell Tissue Organ Cult,1988(2),15:175-182.
[7]Li M,Ding B,Huang W,et al. Induction and characterization of tetraploids from seeds of Bletilla striata (Thunb.) Reichb.f[J]. BioMed Research International,2018(5):1-8.
[8]廖建良,周泽鑫. 植物生长调节剂对罗浮山黄精繁殖的影响[J]. 江苏农业科学,2020,48(10):168-172.
[9]Guo Y,Zhai L,Long H,et al. Genetic diversity of Bletilla striata assessed by SCoT and IRAP markers[J]. Hereditas,2018,155(1):1-10.
[10]王愛勤,何龙飞,裴润梅,等. 组培条件对不同品种芦荟试管苗玻璃化的影响[J]. 中国农学通报,2002,18(5):46-48,52.
[11]李林轩,吴庆华,蔡锦源,等. 五指毛桃组织培养获得再生植株的研究[J]. 中草药,2014,45(17):2547-2551.
[12]李林轩,凌征柱,李 翠,等. 珐菲亚组织培养条件的优化研究[J]. 中草药,2013,44(10):1334-1337.

