miR-9-5P靶向CDH1、CTNNA1和ITGA6对脉络膜黑色素瘤细胞功能的影响
应曼曼,张晓楠,刘然,宁宏
(中国医科大学附属第一医院眼科,沈阳 110001)
脉络膜黑色素瘤是成人最常见的原发性眼内恶性肿瘤,病因尚不明确,常发生于50~60岁,易通过血液循环转移[1-3]。许多患者在出现临床或影像学转移之前,通常已经有多年的肝转移[4]。早期发现和治疗有助于提高患者的生存率和改善预后,因此,深入研究脉络膜黑色素瘤的发生和调控机制将有助于发现肿瘤发生相关的关键靶分子,为脉络膜黑色素瘤的治疗提供新的靶点。
非编码RNA (non-coding RNAs,ncRNAs) 包括微小RNA (microRNAs,miRNAs)、长链非编码RNAs(long ncRNAs,lncRNAs) 和环状非编码RNAs(circular RNAs,circRNAs)。研究表明,miRNAs在肿瘤中发挥负调控作用。miR-9-5p能调控甲状腺癌[5]、胰腺癌[6]等的发生发展,但关于它在脉络膜黑色素瘤细胞增殖、凋亡、迁移和侵袭中的调控作用尚未见报道。本研究通过转染miR-9-5p 至人脉络膜黑色素瘤细胞,观察细胞的增殖、凋亡、迁移及侵袭的变化情况,并分析miR-9-5p作用的靶基因,旨在探讨其在脉络膜黑色素瘤中的作用机制。
1 材料与方法
1.1 细胞培养及转染
取冻存的人眼侵袭性脉络膜黑色素瘤细胞系MUM-2B和MUM-2C (上海拜力生物技术有限公司),在温水中快速摇晃溶解。用含10%胎牛血清 (美国Gibco公司) 的MEM培养基 (美国HyClone公司),于5% CO2、37 ℃培养箱中培养细胞。阴性对照(negative control,NC)为随机序列RNA Oligo,miR-9-5p mimics序 列 为5’-UCUUUGGUUAUCUAGCUGUAUGA-3’,miRNA由苏州吉玛基因公司合成,用Lipofectamine 3000 (美国Life Technologies Corporation公司) 进行瞬时转染。
1.2 RTCA实时增殖实验
取对数生长期细胞转染24 h后,消化并离心,去上清。加入有血清培养基重悬细胞,将细胞悬液与台盼蓝混匀,细胞计数仪读取细胞数。根据细胞密度,将每个细胞样品配置成固定浓度的细胞悬液。在E-plate板 (美国爱森生物有限公司) 中加入有血清培养基50 μL测基线后,加入配置好的细胞悬液(100 μL/孔),利用RTCA软件启动细胞实时增殖分析,连续测定72 h,得出细胞增殖曲线。
1.3 EDU细胞增殖实验
miR-9-5p mimics转染细胞48 h,换液后以EDU(上海碧云天生物技术有限公司) 孵育4 h,消化并离心,以4%多聚甲醛固定15 min,用0.5%TrionX-100通透细胞15 min,用Asize488反应液避光孵育细胞30 min后,以流式细胞仪 (美国BD公司) 检测细胞的增殖变化。
1.4 流式细胞仪检测细胞凋亡
转染处于对数生长期的细胞48 h,消化并离心。将细胞凋亡试剂盒 (美国BD公司) 的Binding Buffer(10×) 用预冷PBS稀释成1× Binding Buffer。将各细胞样品以200 μL的1×Binding Buffer重悬。各样品中加入3 μL FITC后,继续加入3 μL PI,分别室温避光孵育10 min,继续加入300 μL 1×Binding Buffer并充分混匀。以流式细胞仪收集并检测10 000个细胞,分析细胞凋亡情况。
1.5 Transwell迁移侵袭实验
将细胞常规转染24 h后消化离心,去上清后加入适量有血清培养基重悬细胞,将细胞悬液与台盼蓝混匀,以细胞计数仪检测细胞密度,每个样品配置成固定浓度的细胞悬液。不做任何处理的小室直接用于迁移实验,加基质胶的小室用于侵袭实验。24孔板中每孔加入600 μL有血清培养基,将配置好的细胞悬液200 μL加入到每个小室并置于24孔板中,孵箱内培养24 h,弃小室内的无血清培养基,将小室底部置于结晶紫中染色15 min,吸干擦净小室,显微镜下拍照。
1.6 生物信息学软件分析预测miR-9-5p的靶基因
利用miRNAs靶基因预测的生物信息学网站TargetscanHuman7.2 (http://www.targetscan.org/vert_72/) 分析找出miR-9-5p的所有靶基因。将miR-9-5p的所有靶基因输入DAVID 6.8 (Database for Annotation,Visualization and Integrated Discovery) 生信分析网站 (https://david.ncifcrf.gov/home.jsp),进行综合生物学功能分析,用GO生物学功能富集分析及KEGG信号通路分析,筛选相关靶基因。最后将所得2组靶基因输入Venny2.1在线分析软件 (http://bioinfogp.cnb.csic.es/tools/venny/),取交集找出与细胞迁移和侵袭功能相关的关键差异基因。
1.7 Western blotting
以RIPA裂解液 (上海碧云天生物技术公司) 提取各组细胞总蛋白,用BCA蛋白检测试剂盒 (上海碧云天生物技术公司) 检测蛋白浓度。每孔30 μg蛋白上样,行10% SDS-PAGE电泳,电转移至PVDF膜 (美国BIO-RAD公司)。5%脱脂奶粉封闭2 h,加入CDH1抗体 ((1︰5 000,ab40772,美国Abcam公司) 和GAPDH抗体 (1︰5 000,5174s,美国Cell Signaling Technology公司),4 ℃孵育过夜。TBST清洗3次后,以二抗 (山羊抗兔1︰5 000,ZB-2301,北京中山金桥生物技术有限公司) 封闭1 h。利用发光仪MicroChemi4.2 (以色列DNR公司) 检测条带荧光亮度,并以ImageJ软件计算灰度值并分析蛋白表达量。
1.8 统计学分析
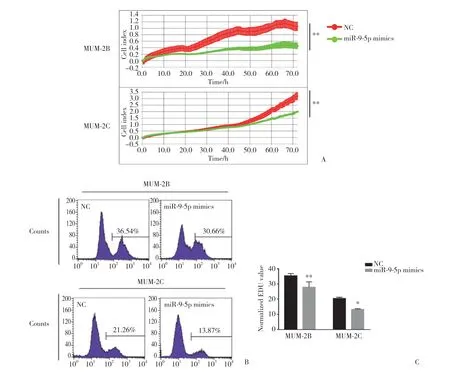
图1 miR-9-5p对脉络膜黑色素瘤细胞增殖的影响Fig.1 The effect of miR-9-5 on proliferation of choroidal melanoma cells
采用GraphPad Prism7.0软件对数据进行分析与作图,实验数据以表示。采用两样本t检验分析比较2组实验数据,每个实验均独立重复3次,P<0.05为差异有统计学意义。
2 结果
2.1 miR-9-5p抑制脉络膜黑色素瘤细胞的增殖
利用RTCA细胞实时增殖实验观察各组细胞的增殖情况,与NC组相比,MUM-2B (t=6.925) 和MUM-2C (t=4.762) 细胞转染miR-9-5p mimics后,细胞增殖能力明显下降 (P< 0.01),见图1A。用EDU细胞增殖实验进一步验证miR-9-5p对细胞增殖的影响,结果表明,MUM-2B (t=4.779) 和MUM-2C (t=4.514) 细胞转染miR-9-5p mimics后,细胞的增殖能力明显减弱 (P< 0.05),见图1B、1C。提示miR-9-5p能够抑制脉络膜黑色素瘤细胞的增殖。
2.2 miR-9-5p能够促进脉络膜黑色素瘤细胞的凋亡
采用流式细胞仪检测各组脉络膜黑色素瘤细胞的凋亡变化情况。如图2所示,与NC组相比,MUM-2B (t=7.385) 和MUM-2C (t=4.893) 细胞转染miR-9-5p mimics后凋亡率明显增加,差异有统计学意义 (P<0.001),见图2A、2B。脉络膜黑色素瘤细胞的凋亡水平与miR-9-5p的表达量呈正相关,表明miR-9-5p能够促进脉络膜黑色素瘤细胞的凋亡。

图2 流式细胞技术检测miR-9-5p对脉络膜黑色素瘤细胞凋亡的影响Fig.2 The effect of miR-9-5p on the cell apoptosis of choroidal melanoma cells detected by flow cytometry
2.3 miR-9-5p能够参与调控脉络膜黑色素瘤细胞的迁移和侵袭
Transwell迁移和侵袭实验结果显示,与NC组相比,MUM-2B (t=7.223) 及MUM-2C (t=11.03) 转染miR-9-5p mimics后,迁移细胞量均显著减少 (P<0.05);与NC组相比,MUM-2B (t=8.271) 及MUM-2C(t=11.42) 转染miR-9-5p mimics后,侵袭细胞量均显著减少 (P< 0.05),见图3。提示miR-9-5p亦能抑制脉络膜黑色素瘤细胞的迁移和侵袭。
2.4 生物信息学方法筛选miR-9-5p参与细胞增殖转移调节的靶基因
为了深入研究miR-9-5p在脉络膜黑色素瘤细胞中发挥作用的分子调节机制,采用生物信息学网站TargetScanHuman7.2 (http://www.targetscan.org/vert_72/)分析预测miR-9-5p可能作用的靶基因,得到1 388个miR-9-5p的靶基因。将靶基因输入DAVID6.8在线分析软件,进一步通过GO生物学分析,找到参与调控细胞迁移侵袭的基因78个,通过KEGG信号通路分析,找到参与调控细胞迁移侵袭的基因51个。经过Venny2.1在线分析工具分析,在上述2组与细胞迁移侵袭相关的基因群中找出3个共同差异表达的基因(CDH1,CTNNA1,ITGA6)。
2.5 验证CDH1是miR-9-5p的靶基因
为验证CDH1,CTNNA1,ITGA6是否为miR-9-5p的靶基因,随机选择性地对CDH1进行实验验证。给予MUM-2B和MUM-2C细胞转染miR-9-5p mimics后,以Western blotting检测不同分组的CDH1蛋白表达变化情况。如图4所示,与NC组相比,转染miR-9-5p mimics组MUM-2B和MUM-2C细胞CDH1的表达均下调。
3 讨论
脉络膜黑色素瘤作为成人最常见的原发性眼内恶性肿瘤,其表现多种多样,并发症多,恶性程度高,易侵袭转移,预后极差[7]。脉络膜黑色素瘤的发生机制可能与染色体畸形、基因突变及信号通路有关[8],其中信号通路是目前的研究热点[9]。研究[10-12]发现,多种miRNAs参与调控肿瘤细胞的生物学行为,并已成为肿瘤治疗的潜在靶点。miRNAs在脉络膜黑色素瘤的增殖、代谢、凋亡及侵袭迁移过程中也发挥着重要作用[13-15]。miRNAs是一类长度约22 nt的内源性非编码小分子RNA,通过与mRNA 3 ’UTR靶向结合调节基因的表达,影响信号通路的激活和抑制状态,从而调控肿瘤的发生与发展。文献[15]报道,miR-155可通过调节NDFIP1的表达促进葡萄膜黑色素瘤细胞增殖和侵袭。

图3 Transwell实验检测miR-9-5p对脉络膜黑色素瘤细胞迁移和侵袭变化的调控作用Fig.3 The regulatory effect of miR-9-5p on the migration and invasion of choroidal melanoma cells examined with Transwell assay

图4 Western blotting检测CDH1蛋白表达情况Fig.4 The expression level of CDH1 detected by Western blotting
miR-9-5p在多种肿瘤中发挥着促进因子或抑制因子的作用[16-19],但它在脉络膜黑色素瘤中的作用机制目前尚不明确。因此,本研究通过在脉络膜黑色素瘤细胞中过表达miR-9-5p,发现miR-9-5p表达上调能够抑制脉络膜黑色素瘤细胞的增殖、迁移和侵袭,并促进脉络膜黑色素瘤细胞的凋亡。为了更加深入地研究miR-9-5p在脉络膜黑色素瘤细胞中的作用机制及途径,本研究利用生物信息学网站TargetscanHuman7.2分析预测了miR-9-5p的全部可能靶基因。随后利用GO分类富集分析及KEGG通路分析上述预测靶基因,筛选得到了3个与细胞迁移和侵袭相关的基因CDH1,CTNNA1和ITGA6。最后以Western blotting初步验证了CDH1是miR-9-5p的靶基因之一。CDH1和CTNNA1属于钙黏着蛋白家族,介导细胞与细胞间的黏附,与上皮-间质转化引起的侵袭性增加有关[20-21]。ITGA6能促进肿瘤细胞的侵袭转移[22]。因此,推测miR-9-5p可能通过调节上述基因的表达影响脉络膜黑色素瘤细胞的发生与发展。
综上所述,本研究发现miR-9-5p能够抑制脉络膜黑色素瘤细胞的增殖、迁移和侵袭,促进脉络膜黑色素瘤细胞的凋亡,并预测其机制可能与调节CDH1,CTNNA1和ITGA6的表达有关,为脉络膜黑色素瘤的诊断和治疗提供了一种新的思路。

