卵巢癌组织中PD-L1及PD-L2的表达及其预后判断价值
袁风玲 贾淑慧 江 源
卵巢癌是一种常见的妇科肿瘤,美国癌症协会统计,其发病率仅次于子宫癌及子宫颈癌,位于第3位,但其死亡率却居妇科肿瘤的第1位[1]。随着医学临床技术的不断发展,外科及化疗已明显改善了卵巢癌患者的预后,但其总体5年生存率仍仅有45%,其中晚期卵巢癌患者的5年生存率只有30%,而早期卵巢患者的5年生存率在70%~90%。因此对卵巢癌患者进行早期诊断及治疗,有助于改善患者的预后[2]。近年来,免疫治疗已成为一种新的治疗方法,卵巢癌免疫逃逸机制与患者预后具有一定的相关性,其中T细胞活化不仅需要TCR-MHC抗原肽复合物提供第一信号,还需协同刺激分子提供的第二信号,而协同刺激分子通过以上信号对T细胞活化、增殖、免疫应答生物学功能进行调节,是治疗肿瘤的主要靶点之一[3]。在免疫治疗中关于程序性死亡因子受体及其配体(PD-1/PD-L1)的药物对多种肿瘤具有较好疗效,而PD-1是CD28/CTLA-4的家族成员,其配体有PD-L1及PD-L2,目前PD-L1及PD-L2的表达与卵巢癌的相关研究较少[4],因此本文分析了卵巢癌组织中PD-L1及PD-L2的表达,并判断了其对卵巢癌预后的预测价值,以为卵巢癌早期诊断选择合适的诊断指标。
1 资料与方法
1.1 一般资料
选择我院2012年1月至2014年12月收治的58例卵巢癌石蜡包埋的组织标本,癌组织均取自肿瘤的原发灶,随访资料完整;排除术前行化疗、放疗者。患者年龄27~72岁,平均年龄为(55.1±4.5)岁,其中非浆液性囊腺癌者21例、浆液性囊腺癌者37例,肿瘤体积为3~5200 cm3,平均肿瘤体积为(1025.8±256.7) cm3,其中细胞分级低分化者35例、中高分化者23例,FIGO分期中Ⅰ期+Ⅱ期者13例、Ⅲ期+Ⅳ期者45例;发生转移者56例。取同期行卵巢囊肿手术的组织标本45例作为良性对照组,其患者年龄为26~71岁,平均年龄为(54.1±5.2)岁。2组患者的年龄等资料对比无统计学意义(P>0.05)。所有患者均用电话、门诊等方式进行随访,生存期为从手术日期至患者死亡的日期。
1.2 方法
2组均用Elivision TM免疫组化方法进行染色,先将石蜡切片置于烘箱中2 h,脱蜡至水,再用Ph7.4的PBS溶液冲洗3次,每次冲洗时间为3 min,取一定量的EDTA缓冲液置入微波盒中,加热至沸腾后将脱蜡水化的组织切片置于耐高温的切片架上,之后置入沸腾的缓冲液中处理10 min,再将微波盒取出,用流水进行自然冷却,之后取出玻片,用蒸馏水进行冲洗,再用PBS液进行冲洗,每张切片上滴上1滴3%的H2O2,于室温下进行孵育,切断内源性氧化物酶活动,之后再用PBS液冲洗,除去PBS液后每张切片滴加1滴PD-L1鼠抗人单克隆抗体及PD-L2鼠抗人单克隆抗体,稀释比例为1∶800,在4 ℃下孵育,再用PBS液冲洗,去除PBS液,于每张切片加一滴聚合物增强剂,于室温下进行孵育,用PBS液冲洗且去除PBS液后,每张切片加1滴酶标抗鼠/兔聚合物,孵育30 min后用PBS液冲洗,再去除PBS液后加1滴新鲜二氨基联苯胺,于显微镜下进行观察,之后用苏木精进行复染,再用中性树胶进行封固、晾干;实验以PBS替代一抗作为阴性对照,之后让2名病理科医师进行读片。
1.3 观察指标及判断标准
(1)对比PD-L1、PD-L2在卵巢癌及卵巢囊肿组织中的表达;(2)分析卵巢癌组织中PD-L1与PD-L2蛋白表达与卵巢癌病理参数的关系;(3)用Kaplan-Meier法分析卵巢癌组织中PD-L1与PD-L2与患者术后总生存期的关系。
PD-L1与PD-L2阳性的判断标准:PD-L1、PD-L2阳性结果用Fromowitz半定量分级对细胞阳性比例及染色强度计分进行判定,其中阳性细胞>80%为4分,>50%~80%为3分,>25%~50%为2分,10%~25%为1分;细胞染色强度中棕褐色为3分,棕黄色为2分,淡黄色为1分,无着色为0分;其中二者总分之和6~7分为+++,2~5分为+~++,0~1分为-;其中+~+++为阳性,-为阴性[3]。
1.4 统计学方法

2 结果
2.1 对比PD-L1、PD-L2在卵巢癌与卵巢囊肿组织中的表达
卵巢癌组织中PD-L1、PD-L2阳性表达率明显高于卵巢囊肿(P<0.05),见表1。
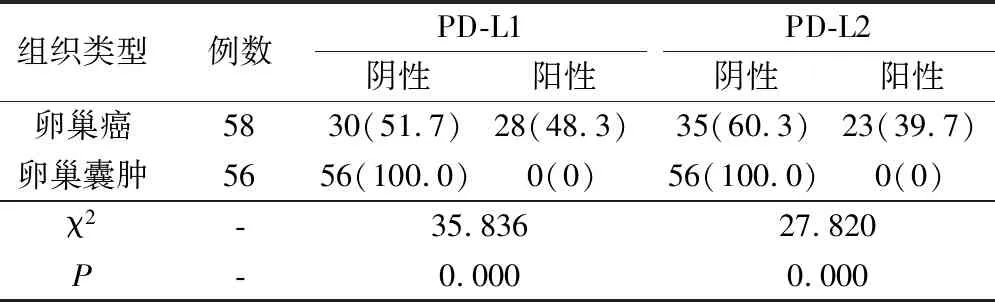
表1 对比PD-L1、PD-L2在卵巢癌与卵巢囊肿组织中的表达(例,%)
2.2 卵巢癌组织中PD-L1、PD-L2蛋白表达与卵巢癌临床病理参数的相关性
PD-L1、PD-L2在卵巢癌组织中的表达与患者的年龄、FIGO分期有明显相关性(P<0.05),而与患者的细胞分级、肿瘤大小、肿瘤转移不相关(P>0.05),见表2。
2.3 卵巢癌组织中PD-L1、PD-L2表达与患者术后总生存期的关系
采用Kaplan-Meier法分析发现,卵巢癌患者PD-L1及PD-L2阴性表达患者的总生存期明显高于阳性表达患者(P<0.05),见表3。

表2 卵巢癌组织中PD-L1、PD-L2蛋白表达与卵巢癌临床病理参数的相关性/例

表3 卵巢癌组织中PD-L1、PD-L2与患者术后总生存期月)
3 讨论
卵巢癌的临床病理类型较为复杂,包括卵巢黏液性囊腺癌、卵巢浆液性囊腺癌、透明细胞癌、卵巢子宫内膜样癌、未分化癌等[4],因其位置较深,因此患者在早期无明显症状,多不能检查确诊,随着疾病进展,待患者出现明显症状检查时已处于晚期,其中手术及术后辅以紫杉醇、顺铂联合化疗是常规的治疗方案[5],但化疗容易产生耐药性,采用手术方式不能完全根治,因此改善卵巢癌患者预后的关键在于提高卵巢癌患者的早期检出率[6],因此临床上需研发灵敏度更高、特异性更高的基因与分子靶向诊断指标。免疫治疗是控制、杀伤肿瘤细胞的一种新治疗方案,协同刺激分子可对T细胞的活化、增殖、免疫应答等生物学功能进行调节,是肿瘤治疗的一个主要靶点[7]。肿瘤细胞中的PD-L1、PD-L2信号通路已成为恶性肿瘤治疗的研究重点,因此本文分析了卵巢癌组织中PD-L1及PD-L2的表达对卵巢癌预后的判断价值。
本文结果表明,PD-L1与PD-L2在对照组卵巢囊肿组织中均为阴性表达,PD-L1与PD-L2在卵巢癌组织中阳性表达率分别为48.3%与39.7%。卵巢癌组织中PD-L1、PD-L2阳性率明显高于卵巢囊肿,PD-L1、PD-L2在卵巢癌组织中的表达与患者的年龄、FIGO分期有明显相关性,而与患者的细胞分级、肿瘤大小、肿瘤转移不相关。采用Kaplan-Meier法分析发现,卵巢癌患者PD-L1及PD-L2阴性表达患者的总生存期明显高于阳性表达患者;表明PD-L1、PD-L2阳性表达与卵巢癌患者的生存期密切相关,主要是由于PD-L1多表达于活化的B细胞、T细胞、巨噬细胞表面上[8],其与PD-1结合可促使免疫逃逸,其阳性的肿瘤细胞与PD-1阳性T细胞结合后,可对T细胞增殖、分化进行抑制,并诱导其凋亡、耗竭细胞能量,其对一些恶性肿瘤有一定的抗肿瘤效应[9]。同时PD-L2受体是CD28家族的PD-1,其胞外区与PD-1的IgV样进行区域性结合,其结构中的酪氨酸会发生磷酸化,募集蛋白酪氨酸磷酸酶-1,从其下游的Zeta链相关蛋白进行去磷酸化,对PI3K/Akt激酶活性进行下调,从而使得p56lck失活,避免其向T细胞内传递免疫抑制信号,对激活T细胞进行抑制[10-11],从而刺激免疫抑制性细胞因子IL-10分泌,其异常会对T细胞功能进行抑制,进一步对T细胞凋亡进行诱导,从而对抗肿瘤免疫反应产生影响,发挥免疫调节作用,因此PD-L1与PD-L2表达在卵巢癌与卵巢囊肿患者中会出现差异,也可用于卵巢癌预后的判断[12-13]。
综上所述,PD-L1及PD-L2可能参与卵巢癌的发生、发展,可用于卵巢癌的诊断及预后分析,肿瘤细胞与肿瘤微环境的关系有待进一步深度分析,从而更透彻地认识PD-L1、PD-L2信号通路,为卵巢癌的诊断、治疗提供新的思路。

