miR-21在幽门螺杆菌诱导的胃癌发生发展中的作用
何文婧 刘 静 武静静 米思蓉
幽门螺杆菌(helicobacter pylori,Hp)是能够在胃上皮细胞定居繁殖的革兰氏阴性杆菌,除了可引发胃溃疡等疾病外,机体感染Hp后还可通过炎症、免疫反应、氧化应激反应等多途径促进胃癌的发生和发展[1-2]。现代研究表明胃息肉向胃癌的演进是一个由良性到恶性逐步演变的过程[3]。随着分子生物学技术的不断发展,通过检测肿瘤细胞特异抗原等早期检出胃癌已成为了可能[4]。微小RNA(miRNA,miR)是非编码的一类内源性小分子RNA,广泛地参与细胞分化、凋亡、生长等过程,其异常表达参与了肿瘤的发生和发展[5]。miRNA的长度为20~22个核苷酸,在基因翻译后修饰调控中发挥重要作用,可在转录后水平负性调控靶基因的表达[6-7]。miR-21在卵巢癌、肝癌、肺癌等恶性肿瘤中呈现高表达状态,均发挥促癌基因的作用[8-9]。本文具体探讨了miR-21在Hp诱导的胃癌发生发展中的作用,现总结报告如下。
1 资料与方法
1.1 一般资料
选择2016年5月至2019年1月在本院进行诊治的120例胃癌患者(胃癌组)与120例胃溃疡患者(胃溃疡组)作为研究对象。纳入标准:患者临床病历资料齐全;14C呼气试验检测Hp阳性;都符合胃癌或胃溃疡的诊断标准;检测前都未经过任何治疗;研究得到了医院伦理委员会的批准。排除标准:妊娠孕妇与哺乳期妇女;精神疾病患者;临床资料缺乏者。2组的一般资料对比无统计学意义(P>0.05),见表1。

表1 2组一般资料对比
在胃癌组中,Dukes分期:A期+B期48例,C期+D期72例;淋巴结转移60例;分化程度:高分化60例,中分化40例,低分化20例;远处转移20例;浸润深度:<肌层40例,≥肌层80例。
1.2 标本采集
取2组的空腹静脉血3~5 ml,促凝后取下层全血样本,采用TRIzol试剂提取全血总RNA并置于-80 ℃冻存,具体步骤参照说明书。使用琼脂糖凝胶电泳检测RNA完整性,选择紫外分光光度仪测定RNA浓度和纯度。
1.3 qRT-PCR检测miR-21表达水平
采用美国Invitrogen公司生产的实时荧光定量PCR仪行qRT-PCR。cDNA的合成体系中包含20~25 ng的总RNA,反应条件:42 ℃1 h,95 ℃ 5 min。PCR反应总体积:20 μl。实时PCR反应条件:95℃预变性10 min;然后以95 ℃10 s、60 ℃1 min,进行40个循环,扩增反应在实时荧光定量PCR仪上进行。以miR-21与内参U6的反应体系中得到的Ct值,计算miR-21的相对表达水平。miR-21上游引物为:5’-CCGCTCGAGGGTAGGAGG-3’,下游引物为:5’-GCTAGACCTCTGGGCCTC-3’;U6上游引物:5‘-GCCAACGTCAGTAGGCAGA-3’,下游引物:5‘-GCCAACCATGATCTGCTGAAAC-3’。相对表达水平≥1.0判断为 miR-21表达阳性。
1.4 调查内容
调查2组患者的性别、年龄等资料,同时重点调查胃癌患者的临床Dukes分期、分化程度、淋巴结转移、浸润深度、远处转移等情况。随访至今,记录胃癌患者的生存情况。
1.5 统计方法
选择SPSS 20.00软件进行分析,计数资料的比较采用卡方检验或方差分析(采用百分比表示),计量数据的比较采用t检验(采用均数±标准差表示),相关性分析采用Cox多因素生存回归分析,检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 miR-21表达水平对比
胃癌组的miR-21相对表达水平与表达阳性率显著高于胃溃疡组(P<0.05),见表2。

表2 2组miR-21表达对比
2.2 胃癌组miR-21表达阳性率与胃癌临床特征的相关性
在120例胃癌患者中,不同Dukes分期、淋巴结转移、分化程度、远处转移、浸润深度患者的miR-21表达阳性率对比差异有统计学意义(P<0.05),见表3。
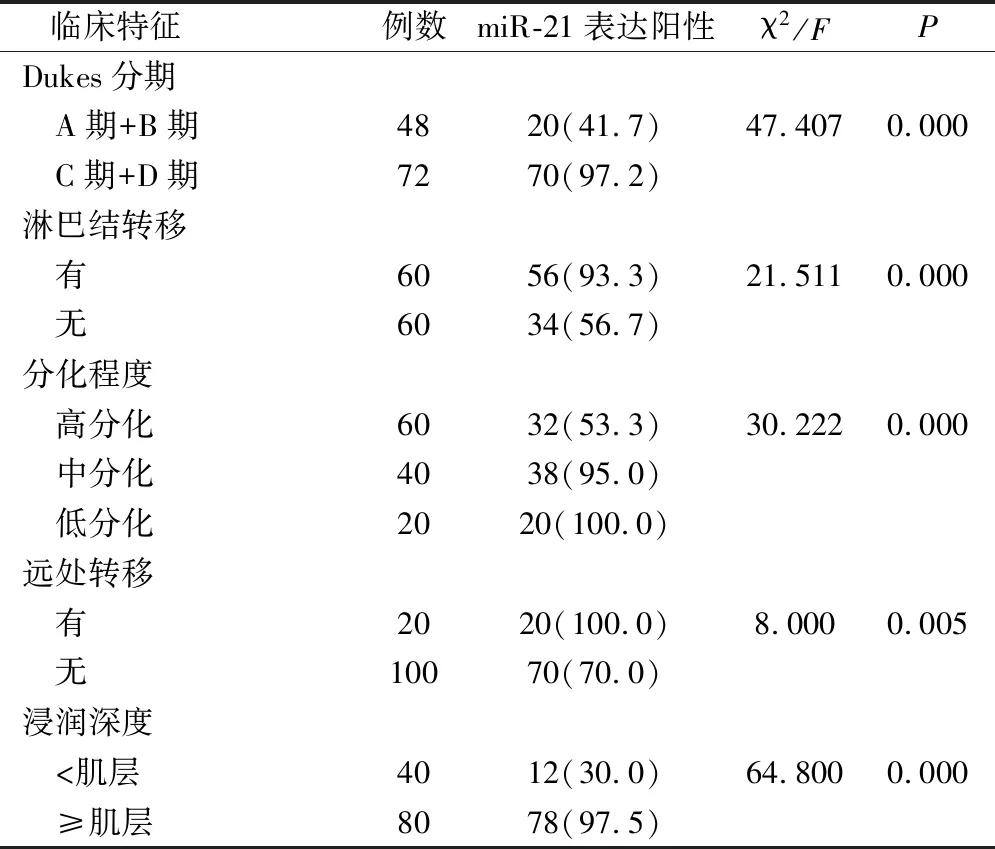
表3 胃癌患者miR-21表达阳性率与临床特征的相关性(例,%)
2.3 随访预后
胃癌组患者随访至今,平均随访时间为(15.22±2.48)月,死亡12例,死亡率为10.0%。单因素和多因素Cox回归分析显示miR-21表达阳性率、Dukes分期、淋巴结转移、分化程度、远处转移、浸润深度都为影响胃癌患者预后的危险因素(P<0.05),见表4。
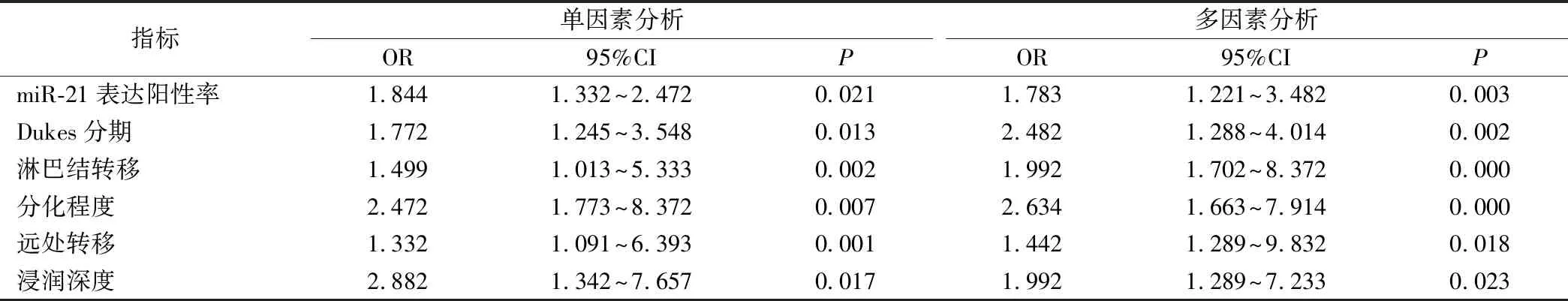
表4 影响胃癌患者预后的Cox回归分析(n=120)
3 讨论
胃癌为临床上比较常见的恶性肿瘤,当前我国胃癌患者占全球胃癌发病总人数的40%左右,但是胃癌早期诊断率却不到10%[10]。Hp在胃癌的发病过程中发挥重要的作用,因为Hp会导致胃黏膜的保护屏障受到破坏,进而使胃酸侵袭深部组织,导致胃癌的形成[11]。
miRNAs是一类高度保守的内源性单链非编码小RNA分子,人体中已经鉴定出上千个miRNAs,其中60%以上的miRNAs涉及机体多个生物学过程,包括瘤的发生发展与侵袭转移、血管生成等[12]。而随着高通量技术的发展,胃癌与胃溃疡中的miRNA也存在显著差异。miR-21是由位于21号染色体上的B细胞整合簇基因转录的非编码RNA加工而成,与人类肿瘤具有非常密切的关系[13]。miR-21与其靶基因构成一个复杂的调控网络,对细胞的增殖、损伤、分化、形成抗药性等过程起重要作用[14]。miR-21过表达能够增加白细胞介素-6的分泌及表达,降低患者的免疫功能[15]。qRT-PCR方法是目前检测基因表达最灵敏、最可靠的方法,也是检测成熟miRNAs的理想工具。本研究显示胃癌组的miR-21相对表达水平与表达阳性率显著高于胃溃疡组,表明胃癌全血中miR-21呈现高表达状态。
胃癌的发病周期比较长,多由胃溃疡发展而来,只有当患者出现腹痛等严重情况才会到院就诊[16]。且与其它肿瘤一样,胃癌的发生归因于基因-环境的相互作用,正是这些基因多态性或修饰性,导致个体对环境因素可产生一定的敏感性[17]。miRNA家族在恶性肿瘤细胞的增殖、迁移、凋亡中发挥重要作用,可起到抑制或者促进肿瘤发展的作用[18]。本研究显示在120例胃癌患者中,不同Dukes分期、淋巴结转移、分化程度、远处转移、浸润深度患者的miR-21表达阳性率对比差异有统计学意义,表明miR-21的表达水平与胃癌患者Dukes分期、淋巴结转移、分化程度、远处转移、浸润深度有关。
目前临床上采用肿瘤标志物对胃癌诊断具有相对较高的特异性和敏感性,但是难以独立作为预测预后的指标[19-20]。本研究单因素和多因素Cox回归分析显示miR-21表达阳性率、Dukes分期、淋巴结转移、分化程度、远处转移、浸润深度都为影响胃癌患者预后的危险因素,说明miR-21表达阳性率可能是预测胃癌患者预后的一个重要指标。miRNA可通过靶向于不同的基因而在胃癌形成过程中产生类似肿瘤促进因子或抑制因子的作用,miR-21通过靶向Smad4可促进前列腺癌细胞的生长和运动,也可促进肝癌细胞增殖和克隆[21]。miR-21表达降低可导致自然杀伤细胞功能障碍,影响T细胞的分化和增殖,可能是肿瘤细胞的正向调控机制之一[22-23]。然而本研究也存在一定的缺陷,没有在胃癌发生与发展过程中针对miR-21进行动态的检测,同时没有进行细胞学分析,将在下一步进行深入分析。
总之,miR-21在Hp诱导的胃癌患者全血中呈现高表达状态,与胃癌的临床特征显著相关,可以作为预测预后的潜在生物标志物。

