EXT在骨巨细胞瘤中的表达及其意义
任龙龙 柴 臻 高 智
骨巨细胞瘤(giant cell tumor of bone,GCTB)是一种常见的原发骨肿瘤,约占临床全部骨肿瘤的6%。GCTB的肿瘤组织主要由多核巨细胞和基质细胞组成,好发于长骨干骺端与胸椎、骶骨处[1-2],在临床上主要表现为局部持续性疼痛、神经功能受损等[3]。该病也是一种潜在恶性或介于良恶性之间的溶骨性肿瘤,术后复发率比较高,部分患者可发生肿瘤转移,因此患者死亡率比较高[4-5]。随着分子生物学的发展,研究表明骨巨细胞瘤的发生、发展为多基因参与和多阶段协同作用的结果,其具有永久增殖能力及刺激单核细胞形成多核巨细胞的能力,某些蛋白的异常表达可使细胞具有恶性特征,促使细胞分化和无限制生长[6-7]。乙酰肝素共聚合酶(exostoses,EXT)编码具有746个氨基酸残基的蛋白,为位于高尔基体与内质网上的跨膜蛋白[8-9]。EXT有可能通过影响表皮生长因子受体糖基化来调节细胞周期或细胞分化,增加表皮生长因子和表皮生长因子受体复合体的内吞作用,从而影响细胞的下游信号[10-11]。本文具体探讨了EXT表达在骨巨细胞瘤中的价值,现报告如下。
1 材料与方法
1.1 一般资料
2014年7月至2019年1月选择在本院诊治的骨巨细胞瘤患者101例作为研究对象,纳入标准:病理组织学证实为骨巨细胞瘤;临床资料与病理资料完整;入院前未行任何治疗;研究得到医院伦理委员会的批准;患者签署了知情同意书;年龄20~80岁。排除标准:精神疾病患者;妊娠与哺乳期患者;其他恶性肿瘤转移患者;合并严重心肝肾异常患者。
在101例患者中,男性61例,女性40例;转移情况:淋巴结转移33例,肺转移20例,肝转移11例;年龄最小26岁,最大78岁,平均年龄(56.22±5.29)岁;发病部位:肱骨9例,桡骨21例,尺骨20例,髂骨10例,股骨30例,胫骨10例,腓骨1例;平均体重指数为(20.42±2.13)kg/m2;组织学分化:高分化40例,低分化40例,中分化21例;Jaffe病理分级:Ⅰ级60例,Ⅱ级30例,Ⅲ级11例。
1.2 免疫组化检测
取所有患者的病灶组织标本与瘤旁组织(距瘤肿边缘2 cm以外细胞组织)标本,所有标本术后均经4%中性甲醛固定,常规石蜡包埋。
采用二步法免疫组化染色,一抗为兔抗人EXT单克隆抗体(北京中杉金桥生物技术有限公司),二抗为二步法检测试剂(北京中杉金桥生物技术有限公司),一抗用PBS稀释,工作滴度为1∶200。石蜡切片脱蜡、水化,采用枸橼酸抗原修复液进行抗原修复;蒸馏水冲洗2次,每次5 min;滴加3%双氧水50 μl,37 ℃孵育20 min;PBS冲洗3次,每次5 min;滴加一抗,4 ℃孵育过夜;PBS冲洗3次,每次5 min;滴加二抗,37 ℃孵育30 min;PBS冲洗3次,每次5 min;DAB显色,苏木精中染色;酒精梯度脱水,中性树胶封片,镜下观察。
1.3 判断标准
EXT表达阳性细胞呈棕黄色,定位于瘤组织的血管内皮细胞上。每张切片随机选择5个区域,放大倍数为200倍,根据阳性信号的强弱和面积判断结果,乘积之和≥2分判断为阳性。调查所有患者的临床病理特征,包括淋巴结转移、肺转移、肝转移、组织学分化、Jaffe病理分级等。同时随访到2019年8月,统计患者的生存率。
1.4 统计方法
选择SPSS 20.00软件进行分析,计数数据采用例数或者百分比表示,计量数据采用均数±标准差表示,对比为t检验与四格表卡方χ2检验法等,多因素分析采用多元回归logistic分析,检验水准为α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 EXT表达阳性对比
在101例患者中,病灶组织的EXT表达阳性率为66.3%(67/101),显著高于瘤旁组织的9.9%(10/101),差异有统计学意义(χ2=68.187,P=0.000)。
2.2 EXT表达阳性率与临床病理特征的相关性
在骨巨细胞瘤的病灶组织中,EXT表达阳性率与Jaffe病理分级、分化情况、淋巴结转移、肺转移、肝转移都有显著相关性(P<0.05),见表1。
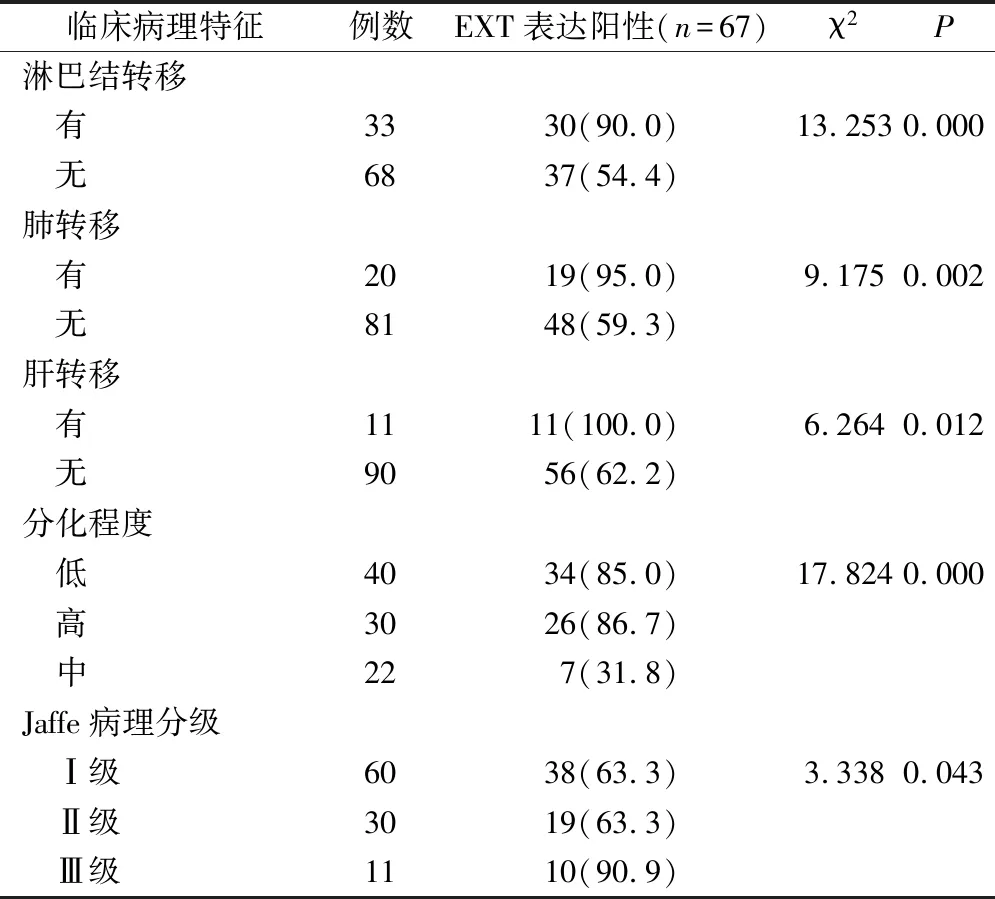
表1 骨巨细胞瘤中EXT的表达与其临床病理特征的相关性(例,%)
2.3 生存情况
随访到2019年8月,101例患者中生存87例,死亡14例,死亡率为13.9%。
2.4 影响因素分析
在101例患者中,以预后随访死亡作为因变量,以临床资料、病理特征与EXT表达阳性率作为自变量进行多元回归logistic分析,结果显示肺转移、肝转移、Jaffe病理分级与EXT表达阳性率为影响骨巨细胞瘤预后死亡的主要因素(P<0.05),见表2。
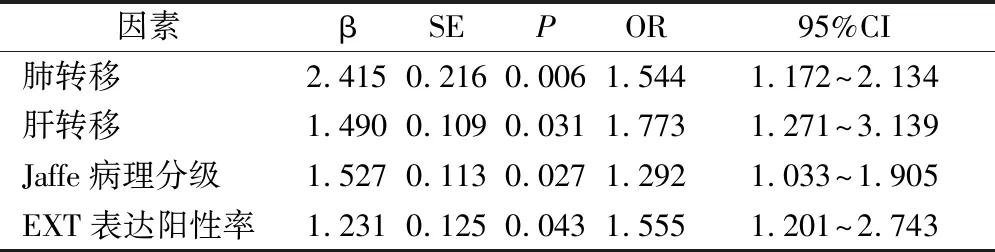
表2 影响骨巨细胞瘤患者预后的因素分析(n=101)
3 讨论
骨巨细胞瘤是一种常见的骨原发性肿瘤,包括多核巨细胞、单核细胞样细胞及单核基质细胞,早期多为良性肿瘤[12],但是其具有一定的侵袭性,易复发,有潜在恶变的可能。骨巨细胞瘤的发病年龄多在20~60岁之间,其病变主要见于骨骺与四肢,肿瘤富含细胞,由单核基质细胞和弥散分布其中的多核巨细胞组成[13]。该病的复发率比较高,少数患者会发生肺转移与肝转移,因此患者的死亡率比较高[14]。
当前骨巨细胞瘤发生和发展的信号通路尚待阐明。EXT的表达和细胞周期密切相关,在细胞分化阶段,如果EXT在成熟细胞中活性很高,可以降低细胞和基质间粘着,可促使细胞产生癌变,同时出现早期的分化抗原[15]。本研究显示在101例患者中,病灶组织的EXT表达阳性率为66.3%,显著高于瘤旁组织的9.9%,表明骨巨细胞瘤患者多伴随有EXT的高表达,其作用机制可能在于EXT能够引起多种细胞因子的释放,从而促进骨巨细胞瘤细胞的增殖和抗凋亡作用,进而导致骨巨细胞瘤的发生、发展、侵袭及转移[16-17]。
骨巨细胞瘤来源于骨髓中的间叶细胞,其中巨细胞肿瘤基质细胞C具有永久增殖能力及刺激单核细胞形成多核巨细胞的能力,为此构成骨巨细胞瘤的主要肿瘤细胞成分[18]。EXT可促进内皮细胞的粘附与增殖,增加细胞间及细胞与细胞基质间的黏附作用,调节内皮细胞的通透性[19]。本研究显示在骨巨细胞瘤的病灶组织中,EXT表达阳性率与Jaffe病理分级、分化情况、淋巴结转移、肺转移、肝转移都有显著相关性,表明骨巨细胞瘤的EXT表达与临床病理特征显著相关。当前也有研究显示EXT可以抑制p38细胞分裂素活化蛋白激酶磷酸化,从而促使多种促血管生成因子、炎症因子的表达,从而发挥促癌作用[20-21]。
当前骨巨细胞瘤在生物学发展过程仍需进一步研究,为此需要从病理生物学和分子生物学角度来确定骨巨细胞瘤的特点[22]。本研究随访到2019年8月,101例患者中生存87例,死亡14例,死亡率为13.9%;多元回归logistic分析显示肺转移、肝转移、Jaffe病理分级与EXT表达阳性率为影响骨巨细胞瘤预后死亡的主要因素。EXT为单拷贝基因,是高度糖基化的分子[23]。EXT蛋白是由胞外区、跨膜区和胞质区等组成,胞外区含有特征性的免疫球蛋白结构域。活化的EXT可通过其胞质区与p59细胞形成复合物进而促进细胞局部黏附聚集,参与了血管新生中内皮细胞的黏附、增殖和迁移[24]。并且EXT的高表达还可主动攻击与之接触的免疫活性细胞,通过表达EXT传导信号杀伤浸润的淋巴细胞,并最终导致恶性肿瘤的发生发展,从而影响患者的生存期[25]。本研究也存在一定的不足,随访时间比较短,且纳入样本数量少,调查分析资料还不够,因此后续研究将扩大样本进行深入分析。
总之,EXT在骨巨细胞瘤中呈现高表达状态,与患者的临床病理特征密切相关,可以作为预测骨巨细胞瘤患者预后的有效指标。

