FAM83H在食管鳞癌中的表达及对癌细胞生物学行为的影响
河北医科大学第四医院肿瘤研究所,河北 石家庄 050011
在中国,食管鳞癌占食管癌的90%,具有较高的侵袭性和转移性,5 年生存率低于20%[1]。因此,寻找具有高灵敏度和特异度的分子标志物,对于食管癌早期诊断和治疗效果评价具有重大意义。上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程广泛参与肿瘤的侵袭和转移,转化生长因子-β1(transforming growth factor-β1,TGF-β1)是EMT过程中最有效的刺激因子[2],因而筛选TGF-β1处理后差异表达的基因,将为探究肿瘤侵袭和转移的分子机制提供理论依据。本研究通过转录组表达谱基因芯片分析,发现TGF-β1处理后FAM83H的表达显著上调。通过文献检索,可知FAM83H在多种实体肿瘤中表达异常,但在食管鳞癌中的表达及作用尚未见报道。本研究分析FAM83H在食管鳞癌组织中的表达情况及其表达水平与患者临床病理学参数之间的关系,同时观察在体外FAM83H对食管癌细胞增殖、迁移及侵袭等生物学行为的影响。
1 材料和方法
1.1 组织标本及细胞系
组织标本取自2015—2017年河北医科大学第四医院生物样本库收集的食管鳞癌手术患者,共67例,其中男性48例,女性19例。患者术前均未接受任何治疗(化疗和放疗)。组织标本包括食管鳞癌原发灶组织及距原发灶边缘3~5 cm以上的相应癌旁正常组织。根据美国癌症联合会(American Joint Committee on Cancer,AJCC)标准进行TNM分期。食管鳞癌患者具体资料详见表1。
食管正常上皮细胞HEEpiC购自美国模式培养物保藏所(American Type Culture Collection,ATCC)。食管癌细胞系Kyse170、TE1、Kyse150和Eca109均由河北医科大学第四医院肿瘤研究所病理学研究室保留并传代。TGF-β1对食管癌细胞Eca109的处理培养方法:TGF-β1处理组用10 ng/mL的重组TGF-β1处理,每2 d更换1次培养基,培养7 d;对照组用不含TGF-β1的培养基常规培养7 d,其余条件完全相同。
1.2 主要试剂
si-FAM83H小干扰RNA由通用生物系统(安徽)有限公司设计并合成;表达引物由上海捷瑞生物工程有限公司合成;反转录试剂盒购自瑞士Roche公司;LipofectamineTM2000转染试剂购自美国Thermo公司;MTS试剂购自美国Promega公司;胎牛血清、RPMI-1640培养基购自美国Gibco公司;Transwell小室购自美国Corning公司;Matrigel购自美国BD公司。
1.3 食管癌细胞系培养及转染
所有食管癌细胞系置于37 ℃、CO2体积分数为5%的条件下常规培养。取对数生长期的食管癌细胞,消化并铺至6孔板中继续培养,待细胞长至70%~80%且细胞状态良好时,准备转染。准备2个无菌的Eppendorf试管,其中1个加入5 μL转染试剂LipofectamineTM2000及100 μL RPMI-1640培养液,吹吸混匀,另1个加入50 nmol/L siRNA及100 μL RPMI-1640培养液,室温放置5 min,随后,将上述2个Eppendorf试管中液体吹吸混匀,室温温育20 min。转染24~48 h后收集细胞,验证转染后FAM83H的敲低效率,并进行后续的研究。

表1 食管鳞癌患者的临床病理学资料Tab.1 Clinicopathological characteristics of 67 ESCC patients
1.4 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测FAM83H在食管癌细胞系和食管鳞癌组织中的表达情况
按照RTFQ-PCR试剂盒说明书进行操作,以GAPDH作为内参,相对表达量以2-ΔΔCt表示。RTFQ-PCR引物序列见表2。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,可变温度退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸7 min,4 ℃保存。实验重复3次。
1.5 MTS实验检测FAM83H对食管癌细胞增殖能力的影响
转染细胞培养24 h后,调整细胞密度,按照1×103个细胞/孔接种于96孔板上,每组设6个复孔。分别在细胞贴壁后0、24、48、72和96 h向每孔中加入MTS试剂20 μL,培养箱中温育1~3 h后,酶标仪测定490 nm波长处的吸光度(D)值。
1.6 Transwell小室迁移、侵袭实验检测FAM83H对食管癌细胞迁移、侵袭能力的影响
Transwell小室迁移实验:在转染细胞培养24 h后,调整细胞密度,向上室中加入200 μL RPMI-1640培养液(含1×105个细胞),向下室中加入600 μL含10%胎牛血清的培养基,常规培养24 h,将小室置于4%多聚甲醛溶液中固定后在结晶紫染液中染色,在倒置显微镜下随机选取5个视野并进行细胞计数。
Transwell小室侵袭实验:首先在上室中加入50 μL稀释好的Matrigel,确保Matrigel充分凝固进行后续实验,其余实验方法同transwell小室迁移实验。
1.7 统计学处理
采用SPSS 21.0软件进行数据分析,两组之间的比较在服从正态分布时,采用t检验,不符合正态分布时,差异比较采用Wilcoxon秩和检验。多组间的均数比较采用单因素方差分析。以上均为双侧检验,P<0.05为差异有统计学意义。

表2 RTFQ-PCR引物Tab.2 Primer sequences of RTFQ-PCR
2 结果
2.1 TGF-β1处理7 d后食管癌细胞Eca109的形态学变化
食管癌细胞Eca109经过10 ng/mL TGF-β1处理7 d后,在显微镜下观察Eca109变为细长梭形、纺锤形,呈现出明显的间充质细胞形态(图1)。
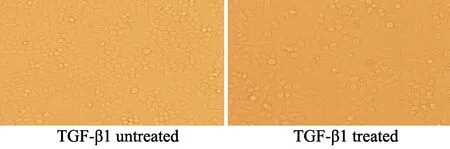
图1 TGF-β1处理前后Eca109细胞的形态学变化Fig.1 Cell morphology in TGF-β1 treated or untreated Eca109 cells
2.2 TGF-β1处理7 d后食管癌细胞EMT相关标志物的表达水平变化
RTFQ-PCR结果显示,与TGF-β1未处理细胞相比,处理后细胞中EMT相关标志物表达水平改变,其中E-cadherin[(0.44±0.05)vs(1.03±0.23),P<0.05]表达量下调,而N-cadherin[(10.59±1.14)vs(1.11±0.17),P<0.0 1]、vimentin[(1.3 9±0.0 6)v s(1.02±0.02),P<0.01]、Snail[(3.62±0.22)v s(1.0 5±0.1 2),P<0.0 1]和Twist1[(1.67±0.14)vs(0.95±0.08),P<0.01]表达量均上调(图2)。
2.3 TGF-β1处理7 d后FAM83H的表达水平变化
RTFQ-PCR结果显示,与TGF-β1未处理的细胞中FAM83H的相对表达量相比,TGF-β1处理后FAM83H的相对表达量显著升高[(4.66±0.35)vs(1.06±0.12),P<0.01,图3]。
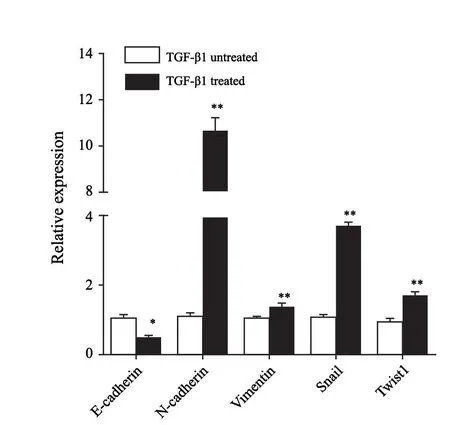
图2 TGF-β1处理前后Eca109细胞中EMT相关标志物的表达变化Fig.2 Relative expression levels of EMT-related markers were detected in TGF-β1 treated or untreated Eca109 cells
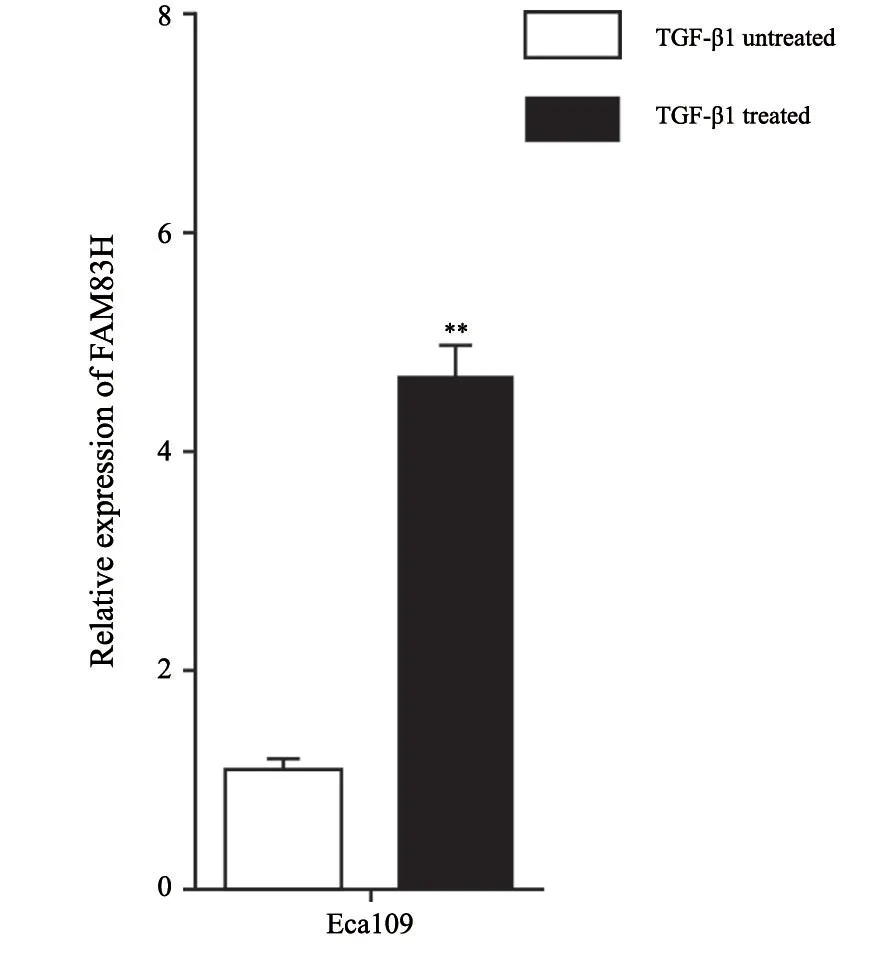
图3 TGF-β1处理前后Eca109细胞中FAM83H表达变化Fig.3 Relative expression level of FAM83H was assessed in TGF-β1 treated or untreated Eca109 cells
2.4 FAM83H在食管鳞癌组织中的表达及其表达水平与患者临床病理学参数间的相关性
利用RTFQ-PCR检测FAM83H在67例食管鳞癌组织及相应的癌旁正常组织中的表达情况。结果显示,FAM83H在食管鳞癌组织中的相对表达量显著高于癌旁正常组织[1.05(0.50,2.31)vs0.59(0.27,1.72),Z=-2.53,P<0.05](图4)。结合临床病理学参数分析,FAM83H表达量在低分化组患者中显著高于中、高分化组患者[3.58(1.39,6.91)vs1.18(0.74,3.44),Z=-2.39,P<0.05]。按照年龄、性别、TNM分期、浸润深度、淋巴结转移等分组进行统计分析,各组ESCC组织中FAM83H的表达量差异均无统计学意义(P>0.05,表1)。
2.5 FAM83H在食管癌细胞系中的表达
通过RTFQ-PCR计算在4株食管癌细胞Kyse170、TE1、Kyse150和Eca109中FAM83H的相对表达量,结果分别为4.1 7±0.4 7、11.35±1.54、13.80±1.60和3.37±0.23,均高于食管上皮细胞HEEpiC的相对表达量(0.98±0.06),差异有统计学意义(P<0.01),且在Kyse150细胞中的表达水平最高(图5)。
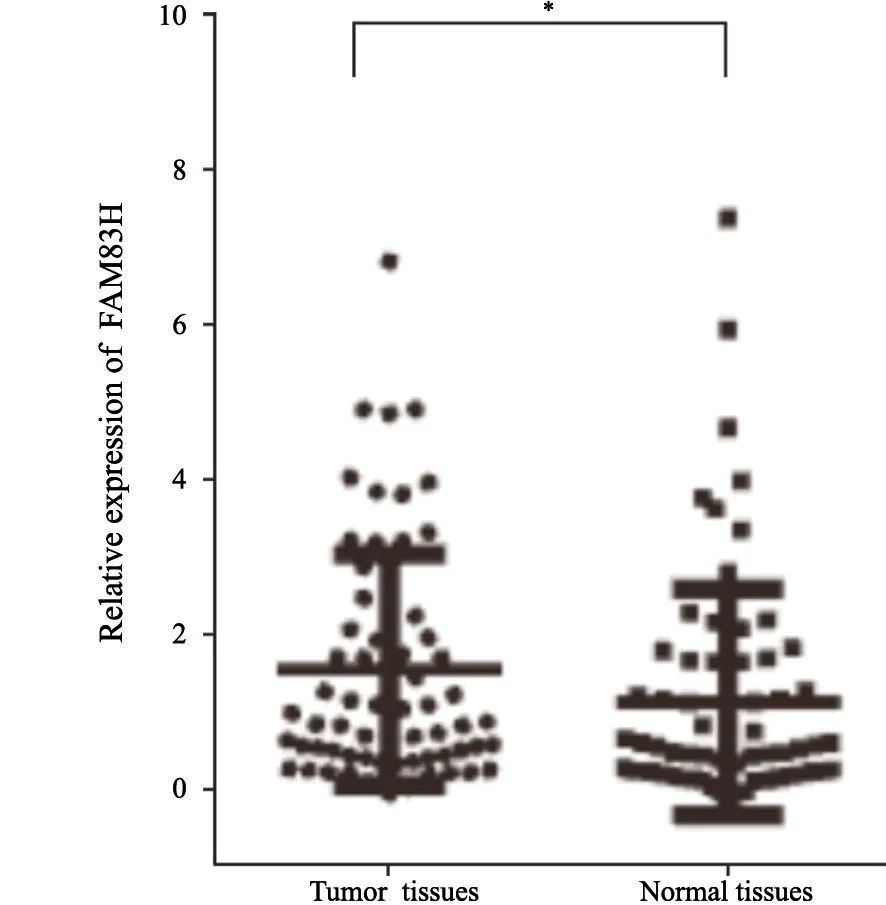
图4 FAM83H在食管鳞癌组织和相应癌旁正常组织中的表达水平Fig.4 Relative expression level of FAM83H in ESCC tissues and corresponding normal tissues
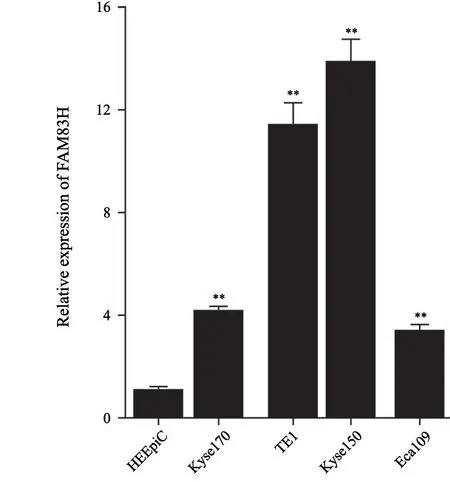
图5 FAM83H在4株人食管癌细胞系中的表达水平Fig.5 Relative expression level of FAM83H in four human esophageal cancer cell lines
2.6 转染si-FAM83H后检测FAM83H的敲低效率
在FAM83H中表达水平较高的Kyse150转染si-FAM83H,采用RTFQ-PCR检测FAM83H的相对表达量,与转染si-NC组(0.92±0.10)相比,转染si-FAM83H-1、si-FAM83H-2和si-FAM83H-3组FAM83H的相对表达量分别为0.29±0.04、0.88±0.15和0.53±0.11。其中,si-FAM83H-1具有显著的敲低效率(P<0.01,图6),用于后续的实验研究。
2.7 敲低FAM83H抑制食管癌细胞的增殖能力
MTS实 验 结果 显 示,si-FAM83H-1 组与对照组相比能显著抑制食管癌细胞的增殖能力,并且在干扰48 h[(0.59±0.07)v s(0.8 3±0.0 5),P<0.0 1]和7 2 h[(0.72±0.06)vs(1.05±0.10),P<0.01]后差异有统计学意义(图7)。
2.8 敲低FAM83H抑制食管癌细胞的迁移及侵袭能力
Transwell小室迁移实验结果显示,si-FAM83H-1组穿膜细胞数(329.00±36.13)显著低于对照组(431.00±55.65),差异有统计学意义(P<0.05,图8A)。Transwell小室侵袭实验结果显示,si-FAM83H-1 组穿膜细胞数(382.00±46.0)显著低于对照组(5 5 1.0 0±2 6.6 1),差异有统计学意义(P<0.01,图8B),说明敲低FAM83H能够显著抑制食管癌细胞的迁移及侵袭能力。
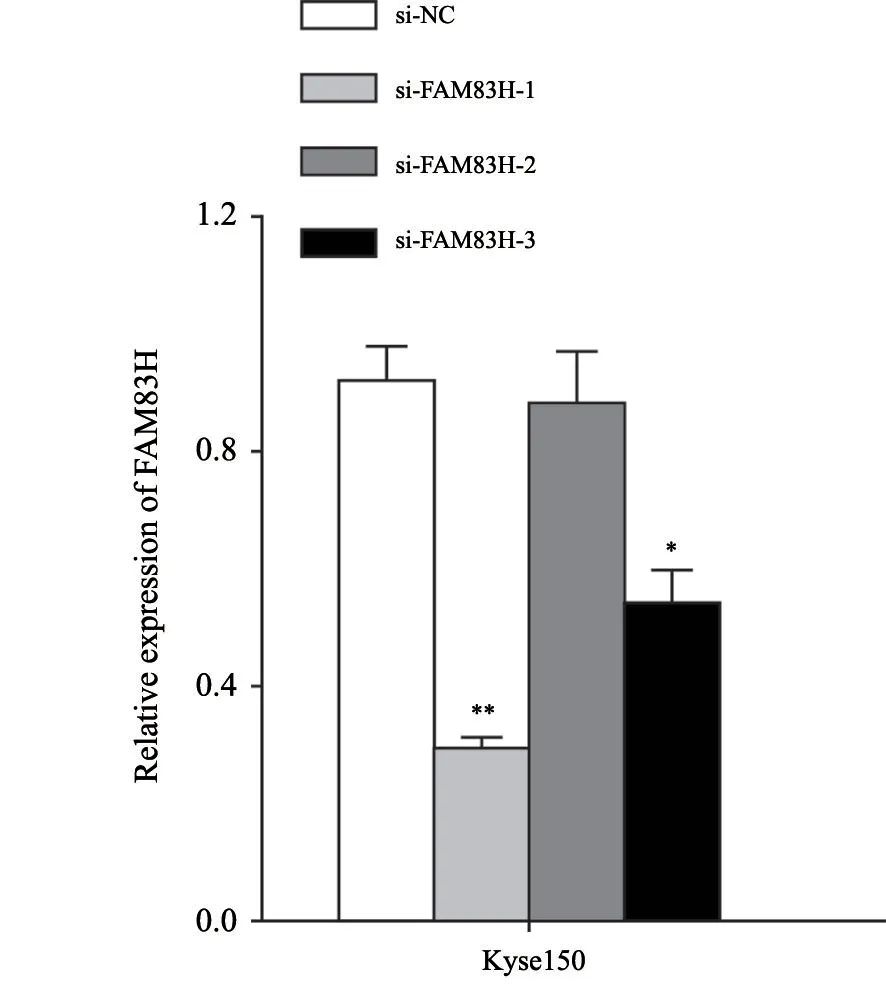
图6 FAM83H敲低效率Fig.6 The interfering efficiency against FAM83H

图7 敲低FAM83H抑制食管癌细胞的增殖能力Fig.7 FAM83H knockdown inhibits proliferation ability of esophageal cancer cells
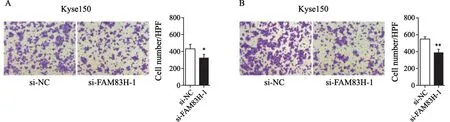
图8 敲低FAM83H抑制食管癌细胞的迁移及侵袭能力Fig.8 FAM83H knockdown inhibits migration and invasion of esophageal cancer cells
3 讨 论
肿瘤是一类多因素参与、多步骤进展的复杂性疾病。随着对肿瘤分子机制深入的研究,发现肿瘤发生、发展过程中大多伴随一些基因的异常表达,因此,筛选出肿瘤中特异性的异常基因,将为肿瘤的早诊早治奠定理论基础。
TGF-β信号通路在恶性肿瘤的EMT过程中发挥着关键作用,包括经典Smad及非经典Smad信号通路[3-5]。本研究利用TGF-β1处理食管癌细胞Eca109,成功诱导食管癌细胞发生EMT。在显微镜下可以观察到食管癌细胞由圆形、椭圆形变为细长梭形、纺锤形,细胞变得离散,细胞间黏附消失,呈现出明显的间充质细胞形态。同时EMT相关标志物表达水平也发生改变,其中上皮细胞标志物E-cadherin表达下调,间质细胞标志物N-cadherin、vimentin以及转录因子Twist1、Snail均表达上调。FAM83H在TGF-β1处理后的食管癌细胞中表达水平也上调,提示FAM83H有可能参与食管鳞癌的侵袭及转移。
有研究表明,FAM83 家族是潜在的癌基因家族,FAM83 家族共有8 个成员,FAM83A~FAM83H。除FAM83G外,其余成员基因N端附近都有一段保守且功能未知的结构域,称为DUF1669,这一结构可能与该家族成员的致瘤性密切相关。目前大量研究[6-15]表明,在多种实体肿瘤中该家族成员基因表达上调,例如,FAM83A在肺腺癌中表达升高,与肺腺癌临床分期及预后相关[6];在胰腺癌中高表达,与胰腺癌患者总生存率、无病生存率显著相关,发挥致癌作用[7]。FAM83B在食管鳞癌[8]、胃癌[9]中表达上调。FAM83D在肝癌[10]、结直肠癌[11]、卵巢癌[12]等肿瘤中表达上调。FAM83H在骨肉瘤、宫颈癌、肝癌等[13-15]恶性肿瘤组织中表达升高,但是在食管鳞癌中尚未见报道。因此,本研究检测了67对食管鳞癌组织及其相应癌旁正常组织中的表达情况,结果显示,FAM83H在食管鳞癌组织中表达水平显著升高,表明其在食管鳞癌中可能也发挥癌基因的作用。进一步研究FAM83H对食管癌细胞系生物学行为的影响,发现FAM83H促进食管癌细胞的增殖、迁移及侵袭能力。在骨肉瘤中,FAM83H与β-catenin直接结合,并通过蛋白酶体介导的β-catenin泛素化来调节β-catenin蛋白的稳定性,促进骨肉瘤的增殖及侵袭[13]。在宫颈癌中,FAM83H激活PI3K/AKT信号通路促进宫颈癌细胞的增殖、迁移及侵袭[14]。在肝癌中,MYC结合至FAM83H启动子区,促进FAM83H转录,导致肝癌组织中FAM83H表达水平升高,进而促进cyclin-D1、cyclin-E1、snail和MMP2的表达,抑制P53和P27的表达[15]。
综上所述,FAM83H在TGF-β1处理后的食管癌细胞中表达上调。同时FAM83H在食管鳞癌组织中的表达水平升高,并且其表达水平与病理学分化程度相关,在体外促进食管癌细胞的增殖、迁移及侵袭能力。对于FAM83H是如何促进食管鳞癌发生、发展,发挥促癌作用,还需要进一步的机制研究。

