节律因子BMAL1通过SHH信号转导通路影响胃癌MGC-803细胞的增殖
程 玉,郝美玲,薛 晶,齐洁敏
1.承德医学院病理学教研室,河北 承德 067000;2.承德医学院附属医院病理科,河北 承德 067000;3.承德医学院形态学实验中心,河北 承德 067000
胃癌是全球第4大常见癌症,每年将近100万人被诊断为胃癌,约78.3万人死于胃癌[1]。中国是胃癌的高发国家之一,发病率和死亡率均居第2位[2]。癌细胞的无限增殖是肿瘤发生、发展的基础,阐明胃癌细胞增殖的分子机制对胃癌的防治具有重要意义。昼夜节律因子组成转录翻译反馈环路(transcription-translation feedback loop,TTFL)产生昼夜节律,通过昼夜节律调控机体的各种生理功能[3]。BMAL1属于bHLH-PAS结构域转录因子家族,位于TTFL的核心部位,它能调控昼夜节律从而维持细胞和组织的生命活动[4]。最近多项研究证实,BMAL1在结直肠癌、舌鳞状细胞癌等恶性肿瘤中起到抑癌作用[5-6]。但关于BMAL1对胃癌细胞增殖等生物学行为的影响及下游信号通路的研究较少。因此,本研究通过体外细胞实验初步探讨BMAL1对胃癌细胞增殖的影响及可能的分子机制,以期为研究胃癌的发病机制及分子靶点治疗奠定理论基础。
1 材料和方法
1.1 材料
人胃癌细胞系MGC-803购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,胰蛋白酶、RPMI-1640培养基购自美国Gibco公司,胎牛血清购自澳大利亚Clark公司,LipofectamineTM3000转染试剂购自美国Invitrogen公司,si-BMAL1和siRNA control由美国GE公司设计合成;抗BMAL1抗体购自英国Abcam公司,抗SHH、SMO、GLI1、Cyclin D1抗体及辣根过氧化物标记的二抗购自美国Proteintech公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自天根生化科技(北京)有限公司,ECL发光试剂盒购自上海天能科技有限公司;MTT试剂购自上海碧云天生物技术有限公司,SHH信号通路抑制剂环巴胺购自美国MCE公司。
1.2 方法
1.2.1 细胞转染及分组
转染前24 h内将MGC-803细胞接种到6孔板内,待细胞汇合度达到50%~60%时进行细胞转染。转染前将6孔板内培养基换成不含血清的MEM,用LipofectamineTM3000试剂将si-BMAL1及乱序阴性对照转染至细胞内,6 h后换成含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基,在37 ℃、饱和湿度、CO2体积分数为5%的培养箱中继续培养。
1.2.2 蛋白质印迹法(Western blot)
转染48 h后,6孔板自温箱内取出,1×磷酸盐缓冲液(phosphate-buffered saline,PBS)洗3遍,每次5 min。用细胞刮刮取细胞至1.5 mL Eppendorf试管内,在4 ℃下以3 000 r/min离心5 min收集细胞沉淀,将沉淀内水分吸尽,加入适量蛋白裂解液,冰上裂解30 min后,在4 ℃下以12 000 r/min离心20 min后吸取上清液,考马斯亮蓝进行蛋白质定量,加入6×上样缓冲液配样后,在沸水中5 min变性。配制10%分离胶和5%浓缩胶,每个泳道中加入18 μL变性的蛋白样品,以80 V的低压在浓缩胶中进行电泳,以120 V的电压在分离胶中进行电泳。电泳结束后,100 V 1.5 h转膜。转膜结束后把聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜放在用TTBS稀释的5%脱脂奶粉中,室温摇床封闭2 h。加入按说明书浓度稀释的一抗,置于4 ℃冰箱内缓慢摇晃过夜,TTBS洗涤3次×10 min之后,加入对应二抗,室温温育2 h,TTBS洗涤3次×10 min,电化学发光(electrochemical luminescence,ECL)试剂盒进行显色,Bio-Rad凝胶成像系统进行拍照,以GAPDH为内参照,Image J软件分析灰度值。
1.2.3 MTT法
细胞转染24 h后,进行细胞计数,将各组细胞按2 000个细胞/孔接种到5个96孔板内,每组设5个复孔。分别培养1、2、3、4、5 d后,每孔加入100 μL 10%MTT,将孔板置于37 ℃培养箱中继续温育4 h,弃掉上清液,每孔中加入100 μL二甲基亚砜(dimethyl sulfoxide,DMSO),室温摇床10 min,用酶标仪检测490 nm波长处的吸光度(D)值。第3天给96孔板换液。以时间为横坐标,D值为纵坐标,绘制生长曲线。
1.2.4 平板集落形成实验
各组细胞转染24 h后,进行细胞计数,将各组细胞分别按500、800、1 000个细胞/孔接种到6孔板中,加入含10%FBS的1640培养基混匀,每3 d换液1次,连续培养10 d左右,肉眼观察到细胞集落形成时,去除培养基,1×PBS洗3次,每次5 min,冰甲醇固定15 min,1×PBS洗3次,每次5 min,0.1%结晶紫染色15 min,流水缓慢冲洗掉染液,自然晾干后拍照,用Image J软件计算集落数。
1.3 统计学处理
使用SPSS 20.0软件对实验数据进行统计学分析,实验重复3次。计量资料用x±s表示,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMAL1 si-RNA下调胃癌MGC-803细胞中BMAL1的表达
与阴性对照(negative control,NC)组(0.817±0.076)相比,转染si-BMAL1后,MGC-803细胞中BMAL1蛋白的表达水平(0.217±0.104)明显降低(P<0.05),相对于阴性对照组,沉默效率为73.47%(图1),说明成功构建了下调BMAL1表达的胃癌MGC-803细胞株。

图1 si-BMAL1对胃癌MGC-803细胞中BMAL1表达的影响Fig.1 The effect of si-BMAL1 transfection on BMAL1 expression in the MGC-803 cells
2.2 敲减BMAL1基因上调胃癌MGC-803细胞活力
MTT实验评估胃癌细胞体外增殖能力,与NC组相比,si-BMAL1组在第3、4、5天的细胞数目显著增加,D值分别为0.236±0.004、0.343±0.050、0.488±0.036(P<0.05,图2)。与NC组(65.000±10.000)相比,si-BMAL1组(155.667±11.015)的细胞集落形成数明显增多(P<0.05,图3)。MTT实验及集落形成实验结果提示敲减BMAL1基因促进胃癌细胞的增殖。

图2 BMAL1基因敲减对各组MGC-803细胞生长曲线的影响Fig.2 The effect of BMAL1 gene knockdown on growth curve of MGC-803 cells in different groups
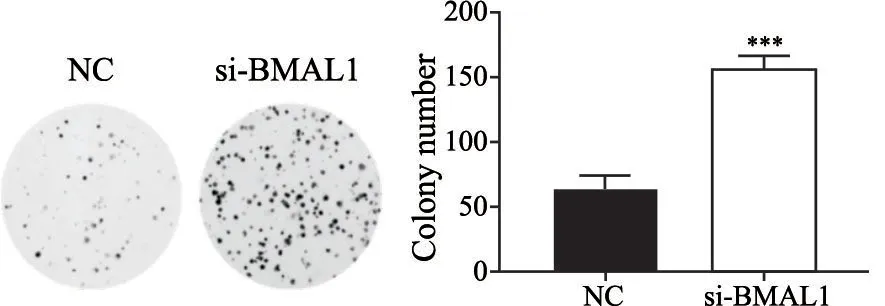
图3 BMAL1基因敲减对各组MGC-803细胞集落形成的影响Fig.3 The effect of BMAL1 gene knockdown on colony formation of MGC-803 cells in different groups
2.3 敲减BMAL1后胃癌MGC-803细胞中cyclin D1蛋白水平升高,并促进SHH信号通路激活
与NC组(0.540±0.072、0.447±0.703、0.400±0.050、0.300±0.050)相比,si-BMAL1组中cyclin D1蛋白水平(1.200±0.100)明显升高,SHH通路关键激活因子SHH(0.830±0.070)、SMO(0.743±0.050)、GLI1(0.700±0.050)表达水平也升高(P<0.05,图4),说明下调BMAL1表达可以明显促进胃癌MGC-803细胞中SHH信号通路的激活。

图4 敲减BMAL1基因对MGC-803细胞中cyclin D1、SHH、SMO和GLI1蛋白水平的影响Fig.4 The effects of BMAL1 gene knockdown on the protein levels of cyclin D1,SHH,SMO and GLI1 in MGC-803 cells
2.4 SHH信号通路特异性抑制剂对si-BMAL1的胃癌MGC-803细胞活力的影响
SHH信号通路特异性激活剂环巴胺处理si-BMAL1的胃癌MGC-803细胞,si-BMAL1组细胞形成集落数为82.333±4.933,si-BMAL1+环巴胺组细胞形成集落数为91.667±7.024,敲减BMAL1带来的胃癌细胞克隆形成数目增多的情况有所恢复(图5)。
2.5 抑制SHH信号通路逆转下调BMAL1对细胞中cyclin D1、SHH、SMO和GLI1蛋白水平的影响
与si-BMAL1组(1.140±0.125、0.853±0.110、0.770±0.111、0.700±0.100)相比,si-BMAL1+环巴胺组细胞中的cyclin D1蛋白水平(0.937±0.061)并未出现之前上调的变化,SHH(0.473±0.097)、SMO(0.407±0.040)和GLI1(0.343±0.067)蛋白水平明显降低(P<0.05,图6)。

图5 抑制SHH信号通路对敲减BMAL1基因诱导MGC-803细胞增殖的影响Fig.5 The effects of inhibition of SHH signaling pathway on BMAL1 gene knockdown-induced proliferation of the gastric cancer cells

图6 抑制SHH信号通路对敲减BMAL1基因表达的MGC-803细胞中cyclin D1、SHH、SMO和GLI1蛋白水平的影响Fig.6 The effects of SHH signaling pathway inhibition on the protein levels of cyclin D1,SHH,SMO and GLI1 in the gastric cancer cells with BMAL1 gene knockdown
3 讨 论
肿瘤细胞失控性生长是恶性肿瘤最基本的特征,侵袭、转移等其他生物学行为也是建立在此基础之上,因此关于肿瘤细胞生长调控的研究一直是一个热点问题。大量基因表达微阵列研究表明,昼夜节律基因与细胞周期进展、增殖和凋亡有关[7],但是具体的调控机制仍未完全明确。昼夜节律由一系列的生物节律因子调控,其中BMAL1是组成节律基因负反馈环路的核心元件,对于维持机体正常昼夜节律极其重要。BMAL1定位于11号染色体短臂,属于bHLH-PAS结构域蛋白家族,而BMAL1调控其他生物钟基因转录起始,激活哺乳动物生物钟基因的表达,包括BMAL1在内的这些生物钟基因在调节昼夜节律中发挥着至关重要的作用[8]。
多项研究证实,BMAL1的异常表达可能参与肿瘤的多种恶性生物学行为[5-6]。BMAL1在舌鳞状细胞癌组织及细胞中表达下调、生物周期节律重置,主要表现为周期缩短、振幅明显降低,提示生物钟基因表达异常以及生物节律紊乱与舌鳞状细胞癌紧密相关[6]。节律因子的表达异常及节律改变势必会打破细胞周期的平衡,导致肿瘤细胞的大量、无限增殖。目前关于节律因子BMAL1在肿瘤中的作用多表现出抑癌作用,He等[9]报道与远处正常和慢性炎症组织相比,鼻咽癌组织标本中BMAL1的表达降低,BMAL1在中国鼻咽癌患者中表达的降低与患者的总生存期短有关,提示BMAL1可能是鼻咽癌中的抑癌蛋白。Qiu等[10]结合转录组测序技术及多种数据库分析14种节律基因在非小细胞肺癌及癌旁组织中的表达,发现BMAL1在肺癌组织中通常呈低表达,而BMAL1高表达的患者生存期更长,也就是说BMAL1在非小细胞肺癌中也扮演着抑癌基因的角色。本研究集中探讨了生物节律因子BMAL1对胃癌细胞增殖能力的影响及可能的下游信号通路。通过MTT法及集落形成实验证实,敲减BMAL1基因可促进胃癌细胞的增殖,也就是说BMAL1抑制胃癌细胞的生长,这与魏柏等[11]的研究结果一致,但具体的作用机制尚不明确。
最近有研究报道,在小鼠肝脂肪变性模型中,体内肝脏及体外肝细胞中Hh信号通路都表现出昼夜节律变化,并且敲低BMAL1表达后,IHH及GLI1蛋白水平上调[12]。昼夜节律与IHH信号通路的交互对话提示我们BMAL1可能是通过SHH信号通路从而影响胃癌细胞的增殖。于是我们在敲减BMAL1基因的表达后检测SHH信号通路关键蛋白SHH、SMO及GLI1的表达,结果SHH、SMO及GLI1表达均上调,与上述实验结果一致。为了进一步证实我们的猜想,我们又在干扰BMAL1之后加入SHH通路抑制剂环巴胺,发现环巴胺能下调SHH、SMO及GLI1的表达,之前干扰BMAL1之后促进胃癌细胞增殖的现象有所恢复,提示BMAL1确实是通过SHH信号通路影响胃癌细胞的增殖。在典型通路中,哺乳动物中Hh配体有SHH、IHH和DHH 3种类型,该通路由两个受体组成,一个负调节因子PTCH和一个正调节因子SMO,Hh与PTCH1的结合抑制了SMO,导致SMO在纤毛中积累并在细胞质末端磷酸化,这一过程介导下游信号转导,锌指转录因子(GLI1、GLI2、GLI3)通过SMO被激活进入细胞核中,与启动子的靶DNA序列结合,表达特定的基因,如编码c-MYC、BCL2和SNAIL基因[13]。SHH基因定位于7q36染色体上,是人类3种Hedgehog同源基因中最为重要、研究最为广泛的一种,在人类的多种组织和器官中广泛存在[14]。SHH通路参与胚胎发生、组织分化、自我更新、体内平衡和成体干细胞增殖,尤其在消化系统中作用更为明显[15]。除维持正常生理功能外,SHH信号通路在多种恶性肿瘤组织中异常激活,其参与肿瘤的发生、发展,抑制SHH信号通路可以下调肿瘤细胞的恶性表型,诱导肿瘤细胞凋亡[16]。
综上,敲减BMAL1基因表达可以通过抑制SHH信号通路的激活促进胃癌细胞的增殖。本研究阐明了BMAL1对胃癌细胞增殖的作用及下游的信号通路,为明确胃癌的发病机制奠定了理论基础。

