HSD3B1基因多态性与前列腺癌临床病理学特征的相关性分析
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032
前列腺癌是男性癌症死亡的第5大原因[1]。雄激素剥夺治疗(androgen-deprivation therapy,ADT)是过去70年里最有效、应用最广泛的前列腺癌治疗手段[2]。90%~95%的雄激素来源于睾丸,临床上通过ADT抑制性腺的合成来延缓前列腺癌的进展,但肿瘤仍受肾上腺前体类固醇的调节。HSD3B1是3β-羟基类固醇脱氢酶-1(3β-hydroxysteroid dehydrogenase-1,3β-HSD1)的编码基因,3β-HSD1是催化肾上腺前体类固醇转化为雌激素、睾丸酮和双氢睾丸酮的关键酶[3]。当HSD3B1的1245位点发生突变时,会促进双氢睾丸酮的合成,使得患者ADT的有效期缩短从而导致去势抵抗型前列腺癌(castrationresistant prostate cancer,CRPC)的发生[4-5]。Chang等[6]提出了一种假说来解释这种现象:HSD3B1基因1245位点的突变会导致编码的改变(N367T),但这不会改变3β-HSD1的活性,其影响是酶的泛素化和降解都减少了,最终导致酶的丰度增加,催化更多的双氢睾丸酮的合成,使得具有HSD3B1突变的人更容易发展为CRPC。Hearn等[7]通过研究发现,不同基因型的前列腺癌患者从接受ADT到进展为CRPC的无进展生存期存在显著差异,CC、AC和AA基因型患者的中位无进展生存期分别为2.5、4.1和6.6年。Hearn等[8]近期发表的研究结果还显示,在低负荷转移的患者中,对比AA型基因携带者,CC型和AC型患者的5年总生存率和ADT有效作用时间明显降低,但两组患者在高负荷转移方面并无差异。HSD3B1基因多态性和包括转移负荷在内的前列腺癌临床病理学特征的相关性在中国人群中缺乏足够的数据支持。为探究HSD3B1基因多态性与前列腺癌临床病理学特征的相关性,同时比较中国人群与其他人种HSD3B1基因突变频率的差异,对2014年6月—2019年6月在复旦大学附属肿瘤医院确诊为前列腺癌的180例患者的DNA进行测序。分析测序结果与前列腺癌临床病理学特征的相关性,同时比较中国人群与其他人种HSD3B1基因突变频率的差异。
1 材料和方法
1.1 相关文献的纳入
检索PubMed、Web of Science、Science Direct、Wiley Online Library、中国知网和万方数据库,搜集关于rs1047303基因多态性和前列腺癌的文献,检索时限均从2012年8月到2020年3月。此外,追溯纳入文献的参考文献,以补充获取相关文献。检索采取主题词和关键词相结合的方式。中文检索词为HSD3B1、rs1047303、基因多态性和前列腺癌,英文检索词为HSD3B1、rs1047303、polymorphism和prostate cancer。文献纳入标准:①至2020年3月公开发表的评价HSD3B1基因与前列腺癌相关性的中英文研究报道;②可以对基因数据进行量化的文献。排除标准:①重复研究;②研究对象不是人类。研究提取的内容:第一作者、文献出版时间、各基因型患者的例数、国家或地区、病理学特征(种族)。纳入文献相关研究的基本情况见表1。
1.2 研究对象
本回顾性研究纳入了2014年6月—2019年6月复旦大学附属肿瘤医院泌尿外科收治的180例前列腺癌患者,前列腺癌的诊断基于前列腺穿刺活检的病理学检查结果。为保证样本数据有代表性,对有意愿进行基因检测的前列腺癌患者进行了连续入组。180例前列腺癌患者的临床信息来自于患者诊疗记录及随访调查,CRPC的诊断遵循欧洲泌尿外科协会的指南[9]。研究得到复旦大学附属肿瘤医院伦理委员会的批准,所有入组患者均签署知情同意书,且被告知潜在风险与获益。
1.3 基因测序
在本研究中,提取患者基因组DNA。对启动子区、所有外显子、外显子-内含子接头和3’非翻译区(3’ untranslated region,3’UTR)的聚合酶链反应(polymerase chain reaction,PCR)产物进行测序,以识别HSD3B1中的多态性。HSD3B1 基因下游引物为5’-AAGCAGAAAACGGTGGAGTG-3’,上游引物为5’-TTCACTGTTCCCGTGTTCGA-3’。PCR系统为:0.2 mmol/L dNTP、50 μL基因组DNA 100 ng、0.5 μL DNA聚合酶和0.2 μmol/L引物。扩增的条件为:98 ℃下使DNA变性15 s,52 ℃下退火20 s,68 ℃下DNA扩增20 s,共38个循环。PCR和测序研究均独立重复。
1.4 统计学处理
采用SPSS 22.0软件进行统计学分析。所有检验均为双侧。P<0.05为差异有统计学意义,对连续变量采用Student’st检验,对分类变量采用χ2检验或Fisher精确检验法,指标包括中国人群与其他人种HSD3B1基因的突变频率、发病时年龄、ADT前前列腺特异性抗原(prostate-specific antigen,PSA)值、Gleason评分、转移负荷和临床病理学分期。
2 结果
将HSD3B1基因型为AA型的人群列为正常组,为CC型和AC型则列为突变组。文献纳入的基本情况:经检索得到相关文献177篇,依照纳入和排除标准进行筛选,最后有5篇文章纳入研究。其中英文文献4篇,中文文献1篇,累计纳入前列腺癌723例,其中HSD3B1突变组共364例,正常组358例,文献质量较高。纳入文献相关的基本情况及质量评估见表1。
在复旦大学附属肿瘤医院进行测序的180例前列腺癌患者中,HSD3B1基因1245位点发生突变者共20例,未发生突变的有160例,AA基因型频率为86.7%,AC为13.0%,CC为0.3%,突变频率为13.3%。将复旦大学附属肿瘤医院泌尿外科HSD3B1的数据与文献报道的数据整合的结果显示,中国人群的突变频率显著低于美国的突变频率(13.3%vs55.8%,P=0.01,表2)。

表1 纳入研究的基本特征Tab.1 Main characteristics of included studies
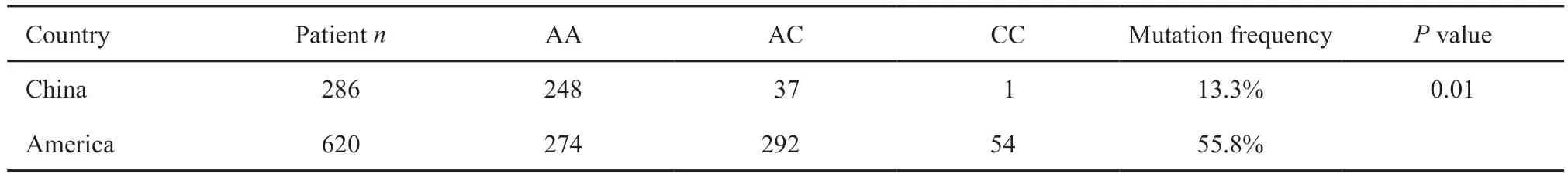
表2 美国和中国HSD3B1基因的各基因型分布Tab.2 Distribution of genotypes of HSD3B1 gene in the America and China
在确诊年龄方面,突变组患者的平均发病年龄[(61±8)岁]显著低于正常组[(66±7)岁],两组差异有统计学意义(P=0.021)。在ADT前PSA值方面,正常组平均值为26 ng/mL,突变组为140 ng/mL,两组差异无统计学意义(P=0.314)。在Gleason评分方面,160例正常组患者的有效例数为135例,其中评分≤7分者29例,8~10分者106例;20例突变组患者的有效例数为14例,其中≤7分者3例,8~10分者11例,两组差异无统计学意义(P=0.649)。在TMN分期方面,160例正常组患者的有效例数为159例,其中未发生转移者47例,发生转移者112例;突变组未发生转移者8例,发生转移者12例,两组差异无统计学意义(P=0.340)。在转移负荷方面,160例正常组患者的有效例数为159例,其中高转移负荷者47例,低转移负荷者112例;突变组中高转移负荷者7例,低转移负荷者13例,两组差异无统计学意义(P=0.507,表3)。

表3 研究对象的临床信息Tab.3 Characteristics of the patients
3 讨 论
自从Huggins等[14]于1941年发表了关于抗雄激素治疗效果的开创性研究结果以来,ADT一直是前列腺癌全身治疗的基石,但预测前列腺癌患者对ADT的先天敏感性和先天抗性至今仍然是一项挑战。之前有研究[15]分析了包括HSD3B1在内的与类固醇合成相关的109个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,但并没有发现SNP与术后生化复发之间有明显关联。然而,该研究主要队列中的大多数患者并没有接受过ADT,这对HSD3B1研究是至关重要的,因为在去势条件下,携带变异等位基因的前列腺癌细胞会有生长优势[15]。HSD3B1基因核苷酸的1245位点由A→C,导致该位点所在序列最终翻译出苏氨酸而不是原本的天冬酰胺,这使得由HSD3B1基因编码的3β-HSD1半衰期变长了,从而能在ADT后比未携带突变的患者产生更多的雄烯二酮和双氢睾丸酮,最终导致前列腺癌细胞的去势转化[4]。一种能够预测ADT耐药性的生物标志物带来的影响是深远的。对于携带HSD3B1(1245C)等位基因的前列腺癌患者,尤其是纯合变异基因型患者,在前列腺癌细胞发生去势转化之前是至关重要的[7]。
此前吴刚等[16]的研究探究了中国人群的HSD3B1基因多态性与CRPC形成时间、CRPC形成率和生存时间之间的关系,发现突变组与正常组仅在CRPC形成率方面的差异有统计学意义。而Hearn等[7]通过3个美国人群的队列揭示了HSD3B1基因的位点突变与无进展生存期、无远处转移生存期和总生存期的降低有关。复旦大学附属肿瘤医院泌尿外科也分析了不同基因型晚期前列腺癌患者的内分泌治疗效果,但并没有发现差异有统计学意义的结果,可能有以下原因:①由于中国人群目标基因的突变频率较低,同时样本数量有限,导致最终得到的突变基因型例数较少,在一定程度上影响了统计学分析的准确性;② CRPC的发生是一个相对缓慢的过程,需要一定的观察时间,此前吴刚等[16]的研究中晚期前列腺癌患者的随访时间在3年以上,而在本研究中有46例患者开始ADT的时间在2019—2020年,导致平均随访时间只有17个月,无法观察到更多的患者发生CRPC。因此要了解中国人群中HSD3B1基因多态性对于CRPC形成的影响,长时间的大样本研究是必不可少的。
Hearn等[8]的研究显示,与低转移负荷带来的影响不同,HSD3B1基因在高转移负荷人群中无法预测CRPC的发生。有大量研究证明,高转移负荷人群和低转移负荷人群的临床进程是不相同的[17]。从局限性前列腺癌进展到转移性去势敏感前列腺癌或非转移性CRPC、再进展到转移性CRPC的过程中,前列腺癌患者的突变谱逐渐增大[18-19]。所以,有可能相比于低转移负荷人群,高转移负荷人群体内各种突变结果的相互作用削弱了HSD3B1基因介导的生物因子的作用。基于转移负荷的人群分类可能是研究HSD3B1基因对中国人群CRPC影响的因素之一,但尚未见相关的报道,所以本研究对HSD3B1基因多态性与临床病理学特征的相关性进行了探究。
综上,复旦大学附属肿瘤医院泌尿外科通过对DNA的测序中得出中国前列腺癌患者HSD3B1基因的突变频率,并将中国人群的基因数据与其他人群作对比,发现中国人群HSD3B1基因的突变频率显著低于美国人群的突变频率。并且,对于中国人群而言,由于HSD3B1基因的突变频率很低,所以它对于预测ADT效果的价值有限。此外,本研究并没有发现HSD3B1基因多态性与PSA值、Gleason评分、转移负荷和临床病理学分期等指标的相关性。

