继发性白血病患者T细胞亚群检测
叶倩舲,宋明珠,王会平,肖 浩,翟志敏
急性髓系白血病发病机制复杂,据既往有无治疗和疾病史,通常可将其分为原发性急性髓系白血病(primary acute myeloid leukemia,P-AML)和继发性髓系白血病(secondary acute myeloid leukemia,S-AML)两类。S-AML是指前期存在骨髓增生异常综合征或有明确职业及环境暴露史 ,或继发于放、化疗之后所形成的白血病[1]。与P-AML比较,S-AML发病率较低,但治疗过程更为复杂,生存期更短,预后更差[2]。该文旨在了解与分析S-AML患者的T细胞亚群,为进一步探究其发病机制奠定相关的理论基础。
1 材料与方法
1.1 病例资料2010年1月~2019年11月安徽医科大学第二附属医院收住的17例S-AML患者、23例P-AML患者。
1.2 主要试剂与仪器CD25-FITC、CD127-PE、CD4-PC5、CD4-FITC/CD8-PE/CD3-PC5试剂盒,以及相关同型对照抗体购自美国Beckman-Coulter公司;溶血剂为0.83%的氯化铵溶液,由本实验室加去离子蒸馏水自行配制;流式细胞仪为美国Beckman-Coulter公司临床应用型流式细胞仪FC500,分析软件为CXP软件。
1.3 实验方法外周静脉血2 ml,肝素钠抗凝。采用直接荧光法标记细胞膜表面各个抗原(包括CD3、CD4、CD8、CD25和CD127),检测不同T淋巴细胞亚群比:识别总T淋巴细胞(CD3+T细胞)、辅助性T淋巴细胞(CD3+CD4+T细胞)、细胞毒性T淋巴细胞(CD3+CD8+T细胞)、调节性T细胞(Treg细胞,CD4+CD25+CD127low)和活化效应性T细胞(Teff细胞群,CD4+CD25+CD127hi)。具体方法如下:取2个试管分别加入抗凝全血100 μl,其中一管加入检测抗体各10 μl,另一管加入相应的同型对照抗体各10 μl,混匀后室温下避光反应15 min;加溶血剂1 000 μl混匀,室温下放置10 min;立即上流式细胞仪检测。
开机后对流式细胞仪进行光路和流路质量控制和荧光补偿,使仪器各项指标在质量控制的允许值范围。检测样本时根据前向散射光信号( forward sCattering,FSC)和侧向散射光信号(side sCattering,SSC)对淋巴细胞群设门,每份标本获取淋巴细胞10 000个以上,数据以Listmode文件形式保存。
1.4 统计学处理Excel 2007录入数据,IBM-SPSS 23.0软件进行统计分析,正态分布采用均值标准差描述,组间比较采用单因素方差分析,差异有统计学意义时采用LSD法进行多组间两两比较;偏态分布资料采用M(P25,P75)描述,组间比较采用Kruskal-Wallis H检验,差异有统计学意义时采用Mann-Whitney U检验进行多组间两两比较(调整检验水准α=0.017);定性资料组间比较采用χ2检验。检验水准α=0.05。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料S-AML患者17例,男10例,年龄25~78(56.94±16.52)岁;阳性对照组,P-AML患者23例,男10例,年龄20~82(56.74±16.44)岁;健康对照34例,男13例,年龄26~77(48.38±14.95)岁。3组年龄(F=2.629,P=0.079)、性别(χ2=1.961,P=0.375)间差异无统计学意义。其中S-AML、P-AML诊断均符合世界卫生组织急性髓系白血病诊断标准。S-AML组患者一般信息见表1。
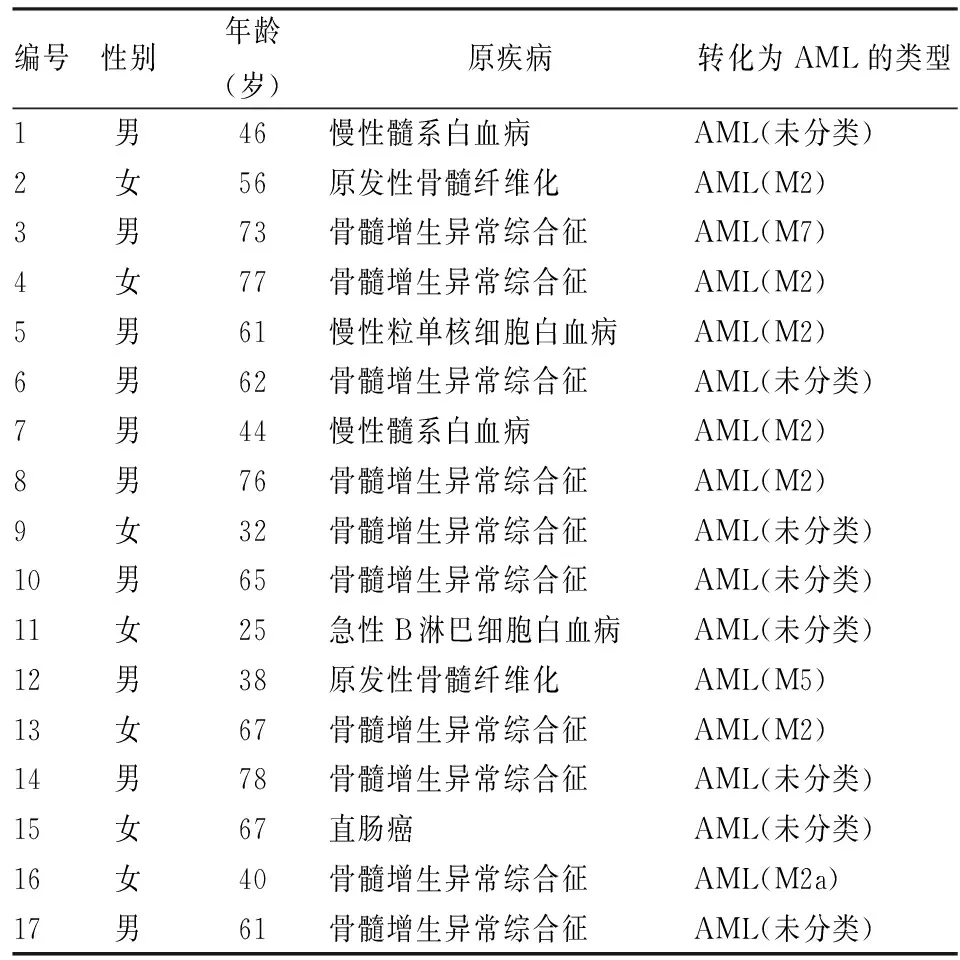
表1 S-AML组研究对象一般情况
2.2 不同T淋巴细胞亚群的检测结果Treg细胞在3组间差异存在统计学意义(P<0.001),其中S-AML组Treg水平高于健康对照组与P-AML组(P<0.05),P-AML组高于健康对照组(P<0.05);Treg/Teff比例在3组间差异也存在统计学意义(P=0.014),S-AML组比值高于健康对照组 (P=0.009)。与健康对照组相比,P-AML和S-AML患者其余的T细胞亚群包括CD3+CD4+T、CD3+CD8+T细胞数量及CD4/CD8比值差异均无统计学意义(P>0.05),见表2。
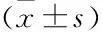
表2 S-AML、P-AML与对照组T淋巴细胞亚群各亚群检测结果
3 讨论
继发性白血病由外国学者Smit et al[3]于1970年首次报道,发病率远低于P-AML。由于该病致病因素复杂,人们虽对其发病机制进行了近50年的探索,然而迄今尚无法明确它的病理机制。现一般被分为两类:一类为实体肿瘤经过综合化疗继发的S-AML,认为与拓扑异构酶抑制剂、烷化剂等化疗治疗相关;另一类则由多种髓系相关血液疾病转化形成,包括骨髓增生异常综合征(myelodysplastic syndrome,MDS)、原发性骨髓纤维化( primary myelofibrosis,PMF)、慢性髓系白血病( chronic myeloid leukemia,CML)等,其中以MDS为主,这一类疾病均有着不同程度向急性白血病转化的风险。
MDS是一组起源于异质性恶性造血干祖细胞的克隆性疾病,特征包括血细胞异型增生、无效造血,多见于老年人,具有程度不一的急性白血病转化风险;造血细胞从正常的干细胞转化成MDS细胞是一个复杂的过程,包括基因突变、抑癌基因缺失或功能不全、以及与分化增殖有关的信号传导异常等[4]。PMF、CML等这一类骨髓增殖性疾病,其主要特点包括骨髓纤维组织增生,一系或多系髓系细胞过度增殖以致外周血过度聚集,疾病终末期多形成无效造血及转化为急性白血病[5-6]。相较于原发性白血病,上述髓系血液系统疾病患者一旦转化为急性白血病,自然病程更短,对化疗药物反应敏感性及反应性均较差,给临床治疗带来极大困难。Treg细胞是机体内一群特殊的免疫细胞,在人类外周血CD4+T细胞中不足10%,但具有免疫抑制和免疫无能功能,被认为在肿瘤性疾病中发挥着重要作用[7]。现已发现,在肺癌、乳腺癌、卵巢癌、消化系统肿瘤、急性淋巴细胞白血病等多种肿瘤性疾病中,Treg细胞水平均明显升高[8-9],这可能是因为Tregs细胞能够抑制T、B淋巴细胞、NK、NKT等多种免疫细胞功能,导致机体处于免疫抑制状态,从而使肿瘤发生的风险升高[10-11]。
因此,对S-AML这种血液肿瘤的Treg细胞进行检测与分析有着重要的临床意义。本研究表明,S-AML患者的Treg细胞比例及Treg/Teff细胞比值明显高于健康对照及P-AML,提示这一类型白血病免疫状态向抑制性偏移,其免疫失衡更为严重。Treg细胞的改变可能是S-AML形成的重要诱因之一,同时,S-AML患者化疗效果不佳及生存期短也极有可能是由Treg细胞的改变造成的。
现今,随着免疫学新技术的快速发展,去除机体某些特定细胞的技术日臻成熟。近期已有学者[12]提出在治疗急性白血病及其它恶性肿瘤过程中,可以将对Treg细胞水平的调控作为一个新的潜在靶点。而S-AML患者免疫状态更为失衡,外周血Treg细胞数量异常升高,降低或去除机体Treg细胞,使机体免疫抑制状态解除,以及通过各种方式提高机体免疫功能,都有可能成为今后延缓S-AML病程,甚至达到治疗目的的手段。而在大剂量化学治疗的同时,找到如何调控机体免疫平衡这一研究亮点可能也为治疗该类白血病提供新的方向。

