盐度对南极冰藻Chlamydomonas sp.ICE-L细胞膜流动性及其脂肪酸脱氢酶基因表达的影响
张 欣,綦晓青,缪锦来,3,郑 洲,3*
(1.青岛大学 基础医学院,山东 青岛266061;2.自然资源部 第一海洋研究所,山东 青岛266061;3.青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室,山东 青岛266061)
南极冰藻Chlamydomonassp.ICE-L是南极冰层微生物生态环境的主体,在南大洋海冰区的初级总产量中,冰藻的直接贡献额达到25%,是南大洋重要的碳流和能量流[1]。南极冰藻的生长与海冰密切相关,海水与海冰季节性交替变化是南极海洋的显著特征,大部分南极海冰在南极短暂的夏天消失,在紧接着的冬天又重新形成[2]。因此,南极冰藻每年夏天会随着海冰融化而从海冰盐囊中释放,在此过程中,南极冰藻经历盐度极度稀释、光照和紫外线突然增强的生境。冬天南极冰藻又随海冰的形成而被嵌入到海冰盐囊中,从而发生盐度升高、温度降低和光照变弱的生境变化[3]。总之,南极冰藻对海冰形成和融化时的生境适应性调节机制是其生活史中最为关键的环节,这种极端骤变环境直接影响南极冰藻的生存和活力。
为了能在海冰盐囊中生存繁衍,南极冰藻形成了适应低温、高盐等生境的复杂的生物学机制。盐胁迫导致植物积累的活性氧和其他毒性物质会破坏膜系统、蛋白质和核酸分子[4],其中细胞膜将细胞与外界环境分隔开,南极冰藻适应海冰环境有赖于细胞膜结构的完整性和膜脂的流动性[5]。膜脂中不饱和脂肪酸是维持细胞膜流动性的关键分子,而脂肪酸脱氢酶是不饱和脂肪酸合成途径关键酶。增加膜脂中脂肪酸的不饱和度,可以降低膜脂熔点,提高细胞膜的流动性[6-7]。因此,微生物极端适应性机制与不饱和脂肪酸关系的研究受到极大关注,目前已从多种微藻中克隆脂肪酸脱氢酶基因,其表达调控成为研究的热点之一[7-10]。
南极冰藻能在极端骤变的海冰环境中生存繁衍,使其成为研究海洋藻类抗逆机制的良好材料[11-15]。本研究探讨了高盐环境对南极冰藻膜流动性及其脂肪酸脱氢酶基因表达的影响,不仅有助于深入了解极端海冰生境中南极冰藻细胞膜及其不饱和脂肪酸的分子调控机理,还为南极冰藻低温脂肪酸脱氢酶的开发利用奠定基础。不饱和脂肪酸已广泛应用于食品、保健品和生物制药等领域,可通过构建南极冰藻低温脂肪酸脱氢酶基因工程菌,实现脂肪酸脱氢酶的规模化制备,促进不饱和脂肪酸产业的发展。
1 材料与方法
1.1 藻种来源与培养
本研究所用的南极冰藻Chlamydomonassp.ICE-L是在2001-2002年第18次南极科学考察时于南极中山站附近的海冰样品中分离得到,现保存于自然资源部海洋生态环境科学与技术重点实验室。
利用1 000 m L三角瓶将藻种接种于灭菌海水配置的Provasoli培养基[16](600 m L/瓶)中,封口膜封口。在光照周期12 L∶12 D、光强1 300~1 900 lx、培养温度(5±1)℃条件下培养,每天摇晃3次使瓶内藻体分布均匀[12]。
1.2 实验方法
1.2.1 不同盐度条件下南极冰藻Chlamydomonassp.ICE-L生长曲线测定
将培养至对数生长期的南极冰藻接种于不同盐度的Provasoli培养基中,接种密度约为5×105m L-1,共150 m L,在250 m L的三角瓶中培养。用NaCl调节培养基的盐度,使其盐度梯度分别为海水盐度(32)的0.5、1、2、3和4倍,即16、32、64、96和128。然后置于低温光照培养箱内,光强为1 300~1 900 lx,光照周期12 L∶12 D,不充气,培养温度(5±1)℃,每日摇瓶3次。分别在培养的第0,2,4,6,8,10,12和14天取样,每样做3个平行,取平均值,以正常海水为对照组,使用紫外可见光分光光度计,测定OD680值。
1.2.2 细胞膜流动性的测定
离心收集不同盐度培养14 d的藻体,用PBS缓冲液洗3次,重悬于50 mmol/L 的PBS缓冲液中,4 ℃下研磨10 min后10 000 g离心20 min,取上清液为细胞膜悬液进行流动性测定。将8-苯胺基-1-萘磺酸(8-Anilino-l-Naphthalene Sulfonic aid,ANS)加入细胞膜悬液中,调整其浓度至2.5×10-5mol/L,在25 ℃温浴30 min后,采用Hitachi F-4500型荧光分光光度计测量ANS荧光强度,具体方法参照文献[17]。
1.2.3 膜脂提取
离心收集不同盐度条件下培养14 d的藻体,并用4 ℃预冷的灭菌水冲洗3次,然后将藻体冷冻干燥,于-80 ℃贮存待用。称取0.2 g干藻体,加入10 m L预冷的匀浆缓冲液。将均匀的悬浮藻液在冰浴中进行超声波破碎,具体方法参考文献[7]。取破碎好的藻物浆液,采用分级离心法制备细胞膜制剂:4 ℃,500 g离心15 min,取上清;4 ℃,2 000 g离心15 min,取上清;4 ℃,50 000 g离心30 min,取上清;4 ℃,80 000 g离心30 min,弃上清,得到的沉淀为细胞质膜制剂。
1.2.4 脂肪酸分析
冰藻质膜的脂肪酸提取和含量分析参照文献[12]。提取的冰藻质膜总脂样品先甲酯化,随后将甲酯化样品冷却,加入3.0 m L饱和NaCl溶液和1.0 m L正己烷,充分振荡后静置,取正己烷层进行气相色谱分析。根据质膜脂肪酸的色谱结果参照标准品和碳链长度值确定脂肪酸种类,对各组分峰面积积分,归一法分析计算各脂肪酸组分质量分数。
1.2.5 不同盐度条件下南极冰藻Chlamydomonassp.ICE-L脂肪酸脱氢酶的胁迫诱导
对不同盐度培养的南极冰藻分别在0,2,6,12,24,48,96(4 d),144(6 d),192(8 d)和288 h(12 d)取样进行荧光定量分析,每个样设3个重复,以正常海水盐度(32)培养的样品作为对照组,研究不同盐度胁迫对脂肪酸脱氢酶基因Δ9Ci FAD,Δ6Ci FAD,Δ12Ci FAD,ω3Ci FAD1和ω3Ci FAD2表达的影响。先按照TransZol说明书步骤提取南极冰藻RNA,检测RNA 的完整性、浓度和纯度符合要求后,再利用PrimescriptTMRT reagent Kit with gDNA Eraser(Ta KaRa)试剂盒将RNA 反转录成cDNA,反转录好的样品于-20℃保存备用。采用实时荧光定量PCR 检测不同盐度下南极冰藻脂肪酸脱氢酶的表达,相关基因的定量引物和实时荧光定量PCR 反应体系同参考文献[7]和[12],引物由英潍捷基(上海)贸易有限公司合成。
2 结 果
2.1 不同盐度下南极冰藻Chlamydomonas sp.ICE-L的生长曲线
南极冰藻在不同盐度条件下的生长情况(图1)显示,其在盐度16,32,64,96和128 条件下均能够生长。在正常海水盐度32中,南极冰藻生长最快,在第12天达到平台期;在盐度16条件下,细胞的生长趋势与正常海水条件基本相同;在盐度64和96条件下,南极冰藻生长较慢,在第8天到达平台期;在盐度128条件下,细胞的生长受到抑制。与正常海水处理相比,随着盐度的增加,南极冰藻的生长速率逐渐降低。
2.2 不同盐度条件下南极冰藻Chlamydomonas sp.ICE-L的流动性
不同盐度条件下南极冰藻细胞膜ANS相对荧光强度见图2,荧光光度值波动范围为398~528。与正常海水盐度32相比,随着盐度升高,荧光光度值呈下降趋势,在盐度128条件下,荧光光度值始终保持最低,且变化最小;在低盐度16 条件下,荧光光度值与正常海水条件下相比有所降低。在不同盐度条件,在培养2 h和6 h时荧光光度值较培养144 h时低。
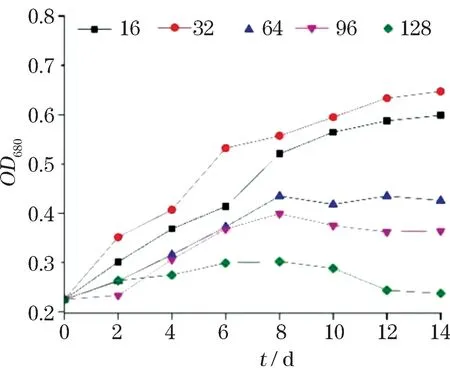
图1 不同盐度条件下南极冰藻生长曲线Fig.1 Growth curve of Antarctic ice algae under different salinity conditions

图2 不同盐度条件下南极冰藻细胞膜ANS相对荧光强度Fig.2 ANS relative fluorescence intensity of the cell membrane of Antarctic ice algae membrane under different salinity condition
2.3 南极冰藻Chlamydomonas sp.ICE-L细胞膜总脂肪酸质量分数
不同盐度条件下南极冰藻细胞膜总脂肪酸质量分数实验结果(图3)显示,在正常海水盐度(32)条件下细胞膜总脂肪酸的质量分数最低,脂肪酸质量分数为8.6%;在盐度16培养条件下,脂肪酸质量分数达到最大值14.3%,为正常条件的1.7倍;在盐度64,96和128培养条件下,随着盐度的升高,脂肪酸质量分数逐渐升高,其中在盐度128条件下,脂肪酸质量分数达到13.5%,为正常条件下的1.6 倍。
2.4 不同盐度条件下南极冰藻Chlamydomonas sp.ICE-L细胞膜脂肪酸组成变化
南极冰藻细胞膜由10多种脂肪酸组成,主要为多不饱和脂肪酸(Polyunsaturaled Fatty Acid,PUFA),其质量分数能达到57.1%~62.9%,其中C18∶3,C20∶3和C20∶5是3种最主要的PUFA;单不饱和脂肪酸(Monounsaturated Fatty Acids,MUFA)的质量分数为22.4%~29.5%,主要为C18∶1和C18∶1(cis9);饱和脂肪酸(Saturated Fatty Acid,SFA)质量分数最少,为11.1%~16.5%左右,主要包括其中C18∶0和C20∶30,还有少量的C12∶0 和C14∶0等短链脂肪酸。由不同盐度条件下的南极冰藻细胞膜脂肪酸组成变化(图4)可知,在高于或低于正常海水盐度的条件下,膜脂中总多不饱和脂肪酸(Tatal Polyunsaturated Fatty Acids,TPUFA)质量分数均有所增加;在高盐度(128)和低盐度(16)条件下,TPUFA 质量分数分别为62.5%和62.85%;随着盐度的升高,膜脂中总单不饱和脂肪酸(Total Monounsaturated Fatty Acids,TMUFA)的质量分数先升高后下降,在盐度64条件下,TMUFA 质量分数达到最大值(29.51%);在正常海水盐度条件下,膜脂中总饱和脂肪酸(Total Saturated Fatty Acids,TSFA)质量分数最高(16.52%),其他盐度条件下,TSFA 质量分数均有所下降。
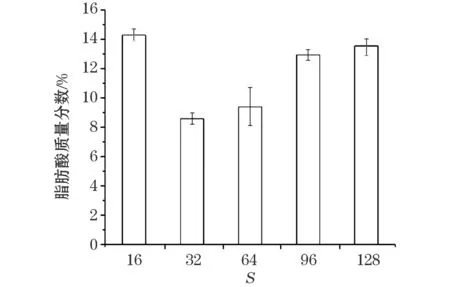
图3 不同盐度下南极冰藻细胞膜总脂肪酸质量分数Fig.3 Total lipid content of Antarctic ice algae membrane under different salinity condition

图4 不同盐度条件下南极冰藻细胞膜脂肪酸组成变化Fig.4 Fatty acid compositions of Antarctic ice algae membrane under different salinity condition
2.5 不同盐度对脂肪酸脱氢酶基因表达的影响
在高盐度条件下,Δ9Ci FAD的表达量在前12 h内持续增加,其中在盐度96和128条件下培养12 h后,其表达量最大,分别为对照组的4.6和5.5倍,随后Δ9Ci FAD的表达量有所降低,但其表达水平仍高于正常条件的表达水平(图5)。在高盐度条件下培养144(6 d)~192 h(12 d),Δ6Ci FAD的表达量随盐度(64和96)的升高有所升高,盐度继续升高至128时其表达量有所下降,随后Δ6Ci FAD的表达呈现先下降后上升的趋势(图6)。在高盐度条件下培养6 h 内,Δ12Ci FAD表达量有所上调,其后其表达变化趋势与Δ6Ci FAD相似;不同的盐度条件下Δ12Ci FAD表达量最大的时间有所不同,在盐度128条件下培养的第8天时达到峰值,为对照组的6.5倍;在盐度64和96条件下培养的第12天时达到峰值,分别为对照的6.7倍和6.9倍;在低盐度条件下,Δ12Ci FAD的表达量总体呈现增长的趋势,在盐度16条件下培养的第8天时达到最高值,为对照组的9.6 倍(图7)。ω3Ci FAD1 在高盐条件下表达上调,在盐度96 和128 培养2 h,ω3Ci FAD1的表达量迅速增加到4.2倍和3.5倍,之后培养至第12天表达量稍有下降水平,但仍保持在较高表达水平(图8)。在高盐条件下,ω3CiFAD2的表达量变化趋势与ω3CiFAD1相似,而在低盐条件下,ω3CiFAD2的表达更为活跃,表达量上调,在第4天时达到峰值,为对照组的4.8倍(图9)。
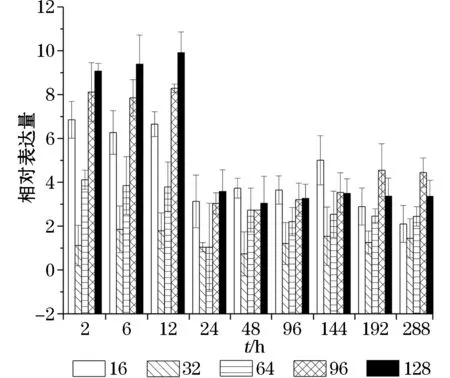
图5 不同盐度下南极冰藻脂肪酸脱氢酶基因Δ9CiFAD 的表达变化Fig.5 Expressions of fatty acid desaturases geneΔ9Ci FAD of Antarctic ice algae under different salinity conditions

图6 不同盐度下南极冰藻脂肪酸脱氢酶基因Δ6CiFAD 的表达变化Fig.6 Expressions of fatty acid desaturases geneΔ6Ci FAD of Antarctic ice algae under different salinity condions

图7 不同盐度下南极冰藻脂肪酸脱氢酶基因Δ12CiFAD 的表达变化Fig.7 Expressions of fatty acid desaturases geneΔ12Ci FAD of Antarctic ice algae under different salinity conditions
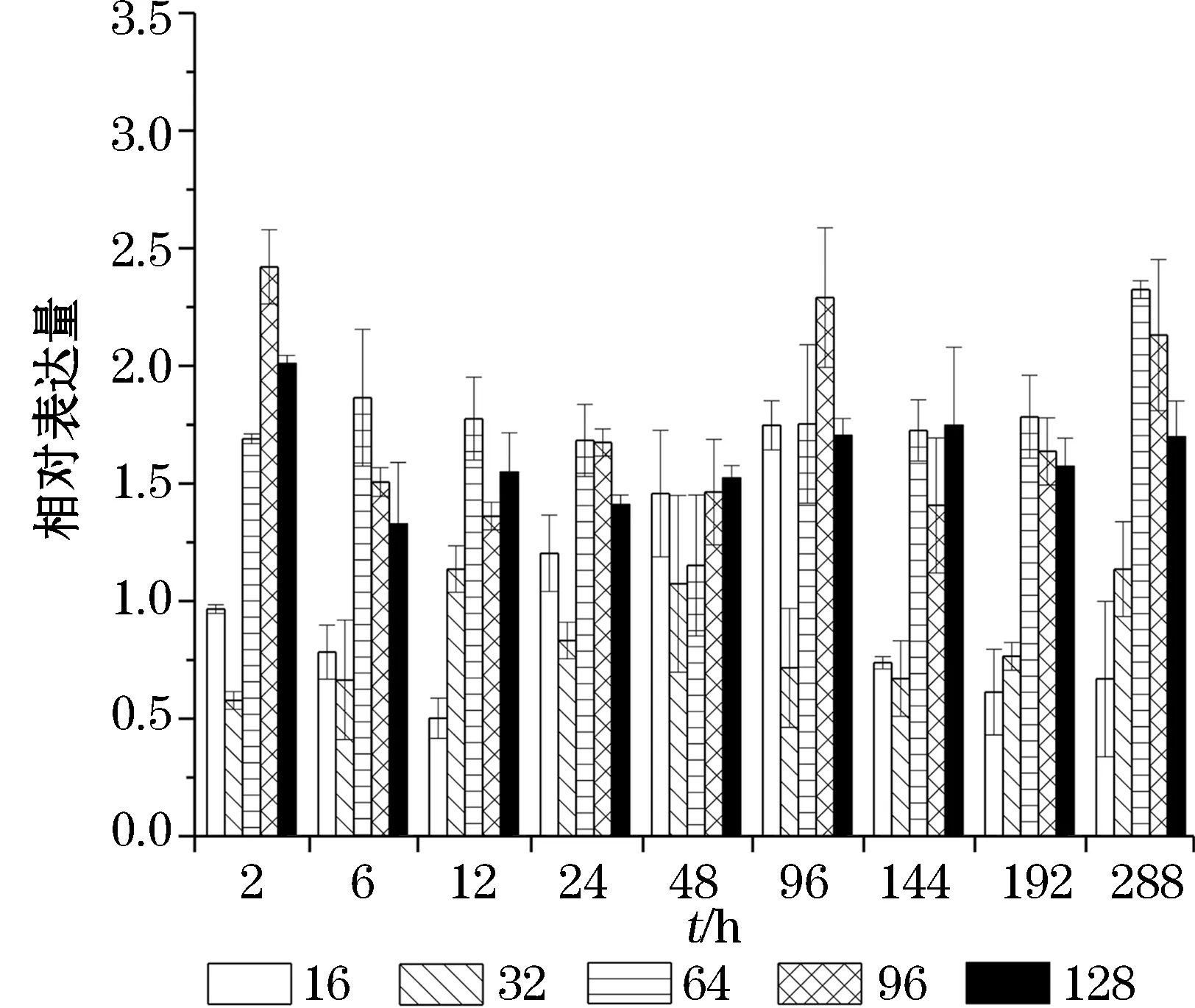
图8 不同盐度下南极冰藻脂肪酸脱氢酶基因ω3CiFAD 1的表达变化Fig.8 Expressions of fatty acid desaturases geneω3Ci FAD 1 of Antarctic ice algae under different salinity conditions

图9 不同盐度下南极冰藻脂肪酸脱氢酶基因ω3CiFAD 2的表达变化Fig.9 Expressions of fatty acid desaturases geneω3Ci FAD 2 of Antarctic ice algae under different salinity conditions
3 讨 论
南极冰藻能够在高盐度的海冰盐囊中旺盛生长,盐度是影响其生存的关键因素之一:在盐度32时,最适宜南极冰藻Chlamy domonassp.ICE-L生长;在高盐度128时,南极冰藻的生长受到抑制,在其他盐度下均能生长和存活;在低盐度16时南极冰藻生长状况良好,与正常海水盐度下的南极冰藻生长状况相近。南极冰藻对盐度的耐受力远高于普通海洋微藻,这可能与其适应南极极端骤变海冰环境有关。南极气候异常寒冷,海冰的理化性质季节性变化和昼夜变化剧烈,在海冰溶解过程中,盐度极度稀释,而在海水成冰时,盐分被排斥在冰晶外形成盐囊和盐通道,导致盐度急剧升高,海水盐度一般为34~35,海冰中的盐囊和盐通道可达到普通海水的5倍[3]。在长期进化过程中,南极冰藻形成了适应极端海冰生境的特殊生理生化机制,从而能在海冰盐囊中生存繁衍[19]。
膜结构是一个动态的平衡体系,其成分可随外界环境变化进行适应性调整。与正常海水盐度32相比,在高盐度条件下,随着盐度的升高,南极冰藻细胞膜荧光光度值呈下降的趋势,说明细胞膜流动性随盐度的升高而增强,这与康亦兼等[20]与程书梅等[21]对高盐条件下酵母细胞膜的流动性研究结果一致;在低盐度16条件下,南极冰藻细胞膜荧光光度值比正常海水条件下的荧光值降低,表明其细胞膜流动性有所增加,可能与其适应海冰融化时的低盐环境有关。在不同盐度条件下,南极冰藻细胞膜荧光光度值波动范围较小,说明其膜流动性比较稳定,能够适应南极海水成冰和海冰融化时海水盐度的剧烈变化,维持南极冰藻的生理活性。
脂肪酸是南极冰藻及其细胞膜的主要成分,其含量组成与海冰盐度变化密切相关。在低盐和高盐环境中,南极冰藻细胞膜中多不饱和脂肪酸含量增加,提高了膜脂的不饱和度,这与南极冰藻可在低盐和高盐环境下维持其质膜流动性相一致。南极冰藻细胞膜的脂肪酸组成较多,主要以多不饱和脂肪酸(PUFA)为主,这对细胞在低温和高盐条件下维持细胞膜的流动性发挥着重要作用。在高盐度条件下南极冰藻细胞膜多不饱和脂肪酸的含量升高,能够降低南极冰藻细胞膜的相变温度,使其在海冰环境下维持细胞膜流动性,保护细胞隔间及胞器不受损伤,从而维持南极冰藻的生理功能[6-7]。
南极冰藻脂肪酸脱氢酶基因的表达调控模式与海冰盐度环境有关[22]。Δ9脂肪酸脱氢酶催化棕榈酰Co A(C16∶0)和硬脂酰Co A(C18∶0)的第9、10位碳原子之间脱氢形成一个双键,合成棕榈油酸(C16∶1)与油酸(C18∶1),是不饱和脂肪酸合成的限速酶[12];在高盐和低盐环境中,Δ9Ci FAD基因的表达量快速升高,且变化趋势与细胞膜流动性的变化趋势是一致的,表明其可快速响应外界的盐度压力,调节南极冰藻细胞膜的流动性。Δ12脂肪酸脱氢酶是在油酸(C18∶1)的Δ12位脱氢引入双键形成亚油酸(C18∶2);Δ6脂肪酸脱氢酶是以C18∶2 为底物,合成C18∶3n-6 的限速酶[12];在长时间的高盐处理后,Δ12Ci FAD和Δ6Ci FAD表达量升高,它们可能在南极冰藻应对盐度压力后期发挥重要作用;ω3脂肪酸脱氢酶是酰基-脂脱氢酶的一种,以C18∶2作为底物,在C15位脱氢形成C18∶3n-3[12];在高盐压力环境中ω3Ci FAD1表达量高,可以保护南极冰藻细胞免受高盐伤害,而在低盐环境下ω3Ci FAD2表达量高,有利于南极冰藻适应海冰融化时的低盐环境。
4 结 语
南极冰藻Chlamydomonassp.ICE-L能够在高盐环境中维持细胞膜流动性有助于其适应极端海冰环境。南极冰藻细胞膜流动性在高盐环境中波动范围不大,细胞膜保持了动态的稳定以维持细胞正常的生理功能。在高盐环境中,南极冰藻通过增加细胞膜脂肪酸的不饱和度来增加细胞膜的流动性,从而增强对极端环境的适应性。在高盐条件下,南极冰藻Δ9Ci FAD基因的表达量在短时间内迅速升高,Δ12Ci FAD和Δ6Ci FAD对环境变化的时间稍微滞后,ω3Ci FAD1在高盐环境表达量升高,而ω3Ci FAD2在低盐环境中表达量升高,不同盐度条件下南极冰藻脂肪酸脱氢酶的表达变化与其细胞膜脂肪酸组成的变化趋势基本一致。由此可知,在高盐环境胁迫下南极冰藻通过提高脂肪酸脱氢酶基因的表达量来增加脂肪酸脱氢酶的合成,以增加不饱和脂肪酸的质量分数,降低膜脂的熔点,从而提高细胞膜的流动性。这不仅有助于揭示极端海冰环境中南极冰藻细胞膜流动性及其不饱和脂肪酸质量分数变化的协同调控机制,还为南极冰藻脂肪酸脱氢酶的开发利用奠定基础,对油料植物基因工程和抗冻耐盐作物选育等具有重要的理论意义和应用价值。
参考文献(References):
[1] ARRIGO K R,THOMAS D N.Large scale importance of sea ice biology in the Southern Ocean[J].Antarctic Science,2004,16(4):471-486.
[2] SPINDLER M.Notes on the biology of sea ice in the Arctic and Antarctic[J].Polar Biology,1994,14(5):319-324.
[3] THOMAS D DIECKMANN G S.Antarctic sea ice-a habitat for extremophiles[J].Science(New York,N.Y.),2002,295(5555):641-644.
[4] HASEGAWA P M,BRESSAN R A,ZHU J K,et al.Plant cellular and molecular responses to high salinity[J].Annual Review of Plant Physiology and Plant Molecular Biology,2000(51):463-499
[5] MOU S,XU D,YE N,et al.Rapid estimation of lipid content in an Antarctic ice alga(Chlamydomonassp.)using the lipophilic fluorescent dye BODIPY505/515[J].Journal of Applied Phycology,2012,24(5):1169-1176.
[6] MOCK T,KROON B M.Photosynthetic energy conversion under extreme conditions-I:important role of lipids as structural modulators and energy sink underN-limited growth in Antarctic sea ice diatoms[J].Phytochemistry,2002,61(1):41-51.
[7] QI X Q.Research on the molecular mechanism of fatty acid desaturases genes and membrane fluidity inChlamydomonassp.ICE-L[D].Qingdao:First Institute of Oceanography,MNR,2016.綦晓青.南极冰藻Chlamydomonassp.ICE-L脂肪酸脱氢酶基因及其细胞膜流动性调控分子机制研究[D].青岛:自然资源部第一海洋研究所,2016.
[8] MATSUDA T,SAKAGUCHI K,KOBAYASHI T,et al.Molecular cloning of aPinguiochrysis pyriformisoleate-specific microsomal Δ12-fatty acid desaturase and functional analysis in yeasts and thraustochytrids[J].Journal of Biochemistry,2011,150(4):375-383.
[9] PAL D,KHOZIN-GOLDBERG I,COHEN Z,et al.The effect of light,salinity,and nitrogen availability on lipid production byNannochloropsissp.[J].Applied Microbiology and Biotechnology,2011,90(4):1429-1441.
[10] DE JAEGER L,SPRINGER J,WOLBERT E J H,et al.Gene silencing of stearoyl-ACP desaturase enhances the stearic acid content inChlamydomonas reinhardtii[J].Bioresource Technology,2017,245:1616-1626.
[11] LIU C L,HUANG X H,WANG X L,et al.Phylogenetic studies on two strains of Antarctic ice algae based on morphological and molecular characteristics[J].Phycologia,2006,45(2):190-198.
[12] AN M L.Study on fatty acid desaturases and fatty acids profile inChlamydomonassp.ICE-L[D].Qingdao:The First Institute of Oceanography,SOA,2014.安美玲.不同生境下南极冰藻Chlamydomonassp.ICE-L 不饱和脂肪酸的研究及脂肪酸去饱和酶的功能验证[D].青岛:国家海洋局第一海洋研究所,2014.
[13] MI Y Y,WANG Y,HUANG X H,et al.Characteristics and Expression CiDDX5 Gene From the Antarctic Ice Analysis of a RNA Helicase AlgaChlamydomonassp.ICE-L[J].Advances in Marine Science,2013,31(4):566-573.宓妍妍,王燕,黄晓航,等.南极冰藻Chlamydomonassp.ICE-LRNA 解旋酶CiDDX5的基因特征及其表达分析[J].海洋科学进展,2013,31(4):566-573.
[14] WANG N F,SHEN J H,JIN Z P,et al.Construction and Quality Detection of cDNA Library From Antarctic Ice AlgaChlamydomonassp.ICE-L[J].Advances in Marine Science,2006,24(4):520-525.王能飞,沈继红,金治平,等.南极冰藻Chlamydomonassp.ICE-L的cDNA 文库构建及品质检测[J].海洋科学进展,2006,24(4):520-525.
[15] LIN M Z,LIU C L,HUANG X H,et al.Bioinformatic Analysis of the Nitrate Reductase Gene in Antarctic Ice AlgaeChlamydomonassp.ICE-L[J].Advances in Marine Science,2012,30(4):527-533.林敏卓,刘晨临,黄晓航,等.南极衣藻Chlamydomonassp.ICE-L硝酸还原酶基因的生物信息学分析[J].海洋科学进展,2012,30(4):527-533.
[16] PROVASOLI L.Nutrition and ecology of protozoa and algae[J].Annual Review of Microbiology,1958(12):279-308.
[17] DU Q P,JIA X S,LI S Y,etal.Effects of sulfur dioxide on the membrane fluidity and enzymatic activity of alveolar macrophages in rats[J].Chinese Environmental Science,2007,27(3):391-394.杜青平,贾晓珊,李适宇,等.SO2对大鼠肺泡巨噬细胞膜脂流动性及酶活性的影响[J].中国环境科学,2007,27(3):391-394.
[18] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method[J].Methods,2001,25(4):402-408.
[19] LIGOWSKI R,JORDAN R W,ASSMY P.Morphological adaptation of a planktonic diatom to growth in Antarctic sea ice[J].Marine Biology(Berlin),2012,159(4):817-827.
[20] KANG Y J,XIAN M,WANG J X,et al.Effects of mycelial bio-membrane fluidity on the activity of desaturases[J].Journal of Molecular Catalysis,2002,16(1):1-4.康亦兼,咸漠,王君霞,等.菌丝体的膜流动性对去饱和酶活性的影响[J].分子催化,2002,16(1):1-4.
[21] CHENG S M,CHEN B J,GU J L,et al.Fluorescence polarization techniques for the determination of complete cell membrane fluidity ofSaccharomyces cerevisiae[J].Journal of Agricultural University of Hebei,2005,28(6):95-97.程书梅,陈宝江,顾金兰,等.应用荧光偏振法测定酿酒酵母完整细胞膜的流动性[J].河北农业大学学报,2005,28(6):95-97.
[22] AN M,MOU S,ZHANG X,et al.Expression of fatty acid desaturase genes and fatty acid accumulation inChlamydomonassp.ICE-L under saltstress[J].Bioresource Technology,2013,149(4):77-83.

