子芩与枯芩超高效液相色谱指纹图谱及模式识别研究
宋亚芳,夏伯候,杨红,龚慕辛
子芩与枯芩超高效液相色谱指纹图谱及模式识别研究
宋亚芳1,夏伯候2,杨红1,龚慕辛1
1.首都医科大学,北京 100069;2.湖南中医药大学,湖南 长沙 410208
建立子芩与枯芩的超高效液相色谱(UPLC)指纹图谱,为黄芩药材的鉴别和质量控制提供依据。采用UPLC对22批不同产地的子芩、枯芩进行测定,建立其特异性指纹图谱;运用主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA)对其进行模式识别研究,分类并筛选其主要差异性成分,并通过对照品比对进行鉴定。建立的子芩和枯芩UPLC指纹图谱稳定可靠,可用于评价两者的差异性;得到15个共有峰,各产地样品指纹图谱相似度较高。PCA不能完全区分子芩与枯芩,OPLS-DA能对子芩与枯芩进行明确区分,导致差异的主要成分有3个,经鉴定分别为黄芩新素Ⅱ、千层纸素A和黄芩素,且三者在子芩与枯芩中含量变化显著。本研究建立的指纹图谱和模式识别方法相结合能够区分子芩与枯芩,可作为黄芩质量控制和评价的有效手段之一。
黄芩;超高效液相色谱法;指纹图谱;主成分分析;正交偏最小二乘-判别分析
黄芩为唇形科植物黄芩Georgi的干燥根,具有清热燥湿、泻火解毒、止血、安胎功效[1]。《药品化义》提到“一品宜分两用,盖枯芩体轻主浮,专清肺胃上焦之火,而条芩体重主降,专泻大肠下焦之火”。2年采收者,根坚实,称为“子芩”;3年以上采收者,老根中空,称为“枯芩”。两者成分含量及药效均有一定差异[2-4]。传统用药经验是将二者区别使用,但目前临床除少数医生特殊要求外,无论治疗上焦肺热证还是腹泻等下焦病证均直接使用黄芩饮片,不再对黄芩进行子芩和枯芩的区别使用,药材市场、药店及医院也无枯芩、子芩区别销售。由于子芩生长时间短,且能满足《中华人民共和国药典》的质量要求,可在相对降低生产成本的基础上增加药农收入,故市场销售以子芩居多。
指纹图谱具有专属性、唯一性、整体性等特点,适合对中药进行整体的质量控制。中药作为一个多组分体系,必须从整体上评价其质量体系。模式识别方法是一种切合中药指纹图谱分析的技术,可有效解决中药质量多维信息的综合分析问题。本研究收集22批不同产地的子芩和枯芩药材,建立黄芩药材的超高效液相色谱(UPLC)指纹图谱;通过主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA)方法分析子芩与枯芩UPLC指纹图谱的差异性,筛选导致样品间差异的化学成分并进行鉴定,为黄芩药材的质量标准和含量测定指标选择提供依据,以期更好地指导临床用药。
1 仪器与试药
Nexera UHPLC LC-30(SPD-M3OA光电二极管阵列紫外可见检测器),岛津公司;SK2200LHC型超声波清洗器,上海科导超声仪器有限公司;Secura225D-1CN分析电子天平(十万分之一),赛多利斯科学仪器(北京)有限公司;HY-04型高速粉碎机,北京环亚天元机械技术有限公司。
对照品黄芩新素Ⅱ(批号55084-08-7)、野黄芩苷(批号27740-01-8)、千层纸素A-7(批号36948- 76-2)、黄芩素(批号491-67-8)、黄芩苷(批号21967- 41-9)、汉黄芩素(批号632-85-9)、木蝴蝶苷-A(批号57396-78-8)、汉黄芩苷(批号51059-44-0)、千层纸素A(批号480-11-5),成都瑞芬思生物科技有限公司,纯度均大于98%;乙腈为HPLC级(德国默克),其他试剂为分析纯,水为娃哈哈纯净水。22批子芩、枯芩药材来自甘肃、山西、内蒙古、河北、陕西等主产区(见表1),经全值大药房郑娟中药师鉴定为唇形科植物黄芩Georgi的干燥根。
表1 22批黄芩药材样品来源信息
编号购买地产地样品 编号购买地产地样品 S1河北安国河北子芩 S12河北安国陕西枯芩 S2河北安国陕西子芩 S13河北安国陕西枯芩 S3河北安国甘肃子芩 S14河北安国山西枯芩 S4北京海淀山西子芩 S15河北安国河北枯芩 S5河北安国山西子芩 S16河北安国陕北枯芩 S6江苏苏州甘肃子芩 S17河北安国内蒙古枯芩 S7河北安国甘肃子芩 S18河北安国山西枯芩 S8河北安国甘肃子芩 S19河北安国山西枯芩 S9北京顺义山西子芩 S20河北安国内蒙古枯芩 S10河北安国山西子芩 S21北京顺义甘肃枯芩 S11河北安国山西子芩 S22河北安国山西枯芩
2 方法与结果
2.1 对照品溶液制备
取对照品黄芩新素Ⅱ、野黄芩苷、千层纸素A-7、黄芩素、黄芩苷、汉黄芩素、木蝴蝶苷-A、汉黄芩苷、千层纸素A适量,精密称定,用70%乙醇溶解,分别制成浓度为0.09、0.08、0.03、0.06、0.20、0.08、0.08、0.06、0.03 mg/mL的溶液,摇匀,即得。
2.2 供试品溶液制备
取黄芩样品粉末(过80目筛)约0.2 g,精密称定,置100 mL锥形瓶中,加70%乙醇50 mL,称定质量,超声提取(功率100 W,频率53 kHz)40 min,取出,放至室温,再称定质量,用70%乙醇补足减失的质量[5],摇匀,过0.22 μm微孔滤膜,取续滤液,即得。
2.3 色谱条件
色谱柱:InertsilTMODS-3(2.1 mm×100 mm,2 μm);流速:0.3 mL/min;检测波长:280 nm;进样量:5 μL;流动相:乙腈(A)-0.2%冰醋酸水(B),梯度洗脱(0~8 min,20%A;8~15 min,26%A;15~25 min,26%~60%A;25~35 min,60%~100%A;35~40 min,100%A)。
2.4 方法学考察
2.4.1 精密度试验
取枯芩样品(S21),按“2.2”项下方法制备供试品溶液,连续进样6次,计算野黄芩苷、木蝴蝶苷-A、黄芩苷、千层纸素A-7、汉黄芩苷、黄芩素、汉黄芩素、黄芩新素Ⅱ、千层纸素A的峰面积RSD分别为1.76%、1.04%、0.49%、0.45%、0.22%、0.19%、0.44%、0.89%、0.57%,表明仪器精密度良好。
2.4.2 稳定性试验
取枯芩样品(S21),按“2.2”项下方法制备供试品溶液,在室温下分别放置0、4、8、12、24 h,进样分析,计算野黄芩苷、木蝴蝶苷-A、黄芩苷、千层纸素A-7、汉黄芩苷、黄芩素、汉黄芩素、黄芩新素Ⅱ、千层纸素A的峰面积RSD分别为1.50%、0.16%、0.72%、0.63%、0.28%、0.27%、0.58%、1.91%、0.42%,表明样品在24 h内稳定。
2.4.3 重复性试验
取枯芩样品(S21),按“2.2”项下方法平行制备6份供试品溶液,计算野黄芩苷、木蝴蝶苷-A、黄芩苷、千层纸素A-7、汉黄芩苷、黄芩素、汉黄芩素、黄芩新素Ⅱ、千层纸素A的峰面积RSD分别为1.92%、0.24%、0.81%、1.05%、0.82%、0.67%、0.44%、1.94%、0.61%,表明该方法重复性良好。
2.5 数据分析方法
利用国家药典委员会《中药色谱指纹图谱相似度评价系统》(2008版V1.1)对22批供试品溶液色谱图各色谱峰的保留时间和峰面积等数据进行归一化处理,并进行对数变换。所得数据均导入SIMCA-P+15软件,利用化学计量学方法PCA和OPLS-DA对数据进行分析。
2.6 指纹图谱分析
2.6.1 共有峰确定与指认
为进一步确认化合物的结构信息,利用国家药典委员会《中药色谱指纹图谱相似度评价系统》(2008版V1.1)得出19个共有峰,经与对照品比对,确定峰4(保留时间4.942)为野黄芩苷,峰5(保留时间9.391)为木蝴蝶苷-A,峰6(保留时间10.044)为黄芩苷,峰10(保留时间14.681)为千层纸素A-7,峰11(保留时间17.313)为汉黄芩苷,峰12(保留时间20.944)为黄芩素,峰13(保留时间24.244)为汉黄芩素,峰14(保留时间24.699)为黄芩新素Ⅱ,峰15(保留时间24.852)为千层纸素A。见图1。

图1 22批黄芩药材UPLC指纹图谱
2.6.2 相似度评价
对22批黄芩药材样品进行指纹图谱测定,采用国家药典委员会《中药色谱指纹图谱相似度评价系统》(2008版V1.1)计算相似度,结果22批样品指纹图谱的相似度均大于0.9,见表2。相似度评价结果表明,从共有峰相似度角度来看,子芩与枯芩的化学成分总体差异不显著,这些差异可能来源于某一类成分或同一成分含量的微小变化。因此,本研究进一步采用化学模式识别方法对子芩和枯芩的化学成分差异进行分析。
表2 22批黄芩样品UPLC指纹图谱相似度评价结果
编号相似度 编号相似度 编号相似度 S10.965 S90.997 S170.996 S20.995 S100.998 S181.000 S30.998 S110.992 S190.998 S40.998 S120.998 S200.997 S50.999 S131.000 S210.999 S60.999 S141.000 S220.998 S70.987 S150.994 S80.942 S160.999
2.6.3 基于主成分分析的差异模型建立
PCA作为无监督的多元统计方法,在不指定样本类型的情况下提供了多元信息的无偏和最小损失方法,因此可以代表最原始的样品分类或差异性信息[6]。从不同产地子芩和枯芩UPLC指纹图谱PCA结果可得,前3个主成分分析的累积方差贡献率分别达到41.87%、77.99%、85.82%,表明前3个主成分可以解释分类信息的85.82%。样品得分图见图3。可以看出,不同产地子芩与枯芩分别均匀分布在得分图的两侧,具有显著分类趋势。表明基于PCA方法,子芩与枯芩在化学成分上具有显著差异。
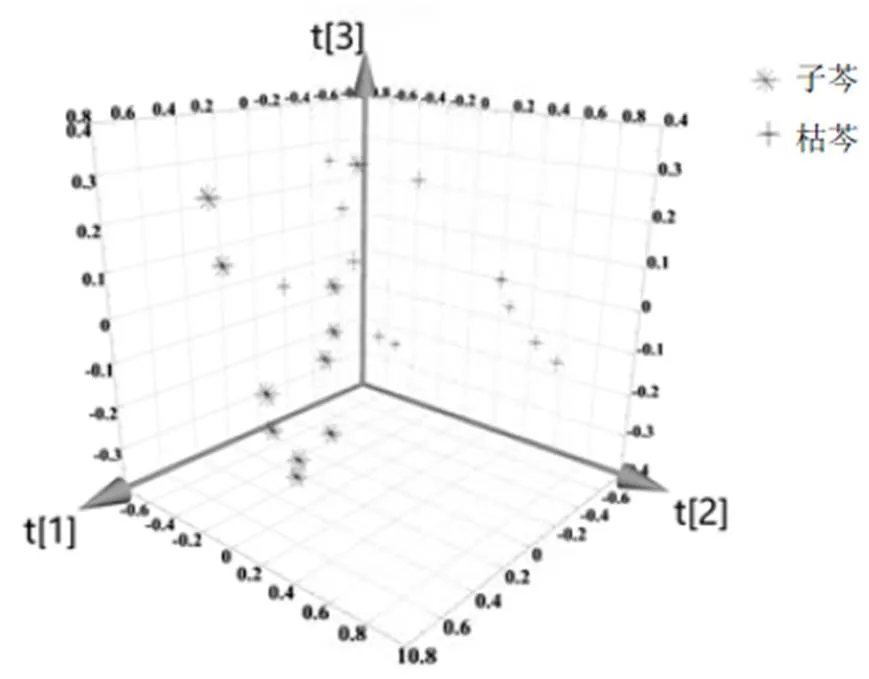
图2 子芩和枯芩PCA得分三维投影图
2.6.4 基于偏最小二乘-判别分析模型建立内在差异模式和标志物筛选
OPLS-DA作为一种有监督的多元统计方法,在成分正交化的基础上,最大化获取分类样品信息,是目前用于组间差异标志物筛选的主要方法之一[7]。为最大程度获取子芩与枯芩的内在质量差异标志物,首先建立两者的OPLS-DA模型,模型得分图见图3A,子芩与枯芩较对称地分布在中线两侧,表明建立的模型能够有效分类两者的化学信息。该模型R2X、R2Y和Q2分别为0.881、0945和0.775,均大于0.5且接近1,表明模型拟合较好,所选择的化学信息变量可以解释94.5%的子芩与枯芩分类差异来源。为防止该模型发生过拟合造成假阳性结果,本研究通过100次交互验证来验证模型。从图3B可知,该模型的交互验证模型R2Y和Q2分别为0.957、0.831,均接近1。且所有R2Y的数据点均高于Q2,表明模型不存在过拟合现象,可用于标志物的筛选。进一步采用S-plot和VIP共同筛选差异标志物(见图3C、图3D),筛选条件为(corr)>0.5且VIP>1,共得到3个符合条件的色谱峰,其保留时间分别为24.609、24.852、20.944 min。
2.6.5 标志物鉴定及分析
通过与对照品进行比对,保留时间为24.609、24.852、20.944 min的化合物分别为黄芩新素Ⅱ、千层纸素A和黄芩素(见图4A)。经热点图(图4B)比对,发现这3种化合物在子芩和枯芩中含量差异较大,显示出不同趋势,标志物总含量比较见图4C。可以看出,黄芩素在子芩中的含量显著高于枯芩,而枯芩中黄芩新素Ⅱ和千层纸素A含量相对较高。

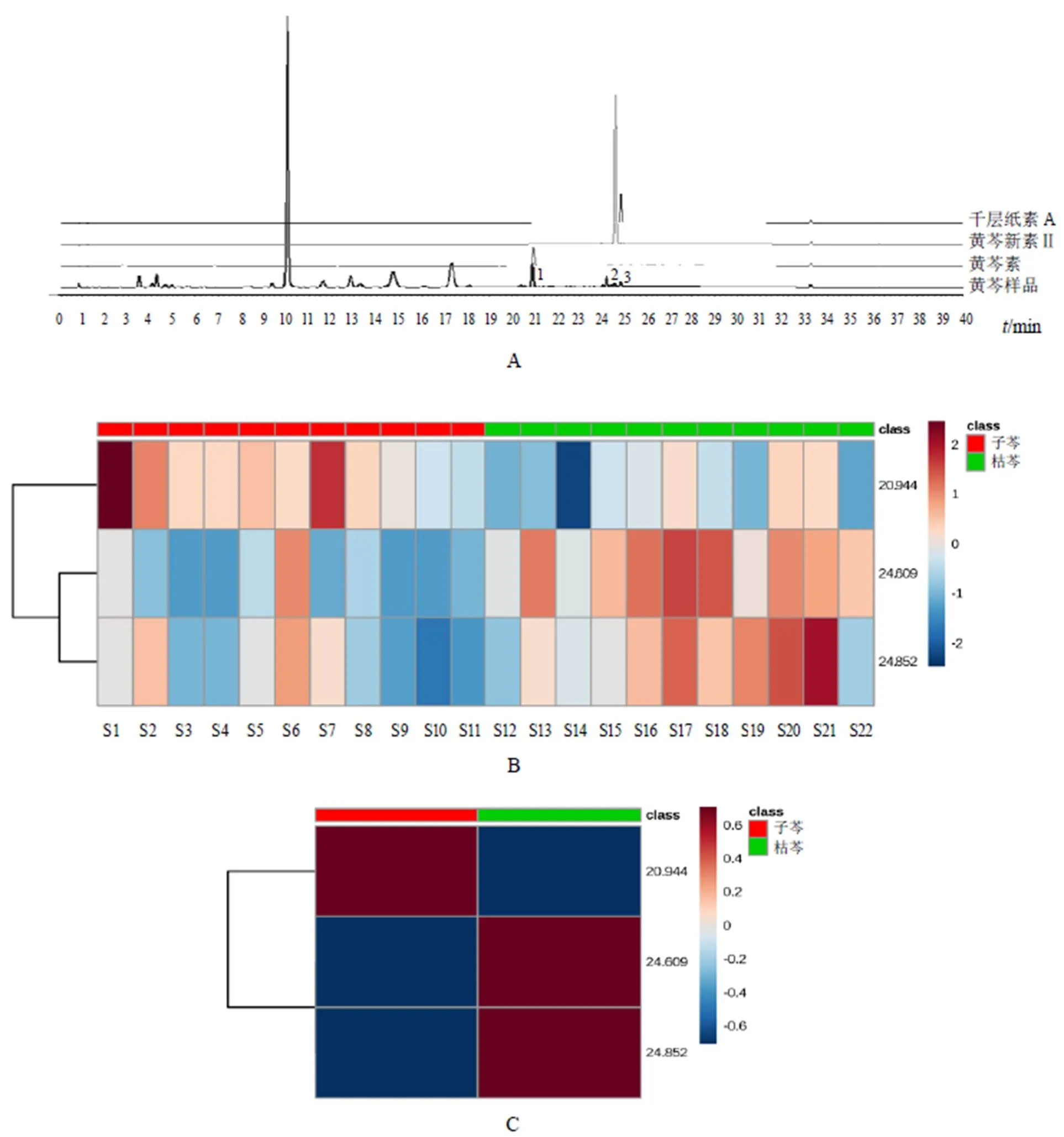
注:A.标志物鉴定;B.热点图;C.标志物总含量;1.黄芩新素Ⅱ;2.千层纸素A;3.黄芩素
3 讨论
本试验建立了测定子芩和枯芩UPLC指纹图谱方法,得到共有峰19个,并对其中9个进行了指认。同时,采用化学计量学方法建立了子芩与枯芩的分类模型。结果显示,子芩和枯芩可明显分为两类,表明二者成分含量存在一定差异,并筛选出3个差异标志物,通过对照品比对鉴别出黄芩新素Ⅱ(24.609 min)、千层纸素A(24.852 min)及黄芩素(20.944 min),且3个成分在子芩与枯芩中的含量存在显著差异。由此可见,传统用药将子芩和枯芩分开使用有一定道理,尚需进一步研究。
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:301-302.
[2] 刘萍,周文斌.RP-HPLC法考察枯芩与子芩不同部位中黄芩苷含量和不同炮制方法的影响[J].中国药物应用与监测,2007,3(2):23-25.
[3] 周小江,郭纯,杨华,等.子芩与枯芩可溶性蛋白质SDS-PAGE电泳分析[J].湖南中医药大学学报,2007,27(2):52-53.
[4] 赵佳文,李水清,刘艳菊,等.基于抗菌活性及病理指标评价子芩与枯芩对肺炎的药效学差异[J].中草药,2018,49(17):4064-4070.
[5] 赵佳文,瞿领航,刘艳菊,等.多成分含量测定结合UPLC指纹图谱及其模式判别评价子芩与枯芩质量[J].中药材,2017,40(9):2101-2106.
[6] 严宝飞,朱邵晴,宿树兰,等.不同产地黄芩茎叶UPLC指纹图谱与化学模式识别研究[J].南京中医药大学学报,2017,33(6):633-638.
[7] FONVILLE J M, RICHARDS S E, BARTON R H, et al. The evolution of partial least squares models and related chemometric approaches in metabonomics and metabolic phenotyping[J]. Journal of Chemometrics,2010,24(11/12):636-649.
UPLC Fingerprint Study and Pattern Recognition Analysis ofPith-nodecayed andPith-decayed
SONG Yafang1, XIA Bohou2, YANG Hong1, GONG Muxin1
To establish the UPLC fingerprints ofpith-nodecayed andpith-decayed; To provide basis for identification and quality control of Scutellariae Radix.Totally 22 batches ofpith-nodecayed andpith-decayed from different habitats were analyzed using UPLC for detection, and their specific fingerprints were established; principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA) were used to conduct pattern recognition research on them, and their main difference components were classified and screened. Differential components were identified by standard control method.The established UPLC fingerprints ofpith-nodecayed andpith-decayed were stable and reliable, which could evaluate their difference. 15 common peaks were obtained, and the fingerprints of samples from each habitat were highly similar. PCA cannot completely distinguishpith-nodecayed andpith-decayed, and OPLS-DA could completely distinguishpith-nodecayed andpith-decayed. There were 3 main components that caused the difference. They were identified as baicalin Ⅱ, laminar A and baicalein, and the contents of the three inpith-nodecayed andpith-decayed changed significantly.The combination of fingerprints and pattern recognition methods established in this study can distinguishpith-nodecayed andpith-decayed, which can be used as one of the effective means for quality control and evaluation of Scutellariae Radix.
Scutellariae Radix; UPLC; fingerprints; PCA; OPLS-DA

R284.1
A
1005-5304(2020)09-0092-05
10.3969/j.issn.1005-5304.202001014
国家重点研发计划(2017YFC1701900);首都医科大学燕京医学院科研启动基金(19qdky8)
杨红,E-mail:yh_7108@126.com
(2020-01-02)
(2020-02-08;编辑:陈静)

