添加不同蓝藻饲料对草金鱼生长、体色和MCs含量的影响
李宛津 戴伟 卢正义 毕相东 董少杰 卫鹏 唐皇
摘 要:为探讨饲料中添加蓝藻和超声波脱毒蓝藻对草金鱼生长、体色和微囊藻毒素(MCs)含量的影响,分别用添加0(对照组)、50%蓝藻藻泥、50%脱毒蓝藻藻泥、67%蓝藻藻泥和67%脱毒蓝藻藻泥饲料饲喂草金鱼60 d。结果显示:饲料中添加蓝藻藻泥能够显著促进草金鱼生长(P<0.05),而经超声脱毒蓝藻未表现出促生长作用。与对照组相比,饲喂添加67%蓝藻藻泥饲料组草金鱼皮肤a*红度值、b*黄度值和类胡萝卜素含量均显著升高(P<0.05),饲料中添加67%蓝藻藻泥增色效果最佳。对照组草金鱼内脏和肌肉内均未检测到微囊藻毒素RR(MC-RR)和微囊藻毒素LR(MC-LR)存在。饲喂添加蓝藻藻泥饲料或脱毒蓝藻藻泥饲料后,草金鱼肌肉和内脏内均有MC-RR蓄积,且蓝藻藻泥添加组和脱毒蓝藻藻泥添加组间无显著差异(P>0.05),草金鱼内脏内检测到MC-LR蓄积,二者间差异亦不显著(P>0.05),仅在饲喂添加67%蓝藻藻泥草金鱼肌肉内检测到MC-LR蓄积。
关键词:草金鱼;蓝藻;脱毒蓝藻;生长;体色;MCs含量
中图分类号:S917.4 文献标志码:A DOI 编码:10.3969/j.issn.1006-6500.2020.07.007
Abstract: To investigate effects of feeds added with cyanobacteria and detoxified cyanobacteria with ultrasonic on the growth, body color and microcystins (MCs) contents of goldfish, goldfish were fed with feeds supplemented with 0 (control), 50% cyanobacteria mud, 50% detoxified cyanobacteria mud, 67% cyanobacteria mud and 67% detoxified cyanobacteria mud for 60 d. The results showed that cyanobacteria supplementation could stimulate goldfish growth significantly(P<0.05), and cyanobacteria with ultrasonic detoxification had no stimulatory effects on the growth. As compared with the control, redness (a*), yellowness (b*) and carotenoid content of the fish fed with 67% cyanobacteria mud increased significantly(P<0.05), suggesting adding 67% cyanobacteria mud into the feed had the best effects on improving fish body color. Both microcystin-RR (MC-RR) and microcystin-LR (MC-LR) were not detected in the viscera and muscles of the control group fish. After being fed with cyanobacteria and detoxified cyanobacteria mud, MC-RR accumulations were detected in the viscera and muscles of goldfish, and insignificant difference was observed between fish fed with cyanobacteria and detoxified cyanobacteria mud(P>0.05). MC-LR accumulation was detected in the viscera, there was no significant difference between fish fed with cyanobacteria and detoxified cyanobacteria mud(P>0.05). The accumulation of MC-LR was only detected in goldfish muscle fed with 67% cyanobacteria mud.
Key words:goldfish; cyanobacteria; detoxified cyanobacteria; growth; body color; MCs content
近幾十年来,因水体富营养化造成蓝藻水华频发,已经成为存在于淡水生态系统的世界性难题。目前,蓝藻水华治理主要有物理消除、生物防控和化学抑杀3种方式[1],其中机械打捞(物理消除)是现阶段降低蓝藻再次爆发强度和减除其水污染危害的最直接有效的措施[2]。但大量打捞出来的蓝藻若得不到及时有效处理,长期堆积腐败后会产生恶臭、释放蓝藻毒素、氮、磷营养盐,引发新的环境问题[3-4]。因此,如何低成本、高效率地处置和利用水华蓝藻已成为蓝藻水华治理过程中亟待解决的问题之一。
目前蓝藻资源化利用主要有以下几种方式:制备蓝藻堆肥、制备蓝藻沼肥、作为饲料原料、生物质新能源等[5]。蓝藻干物质中含有约 30%~50%的蛋白质[6],将其作为养殖动物饲料蛋白质来源具有巨大的发展前景。另外,蓝藻内还富含多种微量元素、类胡萝卜素等,可以高效改善动物体色[7]。但由于蓝藻细胞内蓝藻毒素的存在,动物摄食后毒素蓄积不仅影响其自身生长,还会通过食物链最终危害人类健康。蓝藻毒素已成为蓝藻饲料化利用的主要障碍,因此,应对蓝藻进行适当的脱毒处理,并寻找和筛选对蓝藻耐受性比较高的养殖品种。
谷秀等[8]研究发现用超声法处理蓝藻,同时具有直接破壁灭藻、抑制未灭藻的生长活性和降解藻毒素3种功效。而对于具有观赏价值的水族动物而言,蓝藻毒素蓄积不存在通过食物链威胁人类健康的风险。在观赏水族动物养殖中,蓝藻饲料化利用更具优势。因此,本研究采用超声波法对打捞蓝藻进行脱毒处理,并对比探究了添加蓝藻饲料和脱毒蓝藻饲料对草金鱼生长、体色和MCs含量的影响,以期为蓝藻在观赏鱼养殖中的资源化利用提供理论依据。
1 材料和方法
1.1 试验材料
水华蓝藻采集自天津市蓟州区蓝科水产养殖有限公司循环水渠,经光镜下鉴定铜绿微囊藻为优势种,真空抽滤直接制成藻泥或脱毒后真空抽滤制成藻泥保存于-20 ℃冰箱。试验用鱼为观赏用草金鱼,由天津市蓟州区蓝科水产养殖有限公司提供,在实验室内暂养1周后用于试验。
1.2 脱毒蓝藻制备
根據谷秀等[8]的方法将采集的水华蓝藻在120 W的超声功率下冰浴超声作用15 min进行脱毒处理,然后真空抽滤制成藻泥保存于-20 ℃冰箱。
1.3 试验饲料
对照组:按照360 g商品饲料添加6 g粘合剂、2 g氯化钙和5 mL水的比例制备而成;添加50%蓝藻/脱毒蓝藻藻泥饲料:按照180 g商品饲料添加180 g蓝藻/脱毒蓝藻藻泥、6 g粘合剂、2 g氯化钙和5 mL水的比例制备而成;添加67%蓝藻/脱毒蓝藻藻泥饲料:按照180 g商品饲料添加360 g蓝藻/脱毒蓝藻藻泥、9 g粘合剂、3 g氯化钙和5 mL水的比例制备而成。
1.4 试验动物及饲养管理
挑选体格健壮、规格一致的600尾草金鱼(3.3±0.5 g)随机分成5组,每组3个重复,每个重复40尾,分别饲养于水族箱内,水温23 ℃。每日分别在9:00和17:00各投喂饲料1次,投喂量为鱼体质量3%左右,试验期60 d。试验结束后将试验鱼空腹24 h,测定体质量、体表色差值,并全部解剖采集样本。
1.5 体表色差值的测定
用纱布将鱼体表面的水分吸干,使用色差仪(CR-400,美能达)进行体表色度测定。测定前先将色差仪调零,将色差仪的探头垂直紧贴于鱼体背部和腹部相同位置测定各试验鱼体表白度值(L*)、红度值(a*)和黄度值(b*)。
1.6 类胡萝卜素含量的测定
将草金鱼鱼体皮肤(带鳞片)剪碎后准确称取0.1 g,用丙酮定容至5 mL,随后经低温超声波震荡40 min,4 500 rpm离心10 min后置4 ℃冰箱中静置24 h获得色素萃取液。以丙酮作为空白对照,然后将获得的色素萃取液置于比色皿中(1 cm),先利用紫外分光光度计进行扫描寻找最大吸收峰处波长,然后在此最大吸收峰处波长下测定各组色素萃取液的吸光度值。
类胡萝卜素含量根据以下公式计算:
类胡萝卜素含量(mg·kg-1)=(A*K*V)/(E*G)
式中,E为摩尔消光系数(2 500);G为样品质量(g);A为吸光度值;K为常数(104);V为提取液体积(mL)。
1.7 MCs含量的测定
MCs的提取参考Xie等[9]方法。分别取试验鱼内脏和肌肉保存于-80 ℃冰箱用于MCs含量的测定。-80 ℃反复冻融5次后混匀、真空冻干。研磨干燥后的组织,称取1 g于离心管中,每种组织取3个平行。分2次(每次用20 mL,90%的甲醇提取液)进行磁力搅拌(30 min)提取,10 000 r·min-1离心10 min取上清液,重复提取2次合并上清液,于旋蒸仪40 ℃蒸发至近1 mL,加入6 mL超纯水分2次溶解。过预先活化的 C18 固相萃取小柱进行萃取,先后用超纯水和20%的甲醇各10 mL淋洗去杂质,然后用10 mL含0.1%TFA甲醇洗脱,保留洗脱液,洗脱液旋蒸至近干,甲醇定容至1 mL。过0.22 μm滤膜过滤,使用安捷伦1260InfinityII高效液相色谱仪测定峰面积及确定每种毒素的出峰时间。
1.8 数据分析
采用SPSS19.0软件进行单因素方差分析(One-way ANOVA)。试验结果以平均值±标准差表示,以P<0.05为差异显著性判断标准。
2 结果与分析
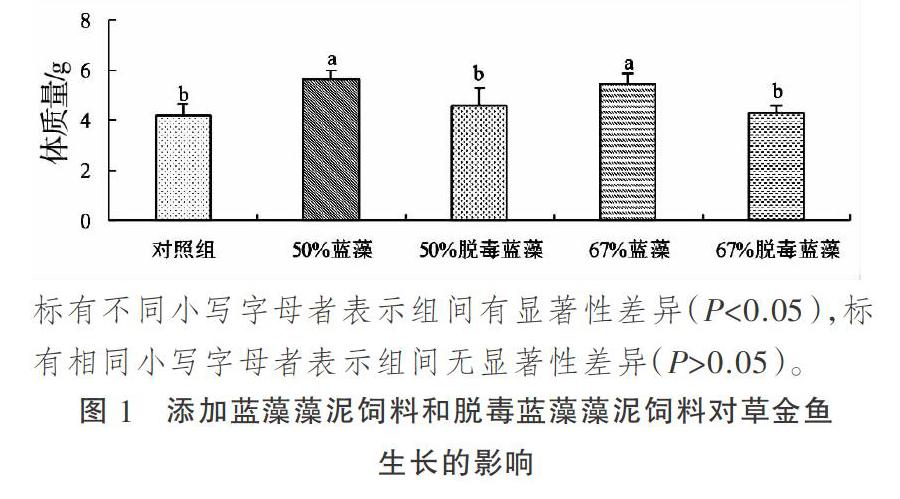
2.1 饲喂添加蓝藻藻泥饲料和脱毒蓝藻藻泥饲料对草金鱼生长的影响
如图1所示,与对照组草金鱼相比,饲喂添加蓝藻藻泥饲料组草金鱼终末体质量显著升高(P<0.05),饲喂添加脱毒蓝藻藻泥饲料组草金鱼终末体重与对照组草金鱼体终末质量差异不显著(P>0.05)。与饲喂添加脱毒蓝藻藻泥饲料组草金鱼相比,饲喂添加等量蓝藻藻泥饲料组草金鱼终末质量显著降低(P<0.05)。
2.2 添加蓝藻藻泥饲料和脱毒蓝藻藻泥饲料对草金鱼体色和类胡萝卜素含量的影响
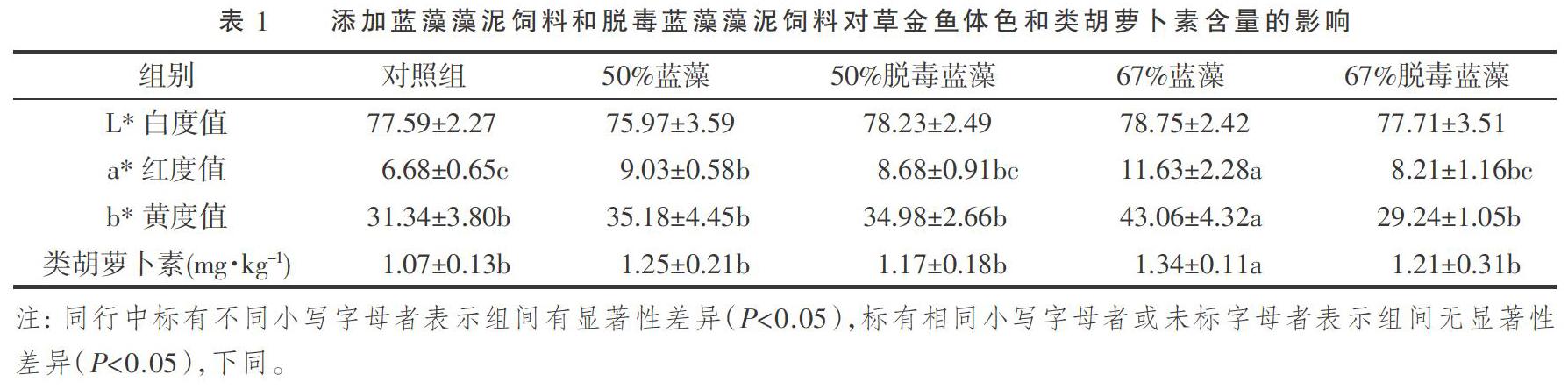
如表1所示,各试验组草金鱼L*白度值均无显著差异(P>0.05);与对照组相比,饲喂添加蓝藻藻泥饲料后,草金鱼体表a*红度值显著升高(P<0.05),而饲喂添加脱毒蓝藻藻泥饲料草金鱼a*红度值与对照组差异不显著(P>0.05);饲喂添加67%蓝藻藻泥饲料草金鱼b*黄度值显著高于其余各试验组(P<0.05),其余各试验组间b*黄度值均无显著差异(P>0.05)。皮肤中类胡萝卜素含量变化与b*黄度值变化一致,饲喂添加67%蓝藻藻泥饲料草金鱼类胡萝卜素含量显著高于其余各试验组(P<0.05)。综合比较草金鱼皮肤中类胡萝卜素含量与体表色度指标判定,添加67%蓝藻藻泥饲料对改善试验鱼体色效果最好。
2.3 添加蓝藻藻泥饲料和脱毒蓝藻藻泥饲料对草金鱼组织中MCs含量的影响
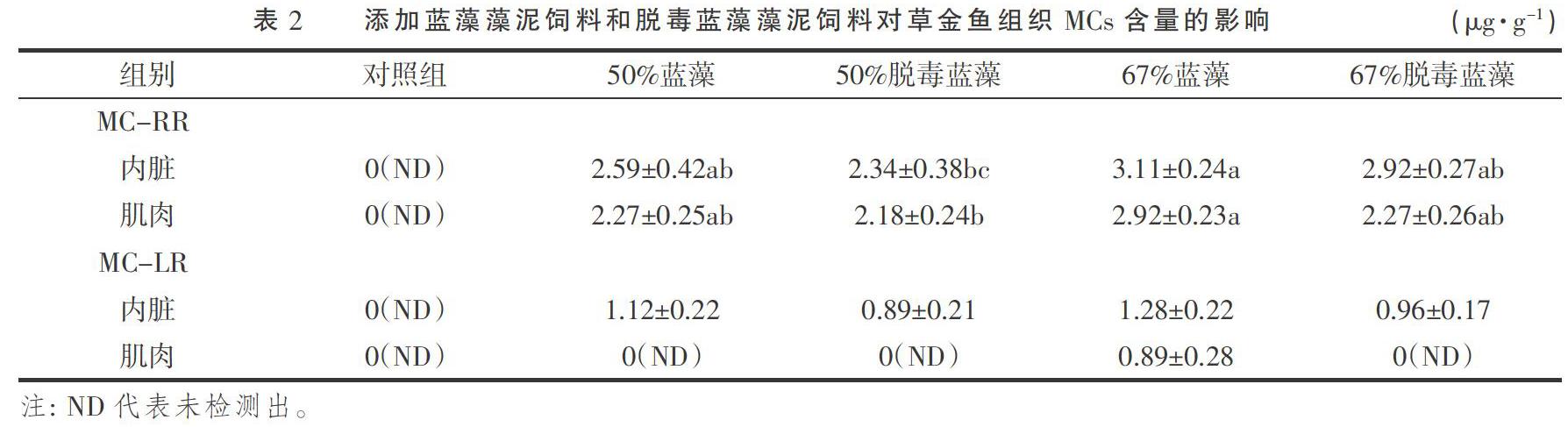
如表2所示,对照组草金鱼内脏和肌肉内均未检测到MC-RR和MC-LR。饲喂添加蓝藻藻泥饲料和脱毒蓝藻藻泥饲料后,草金鱼内脏和肌肉内均能检测到MC-RR存在,其中饲喂添加67%蓝藻藻泥饲料组草金鱼组织内MC-RR含量最高。与饲喂添加蓝藻藻泥饲料草金鱼相比,虽然饲喂等量脱毒蓝藻藻泥饲料后草金鱼组织内MC-RR含量降低,但无显著差异(P>0.05)。饲喂添加蓝藻藻泥饲料和脱毒蓝藻藻泥饲料后,草金鱼内脏内均能检测到MC-LR存在,且各添加组间差异不显著(P>0.05),仅饲喂添加67%蓝藻藻泥饲料组的草金鱼肌肉内检查到了MC-LR。
3 结论与讨论
微藻富含高蛋白、碳水化合物和脂类,因此作为饲料添加剂具有高营养价值,以其作为渔用营养源应用于水产养殖生产备受关注[10]。蓝藻同样富含蛋白质、微量元素、类胡萝卜素等[6-7],可作为渔用饲料蛋白源和增色剂应用,但是蓝藻细胞内毒素的存在却是限制其应用价值的主要障碍。如何发挥蓝藻的营养作用,同时降低其潜在的毒性作用是蓝藻饲料资源化利用时亟待解决的问题。摄食含低剂量藻毒素的蓝藻粉可提高鱼类的摄食率,同时饲料中的蓝藻粉会降低鱼类的饲料转化率和消化率[11-13],并且不同鱼类对藻毒素的耐受性不同[14]。因此,我们选择对蓝藻进行适当的超声脱毒处理并以观赏用草金鱼作为试验对象,探讨蓝藻在观赏鱼养殖中作为饲料蛋白质来源的潜在价值。通过机械打捞后的蓝藻经喷雾干燥法制成干粉代价昂贵,而晾晒除水则会导致营养成分流失。因此,为了降低前处理成本并最大限度地保留其营养成分,本研究饲料中蓝藻以真空抽滤后获得藻泥形式进行添加,制备的蓝藻藻泥与干粉之间的质量换算比例100∶1。
本试验打捞用蓝藻主要为铜绿微囊藻,MC-LR和MC-RR是微囊藻中存在最普遍、含量最多两种MCs异构体,MC-LR的急性毒性强于MC-RR[14]。饲喂添加蓝藻藻泥饲料和脱毒蓝藻藻泥饲料后,草金鱼肌肉和内脏内均有MC-RR蓄积,且在内脏内均检测到MC-LR蓄积,肌肉内仅在饲喂添加67%蓝藻试验组内检测到MC-LR蓄积。虽然与饲喂67%蓝藻草金鱼相比,饲喂等量脱毒蓝藻显著降低了草金鱼肌肉内MC-LR含量,但内脏中的MC-LR含量,以及肌肉和内脏中的MC-RR含量并未受到蓝藻脱毒的影响。分析其原因,可能在于超声波处理虽然能够有效降解胞外毒素[6,15],但是对未释放到胞外的胞内毒素降解效果差。
饲料中添加蓝藻藻泥能显著促进草金鱼的生长,但蓝藻经超声脱毒后未发挥促生长作用。草金鱼对MCs耐受性较强,因此在2种蓝藻添加量下,蓝藻对草金鱼的营养物作用大于其潜在的毒性作用。另外,随着蓝藻添加量增大,MCs蓄积量增加,其潜在毒性作用增强,因此较低添加量(50%)蓝藻促生长效果更为明显。而超声脱毒处理可能破坏蓝藻某些营养成分,因而使得经超声脱毒蓝藻未表现出显著促生长作用。
在观赏鱼体色呈现中,类胡萝卜素起到关键作用,但鱼体自身不具备合成相关类胡萝卜素的能力,只能通过饲料添加方式从外界摄取[16]。因此,在饲料中添加增色剂促进鱼体增色,是提高观赏性鱼类观赏价值的可靠方法。白东清等[17]研究表明,在饲料中添加一定水平的盐藻、裂壶藻以及玉米蛋白粉可提高鱼体类胡萝卜素含量,提高鱼体的黄度。刘梦雨等[18]通过试验得出,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,经检测,皮肤、鳞片、鳍条中类胡萝卜素含量均随着组合饲料添加水平的增加呈现先升后降的变化趋势,饲料中含8%螺旋藻、2%裂壶藻、8%大型溞粉的组合饲料对改善试验鱼体色效果较好。孙金輝等[19]的试验中,盐藻组慈鲷皮肤中总类胡萝卜素的含量要显著高于对照组、裂壶藻组和小球藻组,添加藻粉后各组鳍条中总类胡萝卜素的含量均显著高于对照组(P<0.05),这表明盐藻中的类胡萝卜素经过代谢能够在血艳红慈鲷体内得到有效转化,从而起到增色效果。杨育凯等[20]研究发现饲料中添加盐藻可以增加卵形鲳鲹b*,鱼体体色更为金黄。王磊等[21]认为饲料中添加一定量的雨生红球藻粉对七彩神仙鱼具有较好的着色效果,尤其是皮肤和鳍条的着色效果尤为显著,并且低添加量组(3.33 g·kg-1和6.66 g·kg-1)相比于高添加剂量(9.99,13.32和16.65 g·kg-1)对七彩神仙鱼皮肤和鳍条的增色效果显著提高(P<0.05)。本研究结果证明饲料中添加适量蓝藻同样能够改善试验鱼体色,综合比较草金鱼皮肤中类胡萝卜素含量与体表色度指标判定,添加67%蓝藻藻泥饲料改善体色效果最好。上述试验结果表明,试验鱼种类及其对不同种类微藻的耐受性都会影响微藻的体色改良效果。
综上所述,草金鱼对MCs有较强的耐受性,饲喂添加蓝藻藻泥饲料既可以促进草金鱼生长,亦会改善草金鱼体色,但超声波处理对蓝藻胞内毒素脱除效果不佳,并有可能破坏蓝藻营养成分,因此添加超声脱毒蓝藻未表现出明显促生长作用和增色效果。
参考文献:
[1]PARK M H, HWANG S J, AHN C Y, et al.Screening of seventeen oak extracts for the growth inhibition of the cyanobacterium Microcystis aeruginosa K tem. Elenkin[J]. Bulletin of environmental contamination and toxicology, 2006, 77(1): 9-14.
[2]朱喜. 太湖蓝藻打捞和资源化利用的实践与思考[J]. 江苏水利, 2009(7): 35-37.
[3]赵悬悬, 朱光灿, 许丽娟, 等. 蓝藻自然腐解特性研究[J]. 江苏农业学报, 2013, 29(2): 312-318.
[4]孙小静, 秦伯强, 朱广伟. 蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放[J]. 中国环境科学, 2007, 27 (3): 341-345.
[5]闫冉, 李云利, 毕相东, 等. 有害蓝藻资源化利用现状和发展趋势[J]. 天津农业科学, 2015, 21(5): 72-76.
[6]董桂芳, 解绶启, 朱晓鸣, 等. 水华蓝藻对鱼类的营养毒理学效应[J]. 生态学报, 2012, 32(19): 6233-6241.
[7]朱钦龙. 蓝藻能改善草虾的体色[J]. 畜牧兽医科技信息, 1999(19): 4.
[8]谷秀, 李捍东, 李霁, 等. 超声波技术去除藻毒素的效果[J]. 环境工程技术学报, 2015, 5(2):155-160.
[9]XIE P, OZAWA K. Dynamics of microcystins-LR and RR in the phytoplanktivorous silver carp in a subchronictoxicity experiment[J]. Environmental pollution, 2004, 127(3): 431-439.
[10]侯玉洁, 曾柳根, 姚毅. 微藻营养价值及其在鱼类营养中的应用[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集, 2016.
[11]ZHAO M, XIE S, ZHU X, et al.Effect of inclusion of blue-green algae meal on growth and accumulation of microcystins in gibel carp (Carassius auratusgibelio)[J]. Journal of applied ichthyology, 2006, 22(1): 72-78.
[12]ZHAO M, XIE S Q, ZHU X M, et al.Effect of dietary cyanobacteria on growth and accumulation of microcystins in Nile tilapia (Oreochromis niloticus)[J]. Aquaculture, 2006, 261(3): 960-966.
[13]ZHAO M. Comparative studies of the effects of dietary blue-green algae meal inclusion on fishes of different food habits[D]. Wuhan: Institute of hydrobiology, Chinese academy of sciences, 2006: 43-109.
[14]OZAWA K,FUJIKOA H,MURANAKA M,et al. Spatial distribution and temporal variation of Microcystis species composition and microcystin concentration in Lake Biwa[J]. Environmental toxicology, 2005(20): 270-276.
[15]喬俊莲, 董磊, 董敏殷, 等. 高频超声波对微囊藻毒素释放及降解的特性研究[J]. 中国给水排水, 2009, 25(17): 94-96.
[16]GOODWIN T W. The biochemistry of the carotenoids[M]. London: Chapman and Hall, 1985: 64-69.
[17]白东清, 吴旋, 艾水昌, 等. 盐藻+裂壶藻+玉米蛋白粉对红草金鱼生长、体色和生理生化指标的影响[J]. 饲料研究, 2019, 42(10): 42-47.
[18]刘梦雨, 吴旋, 曾祥茜, 等. 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼生长、体色和生理生化指标的影响[J]. 动物营养学报, 2020,32(3):1454-1464.
[19]孙金辉, 李家鑫, 崔培, 等.不同藻源对血艳红慈鲷体色及部分免疫指标的影响[J]. 湖北农业科学, 2019, 58(2): 100-103, 114.
[20]杨育凯, 陈效儒, 林黑着, 等. 饲料盐藻水平对卵形鲳鲹体色和生长的影响[J]. 水产科学, 2017, 36(3): 336-340.
[21]王磊, 陈再忠, 冷向军, 等. 饲料中添加雨生红球藻对七彩神仙鱼生长、体色及抗氧化力的影响[J]. 淡水渔业, 2016, 46(6): 92-97.

