HY分子筛的SO2吸附性能研究
武传朋,陈 妍,郭大为,宋海涛,毛安国,达志坚
(中国石化石油化工科学研究院,北京 100083)
SO2主要来自石油炼制、化学工业和煤炭燃烧等过程的烟气排放[1],是大气污染的主要源头之一,易引发严重的环境问题,并对人类健康造成严重威胁[2],因此人们在烟气净化方面做了大量的研究。与湿法脱硫工艺相比,吸附法脱硫无二次污染产生,工艺简单,操作性强,对设备无腐蚀,具有较好的环境效益和经济效益,成为近年来的研究热点。
吸附材料的选择是吸附系统设计的关键[1]。Y分子筛作为一种具有明确孔结构和独特表面性质的结晶硅铝酸盐,具有良好的化学稳定性、热稳定性、耐酸性,并可重复再生,因而近年来被广泛应用于烟气中SO2等污染物的吸附脱除研究。

尽管有关Y分子筛吸附SO2的研究较多,但关于硅铝比对Y分子筛的SO2吸附性能影响的研究未见报道,Y分子筛硅铝比对其SO2吸附性能的影响机制尚不明确。本课题选择3种不同硅铝比的HY分子筛作为吸附剂,考察其SO2吸附性能,分析探讨分子筛表面物理化学性质对其SO2吸附性能的影响规律,系统研究并解释分子筛硅铝比差异造成SO2吸附性能差异的原因,为Y分子筛应用于吸附法脱除烟气中SO2提供理论依据。
1 实 验
1.1 吸附剂与原料
吸附剂为不同硅铝比的HY分子筛HY-1,HY-2,HY-3,由石科院自制,其基本组成如表1所示。从表1可以看出:HY-1,HY-2,HY-3的硅铝原子比n(Si)/n(Al)依次增大,另外HY-1,HY-2,HY-3分子筛中均含有极少量的Na2O。试验所用高纯N2和压缩空气由北京环宇京辉京城气体科技有限公司提供,SO2由北京氦普北分气体工业有限公司提供。

表1 HY分子筛的基本组成
1.2 分子筛表征
采用美国Micromeritics公司生产的ASAP 2420型自动吸附仪进行比表面积和孔体积测定,通过BET方法得到吸附材料的BET比表面积,通过t-plot方法得到材料的微孔比表面积和微孔体积,平均孔径由总孔体积与BET比表面积计算得到,孔径分布通过BJH法得到。采用荷兰Panalytical公司生产的X’pert型X射线衍射(XRD)仪测定分子筛晶体结构,测定条件为:管电压40 kV、辐射源CuKα(λ=0.154 nm)、扫描速率4(°)/min、扫描角度5°~40°。采用日本理学株式会社生产的ZSX PrimusⅡ型X射线荧光光谱(XRF)仪测定分子筛元素组成,激发电压为50 kV,激发电流为50 mA。采用美国BIO-RAD公司生产的FTS3000型傅里叶变换红外光谱仪(FT-IR)进行分子筛的吡啶-红外光谱(IR)酸性测定。采用美国Micromeritics公司生产的AutochemⅡ2920型化学吸附仪进行分子筛的CO2程序升温脱附(CO2-TPD)、O2程序升温脱附(O2-TPD)测定。采用德国NETZSCH公司生产的热质联用系统QMS403/5 Skimmer进行分子筛的热重-质谱(TG-MS)分析。
1.3 吸附性能评价试验
SO2动态吸附试验在小型固定床评价装置上进行,试验装置由配气系统、反应系统和分析系统3部分组成,其流程示意如图1所示。由配气系统配制模拟烟气,其中SO2,O2,N2的体积分数分别为0.10%,6.00%,93.90%。石英反应器内径为16 mm,装入4 g 100~150目的吸附剂,床层高度约为30 mm。分析系统为北京杰席特科技有限公司生产的MGS300多组分连续气体测量分析系统,该系统包含了预处理单元、美国万机仪器有限公司生产的Multigas2030傅里叶变换红外光谱(FT-IR)准原位气体分析仪、澳大利亚NOVATECH公司生产的ZrO-1632/1231氧分析仪和后处理单元。
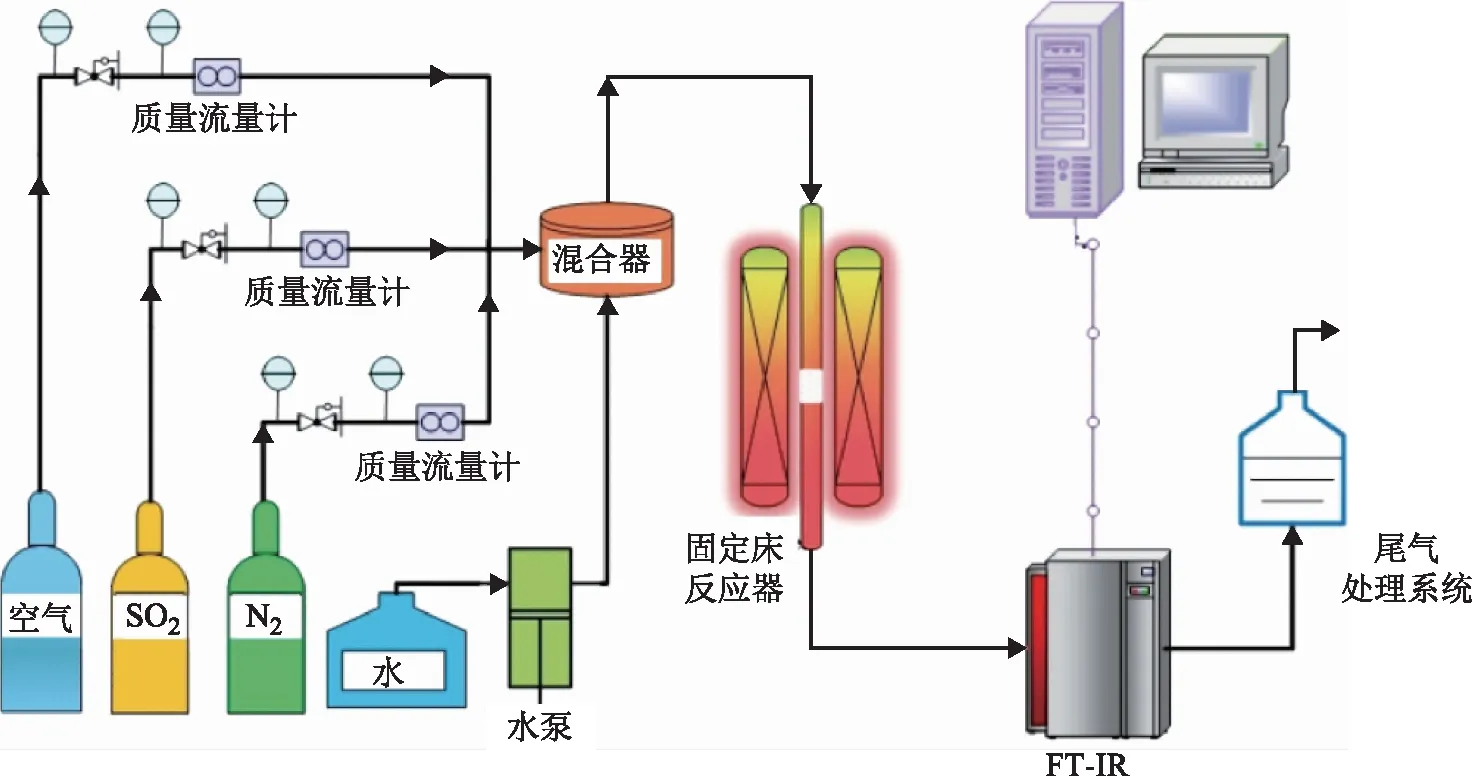
图1 SO2吸附评价装置
吸附试验条件为:吸附剂床层温度50 ℃,模拟烟气流量0.5 L/min,吸附压力0.005 MPa。烟气入口SO2浓度和出口SO2浓度分别标记为Cin、Cout。当Cout/Cin≥0.1时,认为SO2已穿透吸附剂床层;当Cout/Cin≥0.9时,认为SO2已吸附饱和,停止试验。吸附试验结束后,采用高纯N2吹扫,流量为0.5 L/min,直至SO2红外光谱测量值为0。以吸附时间t为横坐标、Cout/Cin为纵坐标绘制SO2吸附穿透曲线,并按式(1)计算吸附剂的SO2饱和吸附容量。
(1)
式中:Qsat为SO2饱和吸附容量,mg/g;F为模拟烟气流量,L/min;m为吸附剂质量,g;tsat为吸附饱和时间,即Cout/Cin=0.9时的吸附时间,min。
2 结果与讨论
2.1 SO2动态吸附试验
不同硅铝比HY分子筛的SO2吸附穿透试验结果如图2所示。从图2可以看出,随着硅铝比增大,HY-1,HY-2,HY-3吸附SO2的穿透时间依次减短,饱和吸附容量依次减小,说明HY分子筛对SO2的吸附性能随硅铝比的增大而下降,低硅铝比的HY分子筛更适用于吸附SO2。
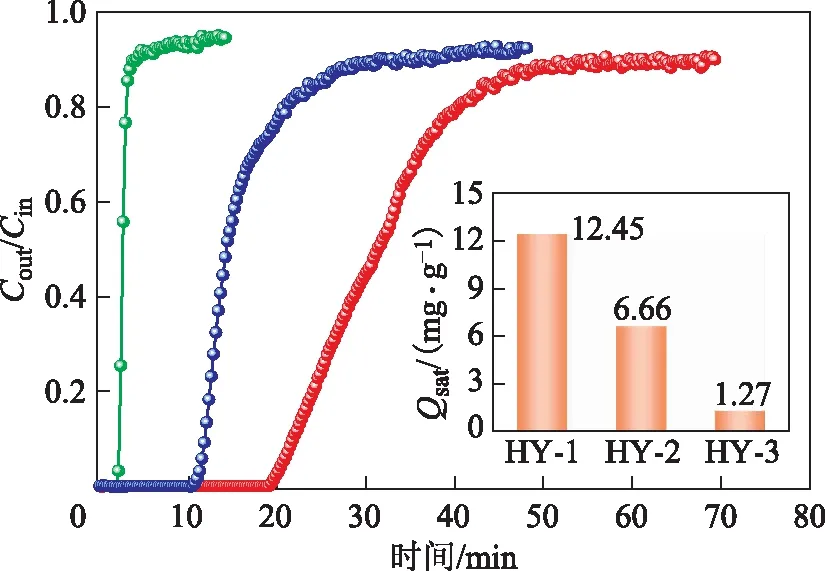
图2 HY分子筛的SO2吸附穿透曲线及饱和吸附容量—HY-1; —HY-2; —HY-3
2.2 孔结构分析
不同硅铝比HY分子筛的孔结构分析结果如表2所示。从表2可以看出,随着分子筛硅铝比增大,HY-1,HY-2,HY-3的总比表面积、微孔比表面积、微孔体积依次减小,总孔体积、介孔体积、平均孔径则依次增大。

表2 HY分子筛的BET分析结果
因HY分子筛微孔孔径的类型及大小较为公知,本课题不再进行考察,而仅通过BJH法得到不同硅铝比HY分子筛的介孔孔径分布,如图3所示。从图3可以看出,HY-1,HY-2,HY-3的孔径分布在3.3~4.2 nm左右出现峰值,且随分子筛硅铝比增大,峰值高度逐渐增加,说明HY分子筛在制备过程中形成了二次孔结构,并随分子筛硅铝比增大,二次孔结构体积增加。Y分子筛的十二元环孔道直径约为0.74 nm,超笼空腔内径约为1.3 nm。由HY-1,HY-2,HY-3孔径分布在3.3~4.2 nm左右出现峰值可以推测其二次孔结构大致相当于由2~4个超笼结构相连形成。

图3 HY分子筛的介孔孔径分布●—HY-1;▲—HY-2; ◆—HY-3
不同硅铝比HY分子筛的N2吸附-脱附等温线如图4所示。从图4可以看出:HY-1,HY-2,HY-3的吸附-脱附等温线中均有回滞环出现,说明它们均含有介孔结构;随着分子筛硅铝比增大,回滞环宽度增大,说明HY分子筛的介孔体积随硅铝比的增大而增大。由分子筛介孔体积与总孔体积之比计算得到HY-1,HY-2,HY-3的介孔占比分别为17.11%,19.34%,39.45%,可见随着分子筛硅铝比增大,其介孔占比也增大。

图4 HY分子筛的N2吸附-脱附等温线●—HY-1; ▲—HY-2; ◆—HY-3
结合2.1节结果可知,HY分子筛的比表面积与其SO2饱和吸附容量有较好的对应关系,随着比表面积、微孔体积增大,其SO2饱和吸附容量也增大。HY-1,HY-2,HY-3总孔体积依次增大,但由于微孔体积依次减小,所以总孔体积的增大主要源自其介孔体积的增大。分子筛介孔体积的增大并没有促进其对SO2的吸附,SO2的饱和吸附容量与HY分子筛介孔体积成反比关系。当吸附剂表面孔径大小接近吸附质分子临界尺寸时,吸附质最易被吸附,吸附效率最高;而当吸附剂孔径过大或过小时,吸附作用迅速减弱。当吸附剂的孔径为吸附质分子直径的1.7~3.0倍时,吸附剂利用率最高[15]。SO2分子临界直径为0.411 nm,HY分子筛十二元环孔道直径为0.74 nm,超笼空腔内径约为1.3 nm,因此HY分子筛微孔结构较适合SO2的吸附,而当HY分子筛形成介孔结构后,其对SO2的吸附作用减弱。
2.3 晶相结构分析
图5为3种不同硅铝比HY分子筛的XRD图谱。从图5可以看出,HY-1,HY-2,HY-3的衍射峰峰型与Y分子筛的特征衍射峰一致,说明HY-1,HY-2,HY-3分子筛均为典型的八面沸石型立方晶系结构。
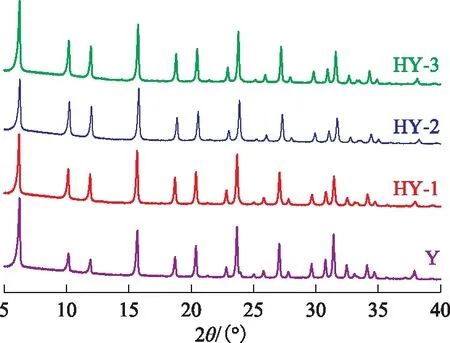
图5 HY分子筛的XRD图谱
2.4 酸性质分析
分子筛中B酸酸性位主要来源于三配位Al与Si形成的Al—OH—Si结构上的羟基基团,L酸酸性位则是骨架上或骨架外配位不饱和的铝物种,如AlO+、AlxOy或其他骨架外阳离子。不同硅铝比HY分子筛的酸性质如表3所示。从表3可以看出,随着分子筛硅铝比增大,HY-1,HY-2,HY-3的总酸量和中强酸酸量依次减小,B酸酸量依次减小,L酸酸量依次增大。分子筛总酸量和中强酸酸量逐渐减小可能是由分子筛脱铝所致,分子筛骨架铝脱除会形成一部分非骨架铝,形成的非骨架铝会平衡一部分骨架负电荷,从而导致分子筛B酸酸量随着硅铝比的增大而减小[16]。分子筛脱铝过程中部分铝从骨架上脱除后并未完全脱离分子筛,而是转变成非骨架铝继续提供酸性位,L酸酸性位来源于骨架外配位不饱和的铝物种,因此L酸酸量随分子筛硅铝比的增大而增大[17]。

表3 HY分子筛的酸性质分析结果
Deo等[6]研究认为SO2在HY分子筛上通过表面羟基形成氢键而进行物理吸附。Marcu等[5]研究认为SO2在Y分子筛上主要通过表面羟基基团形成线性连接和桥式连接进行物理吸附和化学吸附,其吸附结构示意如图6所示。由以上分子筛酸性质分析发现,HY-1,HY-2,HY-3的B酸酸量依次减小,可见HY分子筛的SO2饱和吸附容量随着B酸酸量的减小而减小,由此推测,B酸酸性位是SO2的吸附位,SO2在B酸酸性位上形成氢键而进行吸附。同时,HY-1,HY-2,HY-3的L酸酸量依次增大,但SO2饱和吸附容量并未随之增大,所以L酸酸性位不是SO2的吸附位。

图6 SO2在Y分子筛羟基基团的吸附结构示意
2.5 碱性位测定
分子筛结构中的碱中心来源于带有负电荷的[AlO4]-四面体,当被具有低电负性的阳离子补偿时足以产生碱性骨架氧作L碱中心。分子筛的碱性质与其骨架氧电负性直接有关,同时还与分子筛化学组成(如分子筛中Al含量)、阳离子性质和分子筛结构(如键长和键角)有关[18-19]。采用CO2-TPD表征分子筛表面碱性,定义温度低于300 ℃时的脱附峰为弱碱性位[20-21],温度为300~500 ℃时的脱附峰为中强碱性位,温度高于500 ℃时的脱附峰为强碱性位[22]。不同硅铝比分子筛的CO2-TPD曲线如图7所示。

图7 HY分子筛的CO2-TPD曲线 —HY-1; —HY-2; —HY-3
从图7可以看出,HY-1,HY-2,HY-3的CO2脱附峰主要位于温度小于300 ℃的区间内,说明3种分子筛的碱性位主要为弱碱性位。HY-1,HY-2,HY-3的CO2脱附峰面积依次减小,说明3种分子筛碱性位含量依次降低。另外,HY-1,HY-2,HY-3分子筛CO2脱附峰位置向低温方向移动,说明3种分子筛碱性强度随硅铝比的增大而降低。这主要是因为分子筛碱中心主要来源于带有负电荷的[AlO4]-四面体,且氧上电荷随Al含量降低而降低,因此,分子筛的碱性位含量和碱性强度随硅铝比的增大而降低[19]。
随着硅铝比增大,HY-1,HY-2,HY-3的碱性位含量依次降低的趋势与SO2动态吸附试验得到的SO2饱和吸附容量变化趋势一致,即分子筛碱性位含量越高,SO2饱和吸附量越大。分子筛碱性桥氧原子Al—O—Si可与SO2相互作用,碱性氧原子与SO2的硫原子通过电子供体-受体相互作用成键[7],因此HY分子筛的碱性位是SO2的吸附位,SO2在HY分子筛碱性位上的吸附结构示意如图8所示。

图8 SO2在HY分子筛碱性位上的吸附结构示意
2.6 O2-TPD分析


图9 HY分子筛的O2-TPD曲线 —HY-1; —HY-2; —HY-3
从图9可以看出:HY-1,HY-2,HY-3的O2脱附峰位置主要位于温度小于350 ℃的区间内,说明HY-1,HY-2,HY-3的表面氧物种主要为表面物理吸附氧和弱化学键键合的超氧离子,并以表面物理吸附氧为主;随着硅铝比增大,HY-1,HY-2,HY-3的表面化学吸附氧含量依次降低。
2.7 TG-MS测定
HY-1,HY-2,HY-3吸附SO2饱和后,用N2吹扫,直至吸附试验装置出口气体中SO2含量红外光谱测量值为0,取出分子筛(分别标记为S-HY-1,S-HY-2,S-HY-3)进行TG-MS测定。测定条件为:以10 ℃/min的升温速率由50 ℃升温至1 000 ℃,在1 000 ℃下稳定20 min。
图10为HY分子筛吸附SO2前后的热重曲线,其中虚线为未吸附SO2时的热重曲线,实线为吸附SO2后的热重曲线。对吸附SO2后分子筛热重测试过程中的SO2进行质谱检测,结果如图11所示。

图10 HY分子筛吸附SO2前后的TG曲线

图11 吸附SO2后HY分子筛热重测试过程中的SO2质谱检测曲线■—S-HY-1; ●—S-HY-2; ▲—S-HY-3
从图10可以看出,吸附SO2后的HY分子筛存在3个主要的失重段,第一个失重段在50~250 ℃之间,主要由分子筛物理吸附水和少量物理吸附SO2失重产生,第二个失重段在250~550 ℃之间,主要由分子筛化学吸附水和以弱化学键结合的SO2失重产生,第三个失重段在550~1 000 ℃之间,主要由分子筛强化学吸附的SO2失重产生。
从图11可以看出:质谱在550 ℃之后可检测到S-HY-1表面硫酸盐热分解产生的SO2信号,约在900 ℃时SO2信号达到最高;S-HY-2表面吸附硫在热重测试过程分解产生的SO2主要在350~750 ℃之间被检测到,在900 ℃附近产生了一个SO2信号峰;S-HY-3在整个热重测试过程中几乎检测不到SO2信号,在850 ℃附近产生了一个较小的SO2信号峰。以上结果说明,随着硅铝比的增大,HY分子筛化学吸附SO2的量依次降低,即SO2发生氧化吸附的程度随分子筛硅铝比的增大而降低。
与2.6节O2-TPD分析结果对比发现,HY分子筛表面化学吸附氧含量随硅铝比增大而依次降低的规律与HY分子筛化学吸附SO2的量有较好的对应关系,即低硅铝比分子筛表面含有更丰富的化学吸附氧物种,促进了SO2在分子筛表面的化学吸附,由此可以推断,分子筛表面氧和碱性位的共同作用促进了SO2的吸附。
3 结 论
(1)随着硅铝比增大,HY分子筛的SO2穿透时间依次减短,SO2饱和吸附容量依次减小,说明增大硅铝比不利于HY分子筛吸附SO2。
(2)HY-1,HY-2,HY-3的SO2饱和吸附容量随着分子筛B酸酸量的减小而减小,说明B酸酸性位是分子筛吸附SO2的吸附位;HY-1,HY-2,HY-3的L酸酸量依次增大,但SO2饱和吸附容量并未随着分子筛L酸酸量的增大而增大,所以L酸酸性位不是分子筛吸附SO2的活性位。
(3)随着硅铝比增大,HY分子筛碱性位含量依次降低,分子筛的SO2饱和吸附容量与分子筛的碱性位含量成正相关,说明分子筛表面的碱性位是分子筛吸附SO2的活性位。
(4)随着硅铝比增大,HY分子筛表面化学吸附氧含量依次降低,与其化学吸附SO2的量有较好的对应关系,即低硅铝比分子筛表面含有更丰富的化学吸附氧物种,促进了SO2在分子筛表面的化学吸附。

