石梅湾3种植物叶片与其群落凋落物C,N,P生态化学计量特征研究
陈毅青,陈宗铸,陈小花,雷金睿,吴庭天,李苑菱
(海南省林业科学研究院,海口 571100)
碳(C)、氮(N)、磷(P)是影响陆生植物生长发育必需的营养元素[1-2]。植物对N,P的吸收利用又会对其固碳能力产生影响,3种元素对植物的生长起到相互促进和相互制约的作用[3-4]。生态化学计量学作为研究生态系统能量与多种化学元素平衡的重要学科[5-6],广泛应用于植物养分积累、养分循环、养分利用效率和土壤质量变化等相关研究领域[7-8]。截至目前,有关生态系统中C,N,P生态化学计量学的研究在全球范围内已有大量报道,如,张书齐等[9]探究了海南岛海岸带木麻黄和厚藤叶片C,N,P含量及化学计量特征,发现海南岛海岸带植被叶片的C,N含量较低,N是影响植物生长的主要限制元素;盘金文等[10]通过研究不同林龄马尾松人工林养分含量及生态化学计量特征,发现马尾松不同器官养分含量及化学计量比存在差异,针叶N∶P值处于1.11~1.85范围,生长过程中主要受N限制;王鑫等[11]研究得出不同林型和海拔对凋落物养分含量及其生态化学计量特征的影响存在显著差异,且各影响因子(海拔、纬度、坡度等)与养分含量之间存在显著相关性;关梦冉[12]对亚热带3种林分叶片及凋落物化学计量特征研究表明,甜槠(Castanopsiseyrei)、苦槠(Castanobsissclerophylla)常绿阔叶林分主要受P限制,而杉木林分主要受N,P共同限制。然而,目前关于C,N,P养分循环的研究多集中在叶片或凋落物的化学计量特征,对于植物叶片-凋落物之间养分的转移和再利用生态化学计量学方面报道较少[13-14],仅万芳等[15]发现植物叶片的C,N,P质量分数显著高于其枯落物的质量分数。在森林生态系统中,叶片是植物对养分供应状况最为敏感的部位,也是植物代谢过程的关键器官[16],而凋落物是养分循环中重要的环节,可为植物生长提供所需的矿质元素,因此,有必要开展植物叶片和凋落物的相关性研究。
由于海岸带地区地理位置特殊,受强烈自然与人为因素的影响,具有土壤贫瘠、养分含量低等特点,生态环境相对脆弱[17]。近年,不少学者对海岸带植被的生态化学计量学特征开展了研究,研究对象有广西红树林,福建相思(Acaciaconfusa)、木麻黄(Casuarinaequisetifolia)和湿地松(Pinuselliottii)等[18-21]。石梅湾位于海南岛东南沿海地区,主要典型植被类型有天然生长的青皮林群落(主要优势树种青皮(Vaticamangachapoi))、木麻黄林和红树林,利用该区丰富的植被类型特点,有必要开展相关研究了解海岸带不同典型植物群落的养分限制能力。基于此,本研究以海南岛万宁市石梅湾天然青皮林、海防林、木麻黄林和红树林为研究对象,运用生态化学计量学方法,分析群落建群种青皮、木麻黄和拉关木(Lagunculariaracemosa)的叶片与其群落地表凋落物养分限制格局及养分再吸收作用,为海岸带的植物生长和植物群落的养分管理提供基础数据和科学依据。
1 材料与方法
1.1 研究区概况
研究区位于海南东南沿海地区(万宁市石梅湾附近,如图1所示),该区属于沿海防护基干林区域,为热带海洋性季风气候,年平均气温24.5℃,无寒潮与霜冻,年平均降水量为2 032mm,降水集中在5—10月,年均日照时间2 230h。该区常见森林群落有青皮单优群落(目前海南岛面积最大的天然青皮群落)、木麻黄林(人工种植,树龄20a)和红树林(建群种拉关木)。其中,青皮林群落乔木层以青皮、木麻黄、大花五桠果(Dilleniaturbinata)为优势种,灌木层以破布叶(Microcospaniculata)、土蜜树(Brideliatomentosa)和白楸(Mallotuspaniculatus)为优势种,草本层以方叶五月茶(Antidesmaghaesembilla)、穗花轴榈(Licualafordiana)和翻白叶(Potentillafulgens)为主要优势种。木麻黄林群落结构简单,乔木层以常绿乔木木麻黄为主,种植密度2m×2m,林下灌草有零星分布;红树林群落选择人工种植的红树林,拉关木属于使君子科(Combretaceae),是真红树植物(truemangrove)的一种,树高2~5m,群落外貌浅绿色,结构简单,有零星分布其它混生种。所选样地沿海岸呈条带状分布,为开展热带植物群落凋落物现存量及养分特征研究提供了良好的场所。
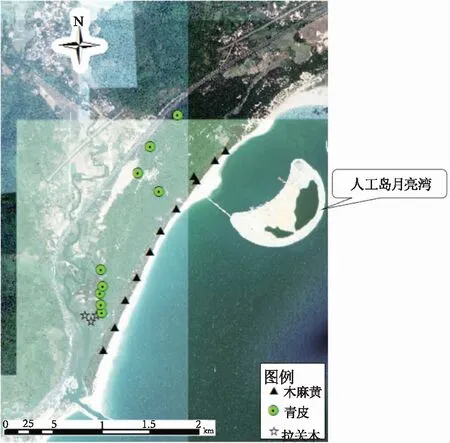
图1 采样点分布图Fig.1 Sampling locations of three forests
1.1 采样地设置与样品采集
2020年3月中旬,在海南岛东南沿海地区选取生境条件基本一致的植物群落,分别是青皮林、木麻黄林和红树林。采用随机布设样方的方法,要求样方间距大于10m,总共布设23个样方(面积5m×5m),分别采集各群落建群种的叶片与其所属群落地表凋落物。调查范围内,经实地查看发现,凋落物的构成主要来源于建群种,因此,叶片选择目标确定为:青皮林群落选择青皮,木麻黄林选择木麻黄,红树林选择拉关木。基于此,在样方内随机选择生长状况相同的标准木进行取样,其中:青皮树单叶,呈锥圆形;木麻黄鳞片状叶,呈披针形、三角形或棒状圆柱形;拉关木单叶互生,呈倒卵形或倒卵状矩圆形。统一采摘树冠下层生长健康的枝条4~5束,根据叶片形态特征,选择完整无病害且呈绿色的。每个样方内叶片采集量不少于500g。另外,在样方内设置大小为0.5m×0.5m表层凋落物采集区,采集量表层凋落物500g左右,分别装进样品袋带回实验室烘干至恒重,鲜叶需先在105℃下杀青30min。
1.1 样品测定
将从野外采集回来的植物叶片和群落表层凋落物至于烘箱烘干后,放入植物粉碎机粉粹,并且过0.15mm的筛,磨成粉末后测定其C,N,P的质量分数。所有样品处理后送给专业测试中心进行C,N,P含量的测定。植被叶片与表层凋落物的碳测定参考《陆地生物群落调查观测与分析》第八篇26[22];氮测定参考:NY/T 2017-2011[23];磷测定参考:NY/T 2421-2013[24]。
养分再吸收率定义为植物正常生长的养分与表层凋落物的差值,表示植物枯落前养分转移的质量分数。计算公式如下:
式中:Re为养分再吸收效率;TH为植物正常生长的养分质量分数(g/kg);TK为凋落物中养分的质量分数(g/kg)。
1.1 数据处理与统计分析
采用单因素方差分析(One-way ANOVA)和双因素方差分析(TWO-way ANOVA)对3种植物的叶片和凋落物的C,N,P含量以及生态化学计量(C∶N,C∶P,N∶P)特征进行差异分析,若方差为齐性,用LSD法进行显著性多重比较,若方差为非齐性,则用Tambane′s 2法进行多重比较。采用Pearson相关性分析分别对植物叶片和凋落物C,N,P,C∶N,C∶P和N∶P之间的相互关系。所有图表在Excel 2019和SPSS 20.0统计软件中完成。
2 结果与分析
2.2 叶片和凋落物C,N,P质量分数及其N,P养分再吸收效率
从表1可以看出,不同植物叶片C,N,P质量分数均值范围分别为478.00~515.50,9.03~17.80,0.98~1.80g/kg,从变异系数可以得出不同植物叶片的C,N,P质量分数变化都很小。不同植物群落表层凋落物C,N,P质量分数均值范围分别为383.50~479.22,5.65~14.43,0.53~0.69g/kg,从变异系数可以得出不同植物群落表层凋落物的C,N质量分数变化较小,P质量分数变化较大。比较群落建群种叶片与其表层凋落物的C,N,P质量分数发现,植物叶片枯落到地面后C,N和P的质量分数明显降低,说明植物在枯落前养分进行了转移,实现了养分的再吸收利用3种植物叶片与其表层凋落物的C,N,P质量分数均存在差异显著(P<0.05),不同植物间叶片N,P质量分数差异显著(P<0.05),而C质量分数不显著,不同植物群落间表层凋落物C,N质量分数差异显著(P<0.05)。
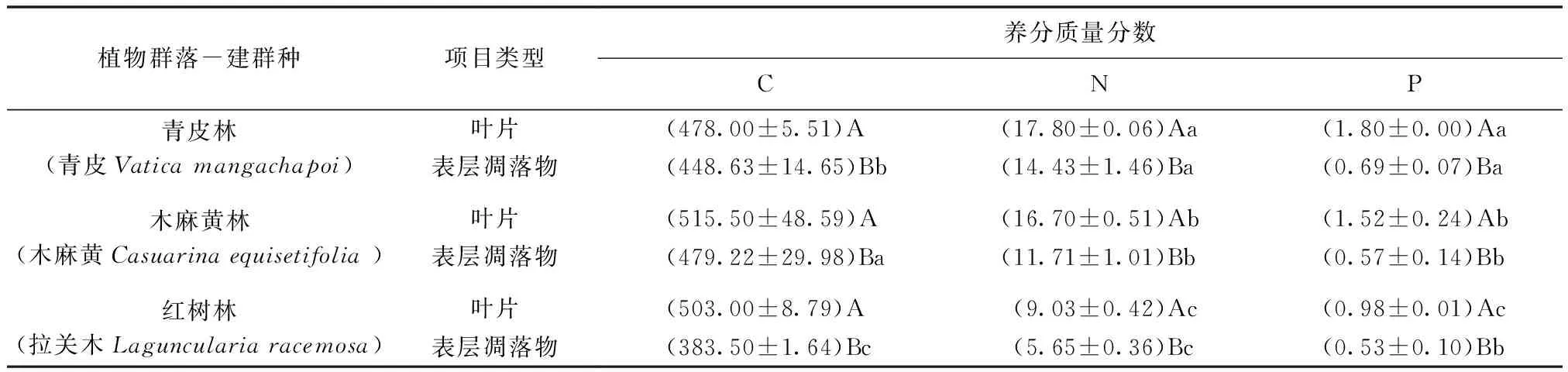
表1 3种植物的叶片与其群落表层凋落物碳氮磷质量分数Tab1.Thenutrient mass fraction in leaf and surface litter of three plants g/kg
养分再吸收效率的大小表示养分再吸收的能力。由表2可知,N的再吸收效率在18.96~34.37%,P的再吸收效率在44.49~62.63%,总体上P的回流率大于N,其中N的回流率表现为拉关木>木麻黄>青皮;P的回流率表现为木麻黄>青皮>拉关木,说明,不同植物叶片在枯萎凋落时,对N和P的利用率存在差异。

表2 3种植物枝叶与表层凋落物的N、P的养分再吸收效率Tab.2 The nutrients resorption efficiencies of N and P in leaf and surface litter of three plants %
2.2 叶片与表层凋落物的生态化学计量特征
从图2可以看出,不同植物群落化学计量比表现为凋落物C∶N,C∶P和N∶P均显著大于植物叶片。不同植物叶片的平均C∶N,C∶P,N∶P值分别为26.82~55.86,265.26~511.80,8.04~16.03,拉关木C∶N和C∶P的值最大,青皮N∶P的值最大。不同植物群落凋落物的C∶N,C∶P,N∶P平均值分别为31.35~68.14,659.22~900.39,11.05~21.93,其中红树林(拉关木)凋落物的C∶N的值最大,木麻黄林凋落物的C∶P和N∶P的值最大。

注:不同大写字母代表同一植物群落(建群种)的叶片与凋落物之间C∶N,C∶P,N∶P值差异显著(P<0.05)。
从图3可以看出,3种植物叶片的C∶N,C∶P和N∶P差异显著(P<0.05);3种植物群落凋落物的C∶N差异显著(P<0.05),木麻黄林凋落物的C∶P显著大于青皮林和红树林,而红树林凋落物的N∶P显著低于青皮林与木麻黄林。
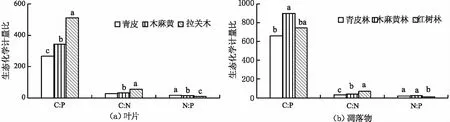
注:不同小写字母代表不同植物群落(建群种)间的凋落物(叶片)生态化学计量比差异显著(P<0.05)。
2.2 叶片与凋落物C,N,P含量及化学计量特征相关性
如表3所示,3个植物叶片的C含量和N,P含量及化学计量比无显著相关性;叶片N含量和P,N∶P呈极显著正相关,和C∶N,C∶P呈极显著负相关;叶片P含量和N∶P呈极显著正相关,和C∶N,C∶P呈极显著负相关;叶片C∶N和C∶P呈极显著正相关,和N∶P呈极显著负相关;叶片C∶P和N∶P呈极显著负相关。
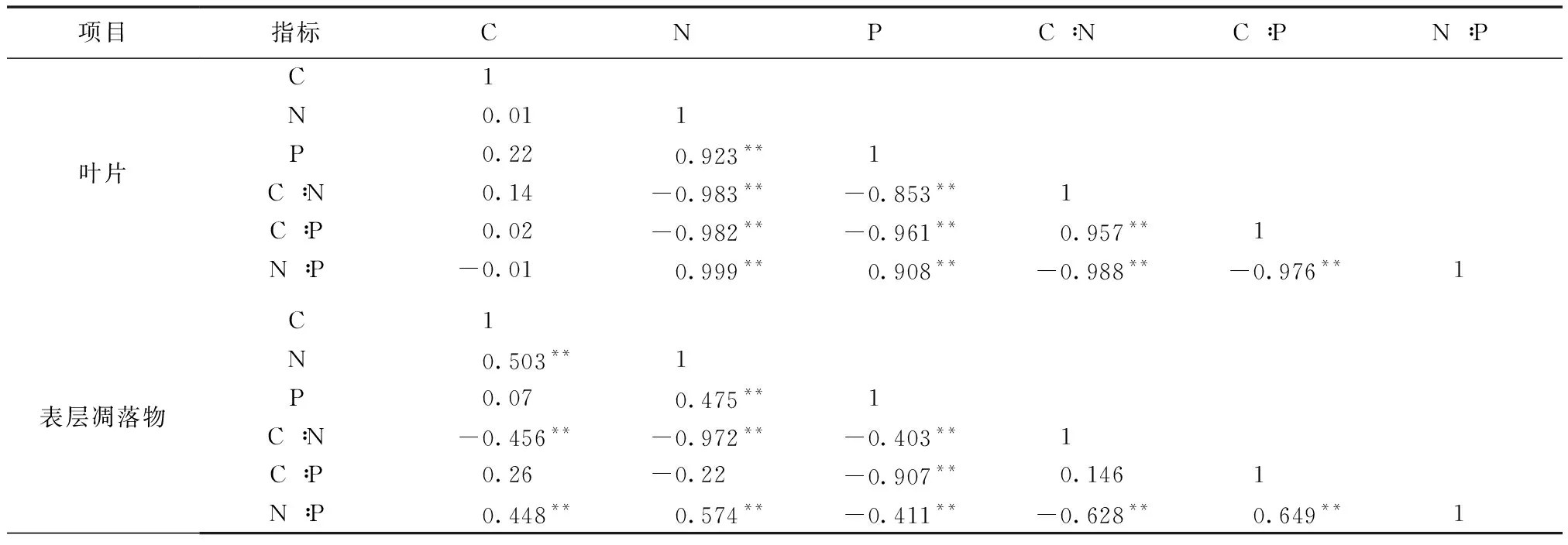
表3 3个植被C,N,P含量及化学计量比之间的相关性Tab.3 Correlation between C,N,P contents and stoichiometry ratio of dominant tree forest
3个植物群落凋落物的C含量和N,N∶P呈极显著正相关,和C∶N呈极显著负相关;凋落物N含量和P,N∶P呈极显著正相关,和C∶N,C∶P呈极显著负相关;凋落物P含量和C∶N,C∶P,N∶P呈极显著负相关;凋落物C∶N和N∶P呈极显著负相关;凋落物C∶P和N∶P呈极显著正相关。
3 讨论与结论
3.3 不同植物叶片与其群落凋落物C,N,P质量分数差异特征
本研究中,木麻黄叶片的C,N和P的平均质量分数分别为515.33,16.70和1.52 g/kg,青皮叶片的C,N和P的平均质量分数分别为478.33,17.83和1.80 g/kg,拉关木叶片的C,N和P的平均质量分数分别为503.00,9.03和0.98 g/kg。其中3种植物叶片的平均C质量分数差异不显著(表1),均高于全球陆生植物叶片平均C质量分数(464.00±32.10 g/kg)[25],说明该区植物C质量分数较高,固C能力较全球陆生植物水平之上。N,P平均质量分数表现为:青皮>木麻黄>拉关木,均低于全球尺度平均水平(N=20.60 g/kg,P=1.99 g/kg)[25],因为海南岛海岸带多为沙地土壤,土壤养分含量较低,从植物根系运送到植物各个器官的养分也相对较少,固N,P的质量分数偏低[9]。3种植物群落的凋落物C,N,P变化规律与叶片保持一致,C,N,P平均质量分数分别为437.12,10.60和0.60 g/kg,均属在全球、国内陆地植物C(371.1~522.1 g/kg),N(8.0~16.6 g/kg),P(0.4~1.3 g/kg)平均质量分数的中偏低水平[26-27],说明该区植物体内C,N,P养分的利用效率不高。李鑫等[28]研究中指出植物枯落物的C,N和P质量分数与植物本身的再吸收能力有关。本研究对比叶片和凋落物养分质量分数发现,3种植物叶片的C,N和P质量分数显著高于群落凋落物,说明植物在生长过程中,叶片更新枯落前养分进行了转移,实现了养分再吸收利用[16]。本研究拉关木N的养分再吸收率较高于木麻黄和青皮,而P的养分再吸收率则是木麻黄和青皮较高,说明相同环境下不同植物的适应能力存在差异,这与树种本身的生长特征有关。
3.3 不同植物叶片与其群落凋落物C∶N,C∶P,N∶P化学计量特征
生态化学计量比在生态系统和功能中是一项重要角色,其中植物体内的化学计量比表征了C积累动态,同时也体现了N和P养分的限制格局[3]。通过植物的C∶N和C∶P比值能够反映C的同化能力,进而反映植物养分利用率,C,N,P之间的比值在一定范围内起到相互平衡和制约的作用,并有利于植物生长[29]。3种植物叶片的C∶N比值范围在26.82~55.86,高于全球陆生植物叶片水平(22.5±10.6)[30-31],说明C的利用效率高,对C的吸收能力较强。C∶P比值范围在265.26~511.80,高于全球陆生植物叶片水平(232±145)[30-31],N∶P比值范围在8.04~16.03,除了拉关木外均高于全球陆生植物叶片水平(12.7±6.82)[30-31],但低于我国陆生植物叶片的N∶P(16.3±9.32)[8],说明青皮和木麻黄对N和P元素的利用率较高,叶片N∶P是植物生态化学计量学与环境变化之间联系的关键点,对外界环境变化具有敏感的响应[32-33]。而3种植物群落凋落物的C∶N比值为31.35~68.14,C∶P比值为659.22~900.39,N∶P比值为11.05~21.93,基本上均低于全球枯落物C∶N值(66.2),C∶P值(3 144)和N∶P值(45.5)[34]。凋落物C∶N,C∶P和N∶P比值均高于植物叶片,这与李明军等[35]的研究结论一致,主要是因为植物在凋落之前通过养分再吸收对N,P进行了重吸收作用。
在植物养分供应和限制方面,前人研究将N∶P比值为16作为养分限制标准,当大于16时界定为受P限制,当小于14时界定为受N限制,介于14~16之间则是共同限制[29]。本研究中拉关木叶片的N∶P比值为8.04,且低于全球水平(13.8),说明倾向于受N限制,这与胡伟芳等[36]的研究结果一致,木麻黄叶片的N∶P比值为15.18,倾向于受N和P的共同限制,而青皮叶片的N∶P比值为16.03,与我国大部分陆生植物结论一致[8],倾向于受P限制。马任甜等[3]研究认为枯落物N∶P是影响枯落物分解和养分归还速率的重要因素之一。本研究3种植物群落凋落物N∶P比值均低于全球水平,且低于临界值25[37],说明3种植物群落的分解倾向于受N限制。
当C∶P等于600∶1时,可作为决定落叶中 P 是净释放还是净固持的分界线[38]。本研究中3种植物群落凋落物的C∶P比值范围在659.22~900.39,均处在分界线之上,认为凋落物的P处于净释放状态,与沈芳芳等[39]研究结论一致。
3.3 不同植物C,N,P化学计量特征与生境的关系
开展生态系统过程中化学元素和环境交互作用的生态化学计量学研究对揭示群落稳定性和养分方面具有重要意义[40]。研究区属于沿海防护基干带,从样点分布图来看(图1),木麻黄林沿海岸线平行分布,属于人工林生态系统,木麻黄生长环境简单,主要受人为影响较大。青皮群落沿木麻黄林靠内陆一侧平行分布,属于天然群落生态系统,青皮生长环境相对复杂。而红树林生长于陆地与海洋交界带的滩涂浅滩,是陆地向海洋过度的特殊生态系统,植物生长受复杂的水文和土壤条件影响[41]。生态系统类型是影响植物养分含量的重要因子,所形成的生境差异性和外部营养元素的供应直接影响植物对养分的吸收,而养分限制状况可通过植物叶片的N∶P值来判断。本研究中3种植物的N∶P在不同生境下存在显著差异,说明不同生境的植物受限制状况不尽相同,其中拉关木的N限制可能同湿地生态系统的高N输入有关[41]。本研究只选择生态系统中3种建群种植物叶片,用氮磷比判断养分限制状况不够准确。此外,在沿海生态脆弱区,容易受到海洋生态系统的影响,不同生态区位受水热条件、土壤养分及自然灾害的干扰不同;其次,人工林和天然林的群落结构所形成的生境受人为干扰强度有别,为准确探析生态位点与生境的关系,需系统分析生态系统的植物-枯落物-土壤的循环关系。

