lncRNA DLX6-AS1在宫颈癌组织中的表达及对宫颈癌细胞增殖和迁移能力的影响
王梦漪,陈莉,卢宏达,雷章
华中科技大学同济医学院附属武汉中心医院,武汉430014
宫颈癌是常见妇科肿瘤,严重威胁女性生命健康。目前宫颈癌的治疗包括手术切除、放疗和化疗,多数患者的长期存活率仍不理想。分子靶向药物在肺癌、乳腺癌等常见肿瘤的治疗中已获得较好的疗效,但宫颈癌的治疗仍缺乏有效的分子靶向药物。长链非编码RNA(lncRNA)是指转录长度超过200个核苷酸的非编码RNA,在细胞生长、分化和运动等各种生理活动中发挥重要作用,其异常表达与脑血管疾病、心血管疾病、糖尿病和肿瘤等疾病密切相关[1~4]。无远端同源框6反义1(DLX6-AS1)是一种定位于7q21.3染色体区域的lncRNA,研究显示,其在肺癌、胃癌、卵巢癌和肝癌等恶性肿瘤中具有促癌基因的作用[5~8]。但其在宫颈癌中的作用少见报道。2017年6月~2019年12月,我们通过检测DLX6-AS1在宫颈癌组织中的表达变化,分析其与患者临床病理特征的关系;进一步干扰宫颈癌Hela细胞中DLX6-AS1的表达,观察其对细胞增殖和迁移能力的影响,并从Wnt/β-catenin信号通路的角度探讨其作用机制。
1 材料与方法
1.1 材料
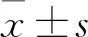
1.1.1 宫颈癌组织标本来源 收集2017年1月~2019年1月在我院行穿刺或手术切除的宫颈癌患者50例,年龄29~72(59.44±18.67)岁。均经病理检查确诊为宫颈癌。患者未行放化疗等治疗,不合并其他肿瘤或影响生存期的全身疾病。收集手术或穿刺标本组织,-80 ℃保存。取同期因良性疾病手术获得的正常宫颈组织30例作为对照组。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.1.2 细胞与试剂 宫颈癌HeLa细胞购自美国ATCC细胞库。DLX6-AS1、内参GAPDH引物购自中国上海捷瑞生物工程有限公司;TRIzol、PrimeScriptTMRT reagent Kit逆转录和SYBR Premix Ex TaqTMPerfect Real time实时荧光定量(qRT-PCR)试剂盒购于日本TaKaRa公司;DMEM-高糖培养基、FBS购于美国Gibco公司;DLX6-AS1干扰RNA购于广州锐博生物科技有限公司;MTS试剂购于美国Promega公司;Transwell购于美国Thermo公司;BCA蛋白浓度检测试剂盒购于美国Thermo公司。
1.2 DLX6-AS1表达检测 采用qRT-PCR法。TRIzol裂解液加入组织中充分裂解,提取总RNA,逆转录为cDNA。以cDNA作为模板,按qRT-PCR试剂盒操作说明书配制反应体系。DLX6-AS1引物:上游5′-AGTTTCTCTCTAGATTGCCTT-3′,下游5′-ATTGACATGTTAGTGCCCTT-3′。GAPDH引物:上游5′-GGGAAATTCAACGGCACAGT-3′,下游 5′-AGATGGTGATGGGCTTCCC-3′。反应条件:95 ℃预变性5 s,95 ℃变性5 s、60 ℃退火30 s,40个循环。上机进行荧光定量PCR。以GAPDH基因为内参,用2-ΔΔCt法计算目的基因的相对表达量。
1.3 干扰DLX6-AS1表达对宫颈癌细胞增殖和迁移能力的影响观察
1.3.1 细胞分组与转染 取HeLa细胞,加入含有10% FBS的DMEM高糖培养基,置于37 ℃、5% CO2培养箱中培养。取对数生长期细胞,加入胰酶消化,按2×105/孔接种至6孔板。待细胞贴壁后,将细胞分为干扰对照组(si-NC组)和si-DLX6-AS1组。按照说明书方法将NC siRNA与脂质体2000混匀后加至si-NC组,DLX6-AS1 siRNA与脂质体2000混匀后加至si-NC组,转染48 h。DLX6-AS1干扰siRNA序列,si-DLX6-AS1#1:5′-GGAAAGAAGAGATTAGAAGAA-3′,si-DLX6-AS1#2:5′-AAGGCCACTGCATATGAGTTG-3′,si-DLX6-AS1#3:5′-GATTTCTAAACCCTGATCATT-3′。
1.3.2 细胞增殖能力观察 采用MTS实验。取对数生长期细胞,加入胰酶消化,以2×103/孔接种至96孔板。待细胞贴壁后,将细胞分为si-NC组和si-DLX6-AS1组,按照“1.3.1”的步骤进行转染,每组设6个复孔。培养48 h后,每孔加入30 μL MTS工作液,37 ℃避光孵育2 h。上酶标仪,于波长490 nm处检测吸光度(A)值。细胞增殖率=(1-si-DLX6-AS1组A值/si-NC组A值)×100%。
1.3.3 细胞迁移能力观察 采用Transwell实验。按照“1.3.2”的步骤进行转染,每组设6个复孔。培养48 h后,胰酶消化收集细胞,洗去FBS,用无血清培养基将细胞制成1×105/mL的细胞悬液,取100 μL接种于Transwell小室的上室,下室加入含10% FBS的500 μL培养基,置于培养箱中。显微镜下观察细胞由上室经微孔膜穿入下室的情况,穿入下室细胞10个左右时终止培养,用PBS洗去微孔膜上室面细胞,甲醇固定,苏木素染色,计数微孔膜下室面细胞数,以细胞数目代表细胞迁移能力。
1.3.4 细胞β-catenin蛋白表达检测 采用Western blotting法。按照“1.3.2”的步骤进行转染,培养48 h后,胰酶消化收集细胞。加入蛋白裂解液完全裂解,4 ℃、14 000 r/min离心20 min,取上清液,BCA试剂盒检测蛋白浓度。行SDS-PAGE电泳分离蛋白,湿转,5% BSA室温封闭1 h,TBST洗涤3次,加入一抗稀释液(稀释比为1∶500)4 ℃孵育过夜。TBST洗涤3次,加入兔二抗(稀释比为1∶10 000)室温孵育2 h,ELC化学发光法曝光条带。采用Image J软件分析蛋白条带灰度值,以目的蛋白与内参蛋白的灰度比值表示目的蛋白的相对表达量。
2 结果
2.1 宫颈癌组织与正常宫颈组织中DLX6-AS1表达比较 宫颈癌组织中DLX6-AS1的相对表达量为2.07±0.83,正常宫颈组织为1.04±0.36,DLX6-AS1在宫颈癌组织中的表达高于正常宫颈组织(t=6.407,P=0.021)。
2.2 不同临床病理特征患者宫颈癌组织中DLX6-AS1表达水平比较 TNM分期Ⅲ~Ⅳ期、淋巴结转移患者宫颈癌组织中DLX6-AS1表达水平高于TNM分期Ⅰ~Ⅱ期、无淋巴结转移患者(P均<0.05),不同年龄、肿瘤直径、组织学分级患者的DLX6-AS1表达水平无统计学差异(P均>0.05)。见表1。

表1 不同临床病理特征患者宫颈癌组织中DLX6-AS1表达水平比较
2.3 干扰DLX6-AS1表达对宫颈癌细胞增殖和迁移能力的影响结果
2.3.1 两组细胞增殖能力比较 si-NC组细胞增殖率为100.14%±1.57%,si-DLX6-AS1组为31.62%±5.45%,si-DLX6-AS1组细胞增殖率较si-NC组降低(t=20.93,P=0.000)。
2.3.2 两组细胞迁移能力比较 si-NC组穿膜细胞数为(112.54±11.57)个,si-DLX6-AS1组为(53.24±8.64)个,si-DLX6-AS1组穿膜细胞数较si-NC组减少(t=7.133,P=0.001)。
2.3.3 两组β-catenin蛋白表达水平比较 si-NC组β-catenin蛋白表达水平为0.78±0.19,si-DLX6-AS1组为0.30±0.13。si-DLX6-AS1组β-catenin蛋白表达较si-NC组减少(t=3.611,P=0.015)。
3 讨论
宫颈癌是严重威胁女性生命健康的恶性肿瘤之一。宫颈癌发病的危险因素包括人乳头瘤病毒感染、性生活过早、吸烟以及卫生条件差等,因此宫颈癌发病率及病死率存在地域差异,发展中国家发病率的病死率普遍高于发达国家。研究显示,宫颈癌早期未发生侵袭转移时,手术切除的预后较好,然而由于早期症状隐匿,患者确诊时常为晚期,失去手术机会。肿瘤的发生机制错综复杂,目前宫颈癌的发病机制仍然未明确,因此探索宫颈癌发病的潜在分子机制有助于为宫颈癌的治疗提供新的策略。新近研究表明,lncRNA参与调控转录激活、转录干扰、核内转运、染色质修饰和X染色体沉默等各种重要的生理过程[9],其参与调控肿瘤发生发展的作用已成为研究热点。DLX基因家族是远端无果蝇基因的脊椎动物同源物,该家族包含参与细胞分化和形态发生的同源框转录因子家族,分为DLX1~6,在人类实体瘤和血液学肿瘤中均发现DLX家族表达失调[10]。DLX6-AS1是DLX基因家族成员的调节因子,与肺癌、胃癌、卵巢癌、肝癌等肿瘤密切相关[5~8],但DLX6-AS1与宫颈癌的关系目前尚不清楚。本研究结果显示,DLX6-AS1在宫颈癌组织中的表达显著高于正常宫颈组织,提示其在宫颈癌中高表达可能具有致癌性。
研究显示,DLX6-AS1在非小细胞肺癌中高表达与患者的肿瘤直径和晚期临床分期有关[5],在胃癌中表达增加与患者晚期临床分期、淋巴结转移和远处转移显著相关[6],在上皮性卵巢癌中表达上调与患者FIGO分期和淋巴结转移显著相关[7]。本研究结果显示,DLX6-AS1在宫颈癌组织中的表达水平与患者TNM分期和淋巴结转移相关,而与患者年龄、肿瘤直径、组织学分级无关。提示DLX6-AS1可能促进宫颈癌的发生发展。
Sun等[5]报道,下调DLX6-AS1表达可抑制非小细胞肺癌的细胞增殖、克隆形成以及迁移、侵袭能力。DLX6-AS1的沉默显示抑制肝癌肿瘤球形成、集落形成、增殖和肿瘤形成能力[8]。本研究采用siRNA技术干扰HeLa细胞中DLX6-AS1的表达,发现细胞增殖和迁移能力下降,表明DLX6-AS1在宫颈癌生长和转移过程中具有重要作用。
恶性增殖和转移是肿瘤的两大重要特征,MAPK、PI3K/AKT、Wnt/β-catenin通路是调控肿瘤增殖和转移的重要信号通路[11~13]。Yang等[14]报道,DLX6-AS1可通过miR-497-5p/FZD4/FZD6/Wnt/β-catenin信号通路促进胰腺癌发生。本研究结果显示,抑制Hela细胞中DLX6-AS1表达后,Wnt信号通路关键分子β-catenin蛋白的表达水平降低。表明DLX6-AS1可能通过调控Wnt/β-catenin信号通路参与宫颈癌的发生发展。
综上所述,DLX6-AS1在宫颈癌组织中表达升高,与宫颈癌的发生发展密切相关;干扰DLX6-AS1表达可能通过调控Wnt/β-catenin信号通路抑制宫颈癌细胞的增殖和侵袭。

