澳洲坚果实时荧光定量PCR分析中内参基因的筛选
杨倩 杨子平 周娅丽 陈东泉 刘恒

摘 要:澳洲坚果是重要的热区经济作物,目前国内外尚无关于澳洲坚果实时荧光定量PCR分析内参基因的报道。选择合适的内参基因是提高实时荧光定量PCR分析准确性的先决条件。为筛选澳洲坚果实时定量PCR最适内参基因,以澳洲坚果的根、茎、叶、果皮、果仁为材料,利用实时荧光定量PCR技术,对18S rRNA,Actin,CYP,EF1a,EF1b,GAPDH,MDH,TUBa,TUBb,UBQ,UBC等11个常用的内参基因在澳洲坚果不同组织中的表达稳定性进行了分析。geNorm软件分析的最适内参基因数目为2,最稳定内参组合为MDH和EF1b,TUBa基因的稳定性最差。BestKeeper分析结果认为,MDH基因表达最稳定,EF1b次之,与geNorm结果一致。NormFinder软件稳定性分析显示,GAPDH最稳定,其次是CYP基因;TUBa基因表达最不稳定。ΔCt算法结果表明,18S基因表达最稳定,其次是GAPDH基因,MDH和EF1b排第3和第4。RefFinder综合排序为:MDH>18S>GADPH>EF1b>CYP>UBC>EF1a>Actin>TUBb>UBQ> TUBa。因此,MDH基因在澳洲坚果不同组织中表达最稳定,初步确认可以作为实时荧光定量PCR分析的校正内参基因,在澳洲坚果的基因表达模式分析中具有重要意义。
关键词:澳洲坚果;内参基因;实时荧光定量PCR;稳定性分析
中图分类号:S664.9 文献标识码:A
Abstract: Macadamia nut is an important economics crop in subtropical areas of China. The selection of a suitable reference gene is an important prerequisite for successful gene expression analysis by real-time fluorescence quantitative PCR (RT-qPCR). In order to select the appropriate reference genes, we investigated the expression stability of 11 candidate genes (18S rRNA, Actin, CYP, EF1a, EF1b, GAPDH, MDH, TUBa, TUBb, UBQ, UBC) in RT-qPCR experiments in different tissues, including kernel, peel, roots, stem, leaf from Macadamia with geNorm, NormFinder, BestKeeper, ΔCt, RefFinder program software packages. As determined by geNorm, MDH/EF1b were the most stable reference genes, TUBa was the least stable gene. BestKeeper revealed that MDH was the most stables reference gene, and EF1b ranked the second. The rank in BestKeeper was similarly with that in geNorm. The result by NormFinder showed GAPDH was the most stable gene, CYP ranks the second, the least stable gene was TUBa. ΔCt algorithm demonstrated that18S was the most stable gene, GAPDH ranks the second, MDH and EF1b ranked the third and fourth. To obtain a consensus result of the most stable reference genes according to the RefFinder approach, the geometric mean of the four algorithms corresponding rankings for each candidate gene were calculated: MDH>18S>GADPH>EF1b>CYP>UBC>EF1a>Actin>TUBb>UBQ>TUBa. The result showed that MDH was the most suitable reference gene for macadamia in different tissues.
Keywords: Macadamia integrifolia; reference genes; real-time fluorescence quantitative PCR; stability analysis
DOI: 10.3969/j.issn.1000-2561.2020.08.001
澳洲堅果(Macadamia integrifolia),又称夏威夷果、澳洲胡桃、昆士兰栗,属山龙眼科(Pro teaceae)澳洲坚果属(Macadamia F. Muell)常绿乔木果树,原产于澳大利亚昆士兰州东南部和新南威尔士东北部沿岸的亚热带雨林地区[1]。澳洲坚果果实营养丰富,风味独特,被誉为“坚果之王”,具有一定的经济价值[2-3]。近年来,我国云南、广西、广东、贵州等南方各省(区)大面积推广引种试种澳洲坚果优良品种,种植面积达16万hm2,占世界种植面积的61.05%(数据来源:中国农业农村部南亚热带作物办公室)。虽然我国澳洲坚果的果仁产量逐渐递增,但是全球市场的需求量更大,因此澳洲坚果产业具有广阔的发展前景[4]。
实时荧光定量PCR技术(real-time fluorescent quantitative polymerase chain reaction, qRT-PCR)的原理是在PCR反应体系中加入荧光化学物质,荧光物质能够与PCR产物反应,随着PCR产物不断增加,荧光信号也成比例增强,所以PCR每个循环结束时的荧光值代表了PCR产物量的变化。利用qRT-PCR对目的基因的相对表达量进行计算时,需要以管家基因的表达量作为标准进行校正和均一化。理想状态下,所选内参基因在不同的处理条件下、不同组织器官中、细胞的不同发育时期中都能稳定表达,而且其表达水平与目的基因表达水平相近[5]。然而,不断有研究表明,实际实验过程中并不存在任何一种内参基因能够在任何条件、任何细胞类型和组织都能够稳定表达[6],因此直接使用未经筛选的内参基因,会导致实验数据出现偏差,影响目的基因表达水平结果的可靠性,所以有必要对内参基因进行筛选。
近年来,随着分子生物学研究手段逐渐被应用到各个研究领域,分子生物学研究中的基因表达和调控机制研究成为热点。基因的表达分析需要内参基因进行归一化,而目前关于澳洲坚果内参基因的研究还未见报道。Actin是常见的内参基因,是微丝的结构成分,也是细胞骨架的主要成分。在鱼的研究中发现,环境中的激素刺激会影响Actin基因的表达稳定性[7]。18S rRNA是真核生物体内含量最多的核糖体RNA,常被用来做内参基因,但是在杨树的不同发育时期,18S rRNA的表达稳定性最差,并不适合作为内参基因[8]。GAPDH是糖酵解、糖异生及光合作用碳固定循环过程中的关键酶。但是在猪的不同组织中的表达水平和稳定性表达变化都很大,是最不稳定的内参基因[9]。苹果酸脱氢酶(malate dehydrogenase, MDH)是一类广泛存在动植物中的酶,参与植物体的多个代谢途径,研究证实细胞质苹果酸脱氢酶基因也可作内参基因[10]。延伸因子(elongation factor, eEF)是一类多功能调控蛋白,可以催化氨基酸链在核糖体上的延伸,从而调控相关蛋白的合成[11-13]。在植物中,真核生物延伸因子1(eEF1)家族包含eEF1A和eEF1B蛋白[14-16],延伸因子(elongation factor, eEF)家族基因常被选作内参基因[14,17]。因此,本研究以澳洲坚果根、茎、叶、果皮、果仁为材料,对18S rRNA,Actin,亲环蛋白(CYP),EF1a和EF1b,GADPH,MDH,微管蛋白(TUBa和TUBb),多聚泛素酶(UBQ),泛素连接蛋白(UBC)等11个常用内参基因分别用geNorm[18]、NormFinder[19]、BestKeeper[20]和ΔCt法等不同算法进行表达稳定性分析,最后根据RefFinder[21]综合分析筛选最适合的内参基因。本实验目的是筛选出澳洲坚果不同组织器官中表达稳定的内参基因,以期为澳洲坚果的基因表达调控相关研究提供合适的内参基因。
1 材料与方法
1.1 植物材料
选取‘南亚1号澳洲坚果品种作为实验材料,分别摘取成熟的果实、幼嫩叶片、枝条和根,清洗干净后用液氮速冻,80 ℃保存备用。
1.2 内参基因的选择和引物设计
在植物实时荧光定量PCR研究中多采用肌动蛋白(Actin)、18S核糖体RNA(18S rRNA),甘油醛-3-磷酸脱氢酶(GADPH)等常用看家基因作为内参基因进行定量。本研究拟选择11个常用内参基因(18S rRNA, Actin, CYP, EF1a, EF1b, GAPDH, MDH, TUBa, TUBb, UBC, UBQ)作为候选内参基因。这11个候选内参基因cDNA序列部分已经从澳洲坚果的转录组数据获得。登录实时定量引物设计网站,在候选内参基因的保守区域,使用在线软件设计特异性荧光定量引物。网站地址:https://sg.idtdna.com/pages/products/qpcr-and- pcr/custom-primers,每个基因设计5对引物。引物由北京六合华大基因科技有限公司合成。
1.3 不同组织RNA的提取和cDNA的合成
澳洲坚果叶片总RNA的提取按照Plant Total RNA Isolation Kit Plus(FOREGENE Biotech, Chengdu, China)方法进行。mRNA使用凝胶电泳检测,Nanodrop测定浓度。反转录按照NOVA All-in-one First-Strand Synthesis Master Mix(Yugong Biolabs, Jiangsu, China)操作。反应体系20 μL,以1000 ng RNA为模板,反转录获得单链cDNA。反转录程序为:55 ℃ 60 min;85 ℃ 1 min。
1.4 标准曲线的制备
实时荧光定量PCR数据采集在罗氏(Roche)Light Cycler 480Ⅱ上完成,荧光试剂盒选用Taq SYBR Green qPCR Premix ROXⅠ(NOVA)。将根、茎、叶、果皮、果仁等5个不同组织的样品等体积混合,5倍梯度稀释,分别以50 、51 、52、53、54 、55作为模板制备标准曲線,每个样品重复3次。3次生物学重复。
RT-PCR扩增体系:SYBR Premix ExTaqⅡ(2),10 L;PCR Forward Primer(10 mol/L),1 L;PCR Reverse Primer(10 mol/L),1 L;cDNA,1 L;dH2O,7 L;总体积20 L。标准曲线和斜率(slope)由稀释倍数和荧光定量Cp值在Excel中计算得出。扩增效率计算公式:E=(5[1/slope]1)100%。
PCR扩增程序:94 ℃预变性3 min;然后94 ℃变性10 s,58 ℃退火30 s,72 ℃延伸10 s,45个循环;在每个循环结束后进行荧光信号的采集,所有循环结束后进行溶解曲线分析(65~95 ℃)。
1.5 数据分析
实时荧光定量PCR数值可利用Light Cycler 480Ⅱ(Roche)的分析软件直接获得Cp值。分别采用geNorm、NormFinder、BestKeeper、ΔCt算法4个不同的程序,比较分析澳洲坚果中候选内参基因在不同组织中的表达稳定性,最后通过RefFinder计算出较为一致的稳定内参基因。
2 结果与分析
2.1 澳洲坚果RNA的分离与纯化和内参引物的筛选
1.2%琼脂糖凝胶电泳检测提取RNA结果显示,不同器官组织的RNA电泳条带清晰,28S rRNA带亮度约为18S rRNA的1.5~2倍(图1),无拖尾,表明RNA的完整性良好,纯度较高,可用于后续实验。根据溶解曲线和荧光定量PCR的Cp值对每个候选内参基因的5对引物进行筛选,选取质量最好的一对常用内参基因引物(表1)用于后续实验。
2.2 内参基因的实时荧光定量PCR标准曲线和熔解曲线
将澳洲坚果根、茎、叶、果皮、果仁等样品cDNA等量混合,依次连续5倍稀释为50,51,52,53,54,55共6个梯度,随后以6个不同浓度的混合样品为模板分别对11个候选内参基因进行qRT-PCR。在Excel数据处理软件中,以实时荧光定量PCR反应获得的Cp值为纵坐标,5的稀释倍数为横坐标,自动生成标准曲线。结果显示:除18S(R2=0.963)外,其余候选内参基因标准曲线的相关系数(R2)都在0.99附近(表1),扩增效率为91.9%~102.5%,说明引物、模板、实时荧光定量PCR反应体系和程序满足实时荧光定量PCR分析的要求(90%~105%)。
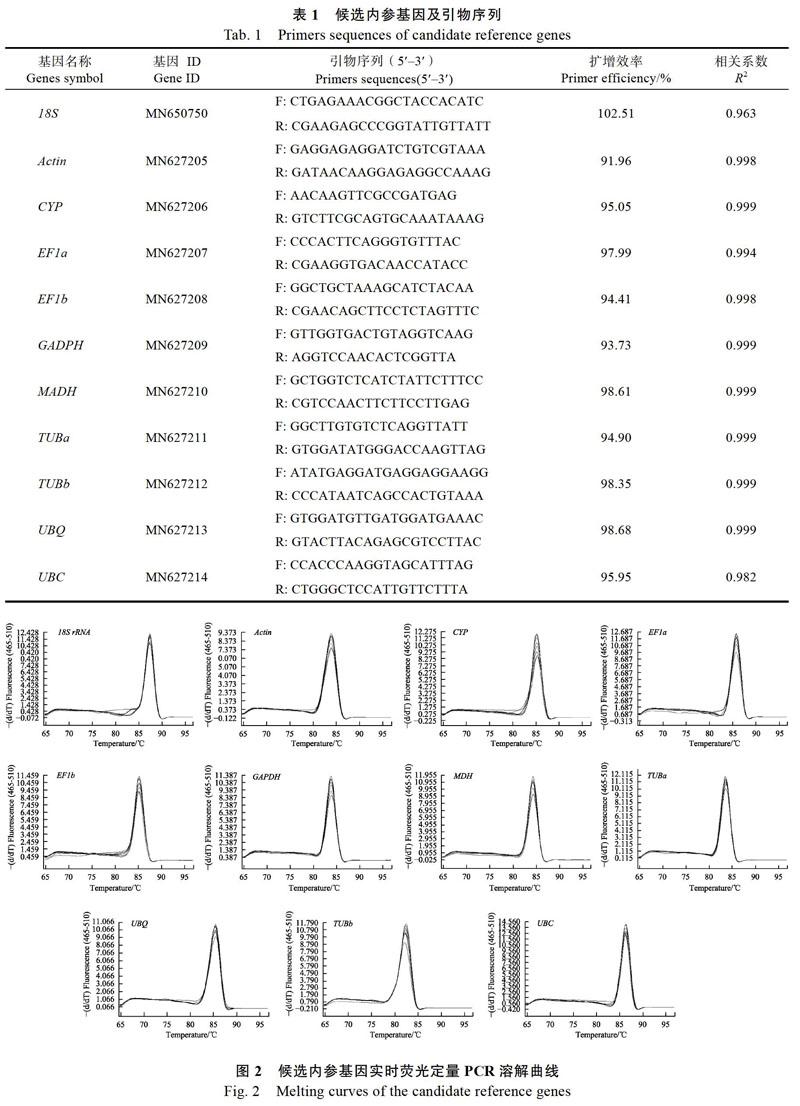
实时荧光定量PCR产物具有荧光信号,随着温度升高双链DNA降解,这个过程的荧光信号被采集生成熔解曲线,可以用来确定PCR的反应产物。熔解曲线分析通常是在qRT-PCR扩增程序的所有循环结束后,设置一个由65 ℃上升至95 ℃的反应程序,每升温0.5 ℃测定1次荧光信号,共采集60次。荧光定量熔解曲线数据显示,11个候选内参基因的都为单一锐锋,不存在非特异扩增,Tm值为80~85 ℃(图2),说明筛选的这些候选内参基因的引物特异性强,符合RT-qPCR分析的要求。
2.3 不同组织内参基因的筛选
以澳洲坚果根、茎、叶、果仁、果皮不同组织的cDNA为模板,对11个候选内参基因进行实时荧光定量PCR分析。
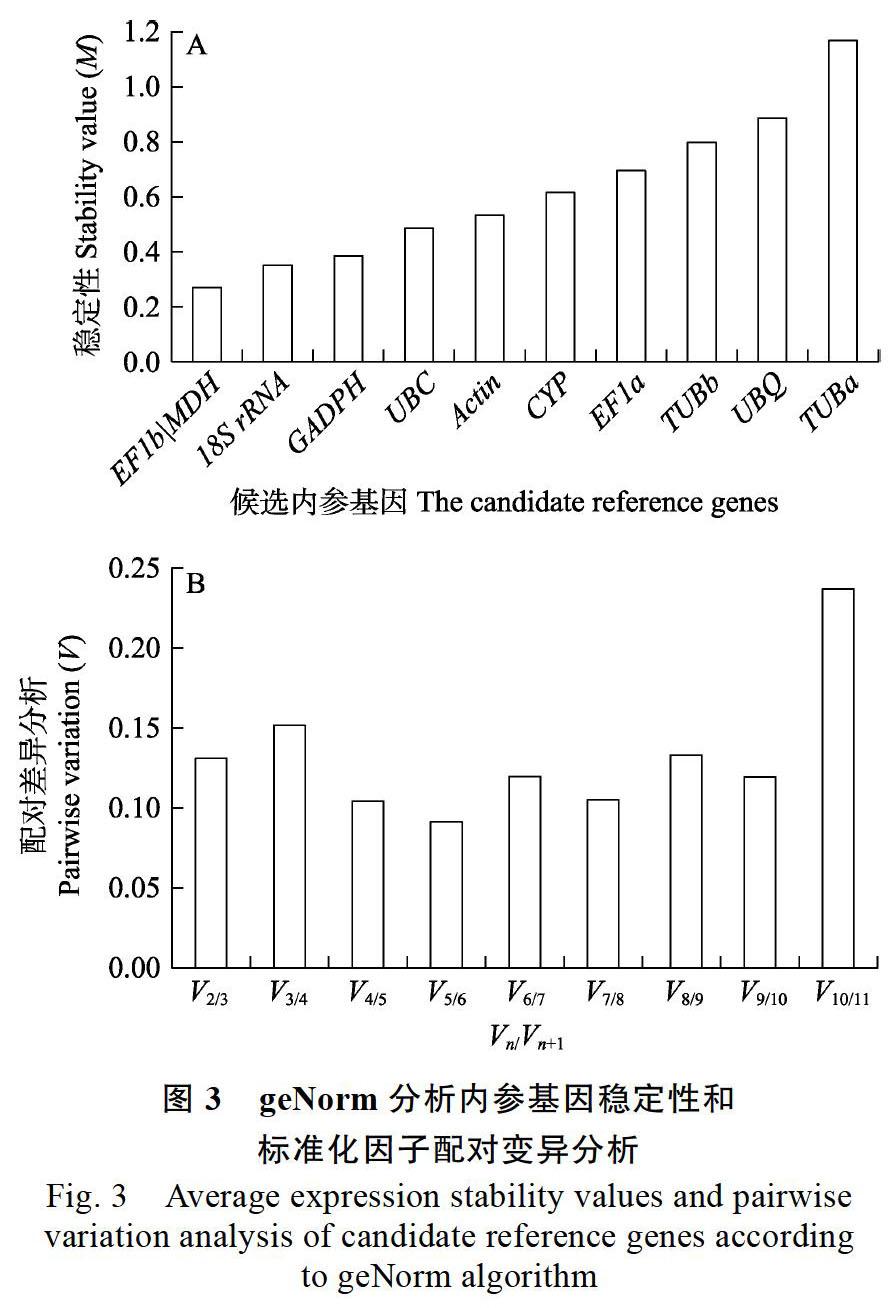
2.3.1 geNorm分析澳洲坚果不同组织中候选内参基因的稳定性 geNorm软件算法利用M值和标准化因子的配对变异V值确定候选内参基因的稳定性和适合内参的数量。M值的阈值为1.5,小于1.5说明该基因适合做内参,反之则不适合做内参;且M值越小则内参基因的表达就越稳定。由图3可见,本实验中11个候选内参基因的M值均小于1.5,说明所有基因的表达都比较稳定。其中EF1b和MDH的M值最低(图3A),其他基因的表达稳定性依次为18S>GAPDH>UBC> Actin>CYP>EF1a>TUBb>UBQ>TUBa,TUBa的M值最高。因此,geNorm软件分析认为EF1b、MDH的稳定性最好,TUBa的稳定性最差。geNorm程序还可计算引入1个新基因后标准化因子的配对变异V值,并根据Vn/Vn+1值来确定所需最适内参基因的数目。实验数据显示,在11个检测的候选内参基因中,V2/3的比值为0.131,小于推荐值0.15,说明本次实验供试的澳洲坚果不同组织器官中,最适合的内参基因数目是2(图3B)。因此,根据geNorm分析认为,EF1b和MDH为最稳定内参基因。
2.3.2 ΔCt算法分析澳洲坚果不同组织内参基因的稳定性 ΔCt算法根据计算的标准偏差数值(STDEV)确定基因表达的稳定性[22],标准偏差越小则基因越稳定。使用ΔCt分析结果显示(表2),18S为最稳定内参基因,其次为GAPDH基因,MDH和EF1b基因排在中間,TUBa为最不稳定基因。
2.3.3 NormFinder分析澳洲坚果不同组织中候选内参基因的稳定性 NormFinder程序的稳定性分析同geNorm分析一样,也是基于候选内参基因的相对定量表达数据,稳定性数值越小,基因表达越稳定[23]。NormFinder算法不但可以估计候选内参基因的整体表达差异,还可以计算样品组间的变异,但是只能筛选出一个最合适的内参基因[24]。本研究使用NormFinder程序分析候选内参基因的表达稳定性排序见表2。分析认为,GAPDH为最稳定基因,其次是CYP、EF1a和18S,然后才是MDH和EF1b,TUBa为最不稳定基因。
2.3.4 BestKeeper分析澳洲坚果不同组织中内参基因的稳定性 BestKeeper程序是以每个样品的原始Cp值进行配对相关分析。计算Cp值得到标准差(SD)、变异系数(CV)、配对相关系数(correlation coefficient),如果SD和CV越小,该内参基因越稳定,反之稳定性越差。一般认为,候选内参基因SD小于1的被认为是最稳定表达,由表3可见,除TUBa(2.38)和UBQ(1.108)基因外,本研究中其他的9个候选内参基因SD值都小于1,说明这些基因的表达都比较稳定。MDH和EF1b的SD分别为0.361和0.411,这个结果与geNorm的分析结果一致。
2.3.5 RefFinder综合排序分析 由于各个算法原理不同,得到最稳定基因的结果差异较大。本实验使用RefFinder程序对上述4种算法的排序结果进行综合分析[21],数值越小,则基因越稳定;反之稳定性越差。结果见表3,MDH表达最稳定,其次为18S rRNA,TUBa基因的稳定性最差。
2.4 澳洲坚果SAD基因的表达分析和内参基因的验证
植物硬脂酰-酰基载体蛋白脱饱和酶(SAD)是一种质体中存在的催化硬脂酸烃链脱饱和合成油酸的可溶性酶,是植物中形成不饱和脂肪酸的前提。已有研究表明,澳洲坚果SAD能以18∶0-ACP和16∶0-ACP为底物催化生成单不饱和脂肪酸——油酸和棕榈油酸,并且对底物18∶0- ACP的酶反应速率高于底物16∶0-ACP[25]。为了分析SAD基因在澳洲坚果不同组织中的表达情况,分别用MDH和18S rRNA(最稳定内参)、TUBa基因(最不稳定内参)作为参照基因归一化定量。结果显示,以MDH和18S rRNA为参照时,基因在各个组中的表达量呈下降的趋势;以TUBa基因作为参照时茎和叶片中基因表达上调,果皮和果仁中基因上调表达,而UBQ则相反;因此,如果采用UBQ和TUBa作为内参基因,那么则会得到完全相反的定量结果(图4)。结果表明,选择合适的内参基因直接影响基因的表达准确性,在本实验中,MDH基因最适合作为澳洲坚果不同组织中进行实时荧光定量PCR分析的内参基因。
3 讨论与结论
使用实时荧光定量PCR技术分析基因的表达情况是理解生物学调控机制研究中常用的重要手段。但实际情况是,常用内参基因的表达在不同组织器官中、不同处理条件下、不同类型细胞中和不同发育阶段中并不是恒定表达,也会随着条件改变[26]。因此,为了获得更为准确的定量结果,通常会选择一个或多个持家基因作为内参基因对目的基因的表达量进行校准和标准化,故选择合适的内参基因是获得准确定量结果的关键[27]。
在本研究中,选择了传统的11个常用看家基因,包括18S rRNA,Actin,CYP,EF1a,EF1b,GAPDH,MDH,TUBa,TUBb,UBQ,UBC等基因,并利用geNorm、NormFinder、BestKeeper和ΔCt算法分析这些候选内参基因在不同组织器官中的表达稳定性。由于各个程序的计算方法原理不同,各软件得出的稳定性结果基本一致,但仍旧有些差异。geNorm分析程序根据各个候选内参基因在每个样品中表达情况的相似度进行排序,不考虑其他内参基因,故不适于区分表达模式类似的基因。而NormFinder是以组内方差与组间方差进行排序,综合考虑其他基因之后,对候选内参基因进行打分。本试验对4种算法数据比较发现:geNorm和BestKeeper软件得到的内参基因的稳定性排序基本一致,MDH和EF1b表达最稳定,TUBa表达最不稳定。而NormFinder的分析认为:GAPDH的表达最稳定,TUBa表达最不稳定,MDH和EF1b的稳定性排第5和第6,与geNorm和BestKeeper分析结果差异较大。ΔCt算法分析结果表明,18S rRNA基因表达最稳定,其次是GAPDH,MDH和EF1b的稳定性排第3和第4。最后,我们通过几何平均算法对上述4种结果综合排序:MDH>18S rRNA>GADPH> EF1b>CYP>UBC>EF1a>Actin>TUBb>UBQ>TUBa。因此,在本研究中,可以初步选择MDH作为澳洲坚果实根、茎、叶、果皮、果仁不同组织实时荧光定量PCR分析较为稳定的内参基因。
魏永赞等[28]认为,β-Actin在荔枝果实发育不同阶段和外源生长调节剂处理下表达稳定性较好,但是,在114份香蕉品种中比较发现Actin表达最不稳定,在本实验中,Actin基因的表达没有MDH基因稳定。苹果酸脱氢酶(malate dehydrogenase, MDH)是一类广泛存在动植物中的酶,参与植物体的多个代谢途径,根据辅酶专一性、亚细胞定位和生理功能。在小麦的研究中发现:TaMDH基因在不同物种间高度保守,推测cyMDH可能由一个共同的祖先进化而来,并且可能属于管家基因[29-30]。在黄花大苞姜花粉母细胞不同的发育时期进行qRT-PCR研究发现:MDH的表达最稳定,可以作为内参基因[31]。本研究结果表明:MDH基因在澳洲坚果不同组织中的表达稳定性最好,适合做内参基因对澳洲坚果不同组织中的基因进行归一化分析。
MiSAD基因是澳洲堅果的合成和积累不饱和脂肪酸的关键基因,本研究分别以最稳定基因MDH和最不稳定基因TUBa分别作为内参对MiSAD基因进行归一化分析。研究结果表明:MDH和18S rRNA为参照时,基因在各个组中的表达量呈下降的趋势;以TUBa基因作为参照时,在茎叶中呈上调表达,果皮和果仁中则表达量降低,而UBQ则相反;如果采用UBQ和TUBa作为内参基因,那么则会得到完全相反的定量结果。因此,如果在进行基因表达分析前,没有对候选内参基因进行表达稳定性分析,盲目使用内参基因,会导致试验结果不准确。由于不同的环境条件,如生物胁迫和非生物胁迫都会影响内参基因表达的稳定性,接下来将进一步对不同处理条件下,澳洲坚果中内参基因的表达稳定性进行深入研究。
参考文献
Russ Stephenson. Macadamia: Domestication and commercialization[J]. Chronica Horticulture, 2005, 45(2): 11-15.
Manohar L G, Robert J B, Ron B H W. Macadamia nut consumption lowers plasma total and LDL cholesterol level in hypercholesterolemic men[J]. The Journal of Nutrition, 2003, 133(4): 1060-1063.
Duxbury D D. Lipid scientists shake healthy macadamia nut tree[J]. Food Processing, 2003(6): 83.
杜 杉. 云南已成澳洲坚果种植老大——第八届国际澳洲坚果大会将首次走进中国[J]. 时代金融, 2018(19): 52-54.
Dheda K, Huggett J F, Bustin S A, et al. Validation of housekeeping genes for normalizing RNA expression in real-time PCR[J]. Biotechniques, 2004, 37(4): 112-119.
孫美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量PCR分析中内参基因的选择[J]. 植物学报, 2010, 45(5): 579-587.
Amy L F, Charles R T. Appropriate “housekeeping” genes for use in expression profiling the effect of environmental estrogens in fish[J]. BMC Molecular Biology, 2007(8): 10.
Gutierrez L, Mauriat M, Guénin S, et al. The lack of a systematic validation of reference genes: a serious pitfall undervalued in reverse transcription polymerase chain reaction (RT-PCR) analysis in plants[J]. Plant Biotechnology Journal, 2008, 6(6): 609-618.
Nygard A B, J?rgensen C B, Cirera S, et al. Selection of reference genes for gene expression studies in pig tissues using SYBR green qPCR[J]. BMC Molecular Biology, 2007(8): 67.
Tomaz T, Bagard M, Pracharoenwattana I, et al. Mitochondrial malate dehydrogenase lowers leaf respiration and alters photorespiration and plant growth in Arabidopsis[J]. Plant Physiology, 2010, 154(3): 1143-1157.
杨彩霞, 雒 军, 王引权, 等. 当归延伸因子AsEF-1β基因的克隆及胁迫应答分析[J]. 西北植物学报, 2019, 39(8): 1371-1378.
王 芳, 董美玲, 董 乐, 等. 蓖麻延伸因子基因的克隆与表达分析[J]. 核农学报, 2019, 33(3): 464-472.
JeeNa H, Chang-Sik O, Byoung-Cheorl K. Translation elongation factor 1B (eEF1B) is an essential host factor for Tobacco mosaic virus infection in plants[J]. Virology, 2013, 439(2): 105-114.
常鹏杰, 申亚梅, 董 彬, 等. 玉兰盐胁迫下qRT-PCR分析中内参基因的筛选[J]. 农业生物技术学报, 2018, 26(9): 1611-1620.
朱海生, 刘建汀, 温文旭, 等. 印度南瓜延伸因子基因CmEF1a的克隆与分析[J]. 核农学报, 2019, 33(6): 1096-1104.
陈晓荣, 陈昶旭, 施力铭, 等. 植物翻译延伸因子eEF1A的研究进展[J]. 农技服务, 2019, 36(2): 64-67.
袁 伟, 万红建, 杨悦俭. 植物实时荧光定量PCR内参基因的特点及选择[J]. 植物学报, 2012, 47(4): 427-436.
Vandesompele J, De Preter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 2002, 3(7): 1-11.
Andersen C L, Jensen J L, Rbtoft T F. Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets[J]. Cancer Research, 2004, 64 (15): 5245-5250.
Pfaffl M W, Tichopad A, Prgomet C, et al. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper-Excel-based tool using pair-wise correlations[J]. Biotechnology Letters, 2004, 26(6): 509-515.
Xie F, Xiao P, Chen D, et al. miRDeepFinder: a miRNA analysis tool for deep sequencing of plant small RNAs[J]. Plant Molecular Biology, 2012, 80(1): 75-84.
Silver N, Best S, Jiang J. Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR[J]. BMC Molecular Biology, 2006, 7(33): 1-9.
Fan C, Ma J, Guo Q. Selection of reference genes for quantitative real-time PCR in bamboo (Phyllostachys edulis)[J]. PLoS One, 2013(8): e56573.
Pérez S, Royo L J, Astudillo A, et al. Identifying the most suitable endogenous control for determining gene expression in hearts from organ donors[J]. BMC Molecular Biology, 2007, 8(1): 1-23.
Rodríguez M F, Sánchez-García A, Salas J J, et al. Characterization of soluble acyl-ACP desaturases from Camelina sativa, Macadamia tetraphylla and Dolichandra unguis-cati[J]. Journal of Plant Physiology, 2015, 178: 35-42.
Chervoneva I, Li Y, Schulz S, et al. Selection of optimal reference genes for normalization in quantitative RT-PCR[J]. BMC Bioinformatics, 2010, 11(1): 1-15.
Suzuki T, Higgins P J, Crawford D R. Reviews-control selection for RNA quantitation[J]. Biotechniques, 2000, 29(2): 332-337.
魏永贊, 赖 彪, 胡福初, 等. 用于荔枝qPCR分析的内参基因克隆及稳定性分析[J]. 华南农业大学学报, 2012, 33(3): 301-306.
Chen L, Zhong H Y, Kuang J F, et al. Validation of reference genes for RT-qPCR studies of gene expression in banana fruit under different experimental conditions[J]. Planta, 2011, 234(2): 377-390.
Ding Y, Ma Q H. Characterization of a cytosolic malate dehydrogenase cDNA which encodes an isozyme toward oxaloacetate reduction in wheat[J]. Biochimie, 2004, 86(8): 509-518.
张俊平, 王英强. 黄花大苞姜花药发育qRT-PCR内参基因筛选[J]. 广西植物, 2018, 38(1): 76-83.

