透明质酸微阵列结构的构建及其生物相容性研究
常铃雪, 何宏燕, 金莉莉, 刘昌胜
(华东理工大学材料科学与工程学院,教育部医用生物材料工程研究中心,上海 200237)
随着组织工程与再生医学的发展,模仿细胞外基质的结构、制备仿生微结构引起了科研人员的广泛关注[1-4]。许多学者致力于研究植入材料的表面特性与细胞的相互作用,通过图案化表面的可控制备,实现对细胞的形貌、增殖、迁移、分化和基因表达的调控[5]。在骨修复中植入材料表面的微纳结构[6]特性(表面纹理、几何形状、空间位置和高度)的不同是影响成骨细胞生物学行为的关键因素之一,可以调节成骨细胞向特定谱系进行分化,指导干细胞成骨分化和作为支撑结构维持新骨的长入[2,7-9]。Chang 等[10]研究发现骨间充质干细胞(BMSCs)的成骨分化能力在微孔表面上有所提高,微孔表面增强了细胞的黏着斑和肌动蛋白的结合能力。Wang 等[11]证实在深沟槽基底上培养的BMSCs 的成骨分化能力明显高于浅表面上的成骨分化能力。Dalby等[12]认为纳米结构(直径为120 nm)可以诱导人骨间充质干细胞(hBMSCs)在体外产生骨矿物质和成骨分化。赵等[13]发现微孔和纳米管相结合的分级微/拓扑结构对BMSCs 成骨分化能力有着显著的影响。由此可见,微结构采用的基底材料和结构特性在调控 BMSCs 的生物学响应中尤为重要。然而,这些微结构的基底材料(例如聚二甲基硅氧烷[14])通常生物活性不足。除了微结构的特性之外,基底材料本身的理化特性对干细胞的影响也不容忽视。为了更好地调节干细胞的生物学行为和满足骨组织修复的需要,有必要对制备生物活性好、结构精准的微阵列结构用于 BMSCs 的生物学行为进行研究。
透明质酸(HA)作为细胞外基质的基本成分之一,具有良好的亲水性和生物活性,在维持细胞外微环境、软骨修复、伤口愈合等方面有着广泛的应用[15,16],尤其是它可以作为药物的载体以提高药物的生物利用度。为了得到具有一定机械强度和生物相容性的 HA,本文用己二酸二酰肼(ADH)和N′-(乙基亚胺基亚甲基)-N, N-二甲基-1,3-丙二胺(EDCI)与 HA 交联成膜。通过调节ADH 和EDCI 的质量分数(8.3%~16.7%),研究不同配比对薄膜的表观结构、膨胀系数、降解行为以及材料相容性的影响。对反应体系进行配比优化后,选取合适的配比和聚二甲基硅氧烷(PDMS)软光刻技术进行微阵列结构的精准制备和特性评价。
1 实验部分
1.1 原料和试剂
HA:纯度97%,麦克林公司;己二酸二酰肼:纯度>99.0%,北京伊诺凯科技公司;EDCI:纯度97%,上海泰坦科技公司;PDMS:SKYLARD184,道康宁公司;胎牛血清(FBS)、鹰最小基本培养基(MEM)、无钙镁改良MEM 培养基、青链霉素混合液、胰蛋白酶、噻唑蓝(MTT)试剂:美国Gibco 公司;大鼠骨髓间充质干细胞(rBMSCs):上海斯莱克公司。
1.2 HA 水凝胶的制备
将HA 粉末配成w=0.5% 的HA 水溶液,于4 ℃保存,溶胀1 d 后,将不同量的ADH 缓慢加入HA 溶液,之后加入EDCI 快速搅拌,反应中用0.1 mol/L 的盐酸维持pH≈4.75;反应后调节体系pH=7.0,将反应产物在0.1 mol/L 的NaCl 溶液中透析1 d,接着用超纯水透析2 d。提纯后液体直接倒入培养皿中,放入37 ℃恒温箱内干燥成膜;将HA 干膜浸泡于PBS 缓冲液中2 h,溶胀平衡后放入4 ℃冰箱保存备用。实验中控制HA、ADH 与EDCI 的质量比(mHA∶mADH∶mEDCI)分别为10∶1∶1、8∶1∶1、6∶1∶1 和4∶1∶1,相应的凝胶样品分别标记为S1、S2、S3、S4。
1.3 HA 薄膜微阵列结构的制备工艺
HA 薄膜 微阵列结构的制备工艺如图1 所示。首先采用软光刻技术制备表面具有微米点阵列的硅片母板,用75%(体积分数)的乙醇溶液超声清洗干燥后,使用商用SKYLARD184 进行软刻胶工艺对其进行复制,得到与母板互补的微阵列结构;然后将带有微阵列结构的PDMS 表面进行等离子亲水处理,使得HA 溶液能够充分润湿PDMS 表面的微阵列结构,最后通过溶剂挥发成膜法得到带有微阵列结构的HA 薄膜。
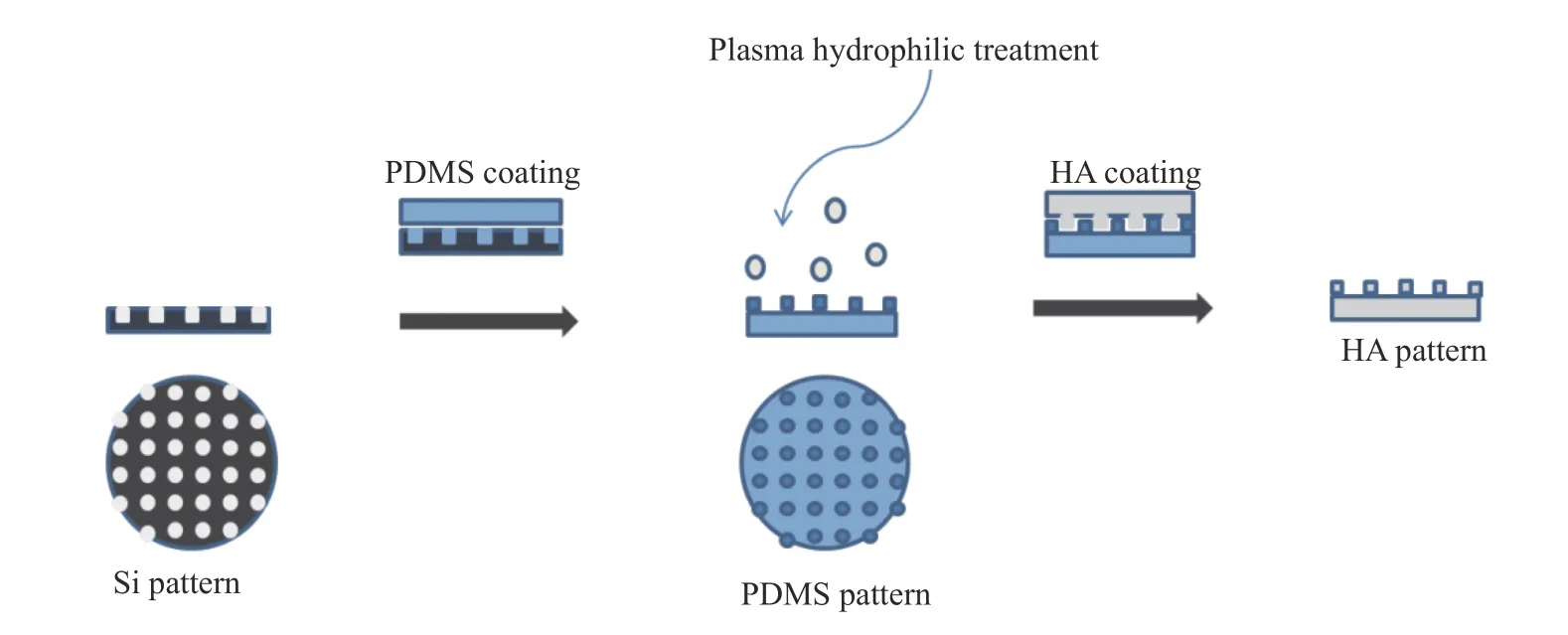
图1 HA 薄膜微阵列结构的制备工艺Fig.1 Preparation process of HA films with well-defined micropatterned surfaces
1.4 HA 薄膜的理化特性表征
傅里叶变换红外光谱仪(美国赛默飞世尔科技公司):HA 薄膜在-20 ℃冷冻过夜后进行冻干处理,得到海绵结构的HA 材料,取适量HA 与KBr 充分混合研磨后采取压片制样,扫描波长4 000~500 cm-1;场发射扫描电子显微镜(日本日立公司,S-4800 型):HA 薄膜冻干处理后固定于样品台表面,喷金处理后,裁剪成4 mm×4 mm 方块,用导电胶固定于SEM 样品台表面,设定时间为60 s 进行喷金,置于样品仓,设置加速电压为20 kV;恒温震荡箱(常州澳华仪器有限公司,SHA-B 型)及电子天平(上海良平仪器仪表有限公司,FA2104 型):将HA 薄膜真空干燥称重(m0),以1∶10 的质量比将HA 薄膜浸泡于PBS 缓冲液中,置于37 ℃温和震荡(80 r/min)3、7、10、14 d 后,将HA 薄膜真空干燥24 h 后称重(mi),通过计算得到剩余量(R),R 可用来评价凝胶薄膜的降解行为。

倒置生物显微镜(上海长方光学仪器公司,XSP-17C 型):选用直径10 μm、间距为15 μm 的模板制备了4种配方的HA 薄膜,采用倒置生物显微镜对HA 凝胶微结构进行观察,并用纳米测量技术对表面微结构尺寸进行测量。
1.5 细胞生物学性能研究
rBMSCs 细胞提取培养工艺如下:选用4 周龄、无特定病原体(SPF)级80~100 g 的雄性SD 大鼠(上海杰思捷实验动物有限公司),提取股骨和胫骨细胞。将rBMSCs 添加到FBS(φ=10%)、青霉素/链霉素双抗(φ=1%)的α-MEM 培养基中,接种于25 cm2的细胞培养瓶中,在37 ℃、5% (体积分数)CO2、湿度95%的恒温培养箱中培养。
对不同交联度的HA 凝胶进行生物相容性MTT 检测,每组设置3 个平行样。具体操作步骤如下:选用rBMSC 为细胞模型,以每孔2×103个的接种密度接种于96 孔板中37 ℃培养24 h 后,加入等量的凝胶样品(S1~S4)于孔板中继续培养;在1、3、7 d 后,避光条件下每孔加入30 μL MTT 工作液(5 mg/mL),放入37 ℃培养箱继续孵育4 h;小心吸去孔板中上层溶液,每孔加入100 μL 二甲亚砜(DMSO),37 ℃恒温震荡溶解15 min;使用MK3 酶标仪(Thermo Fisher)在波长492 nm 下测量其透光率(OD)值。MTT 法也用于评级不同微阵列结构表面对rBMSCs 体外增殖的影响,将HA 薄膜平铺于48 孔板中,每孔加入1×104个细胞,30 min 后每孔加入1 mL 培养基。置于37 ℃恒温培养箱中培养1、3、7 d 后,进行MTT 测试。
2 结果与讨论
2.1 HA 凝胶的FT-IR 分析
图2 示出了配比不同的HA 凝胶和未交联HA的红外光谱。如图所示,相比于未交联的HA,交联HA 在3 402cm-1处 的―OH 伸 缩 振 动 峰 和1 407、1 618 cm-1处羧酸盐的强特征吸收峰消失,意味着羧酸官能团的消失,即证明了交联反应的发生;交联样品在1 610 cm-1处均出现弱吸收峰,说明生成了―CO―NHR。可见,使用ADH 对HA 进行交联后,HA 中的羟基和羧酸的羰基吸收峰消失,取而代之的是酰胺吸收峰,表明ADH 的氨基与HA 的羧基生成了酰胺,成功实现了HA 的交联;随着ADH 和EDCI 用量的增加,薄膜中酰胺吸收峰逐渐变强,说明 HA 的交联程度增加。
2.2 HA 薄膜的表面形貌
图3显示了HA薄膜的表面形貌。当mHA∶mADH∶mEDCI为10∶1∶1 时,虽然HA 薄膜表面呈现连续结构,但表面粗糙不平;随着ADH 和EDCI 含量的增加,薄膜表面的粗糙程度降低,当mHA∶mADH∶mEDCI为4∶1∶1 时,HA 薄膜表面局部区域较为光滑,但是表面起伏较大。
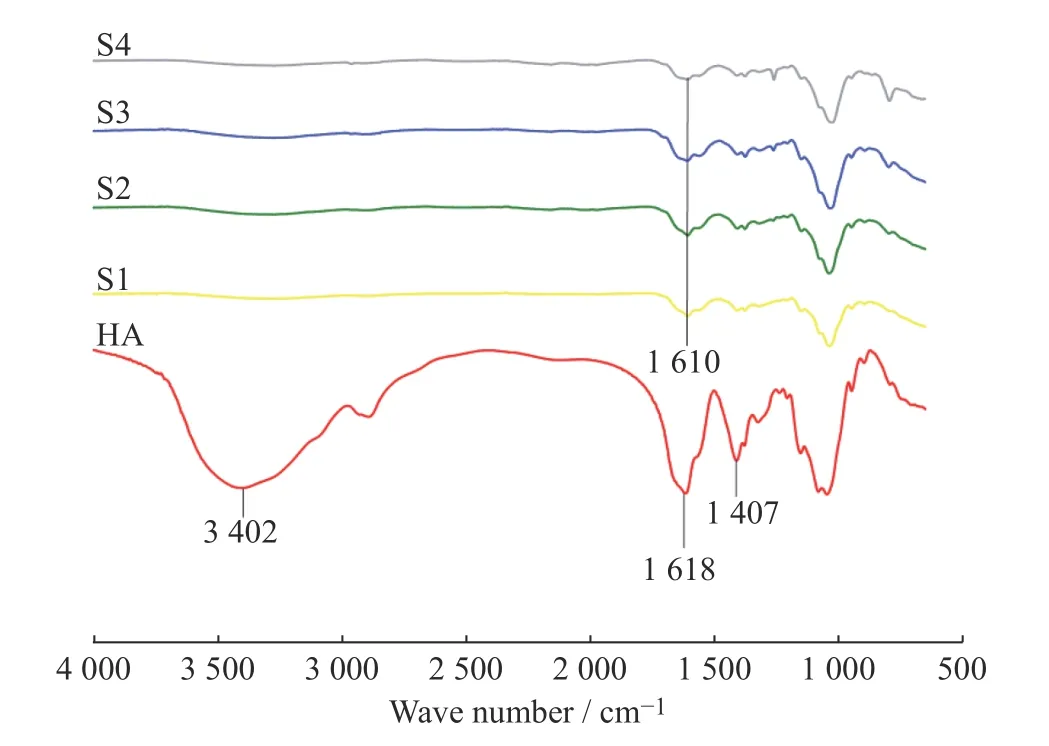
图2 HA 凝胶的红外谱图Fig.2 FT-IR spectra of HA gels

图3 不同配比的HA 薄膜的表面形貌Fig.3 SEM images of HA films with different reagent ratios
为了观察HA 凝胶的内部交联结构,将透析纯化后的溶液直接倒入玻璃培养皿,放入-20 ℃冰箱冷冻12 h,取出再冻干操作24 h 后进行表面形貌观察(图4)。如图所示,4 种HA 交联凝胶内部呈现多孔结构,其形成原因主要在于冻干过程中凝胶内部的水分升华。当mHA∶mADH∶mEDCI=10∶1∶1 时,样品的孔径约为850 μm,孔洞较为松散;随着ADH 和EDCI 用量的增加,凝胶内部的孔洞直径逐渐变小,孔洞结构越来越紧密;当mHA∶mADH∶mEDCI=4∶1∶1 时,相较于其他凝胶,样品内部孔径最小,椭圆形长径约为350 μm,孔洞结构最为紧密。可见,ADH 和EDCI 用量的增加提高了HA 的交联程度,内部孔径变小,结构趋向紧密,这与HA 交联薄膜表面的展示结果相符。材料内部的孔径结构也会影响HA 凝胶薄膜的膨胀特性,为了得到尺寸可控的HA 微阵列结构,非常有必要对薄膜的膨胀特性进行评价。

图4 不同配比的HA 凝胶内部结构的SEM 图Fig.4 SEM images of internal structures of HA gels with different reagent ratios
综上所述,随着ADH 和EDCI 用量的增加,交联程度增加,凝胶内部孔径有着逐渐变小的趋势,结构更加紧密。由此可以推断,当凝胶溶胀平衡后,材料的膨胀程度不同,孔径较小的HA 薄膜将会有较小的体积膨胀系数,制成的微阵列结构在溶胀平衡后也没有明显的变形和损坏。
2.3 HA 薄膜的降解行为
图5 示出了HA 薄膜的降解曲线,所有样品均表现出比较稳定的降解速率。随着ADH 和EDCI 用量的增加,薄膜的交联程度增加,材料的孔径变小,降解速率随之减慢。14 d 时,mHA∶mADH∶mEDCI为10∶1∶1 的薄膜几乎全部降解,mHA∶mADH∶mEDCI为4∶1∶1 的薄膜仅降解了约30%。由此可见,通过改变HA 薄膜的交联程度可以有效地调控薄膜的降解行为。
2.4 HA 凝胶的生物相容性评价
实验样品分为5 组,不同配比的HA 凝胶的生物活性示于图6。随着ADH 和EDCI 用量的增加,细胞活性有所降低。虽然各组样品的细胞总数均低于空白对照组(Control),但仍具有较好的细胞活性,HA 凝胶本身未表现出显著的细胞毒性,故均可用于之后的细胞实验。
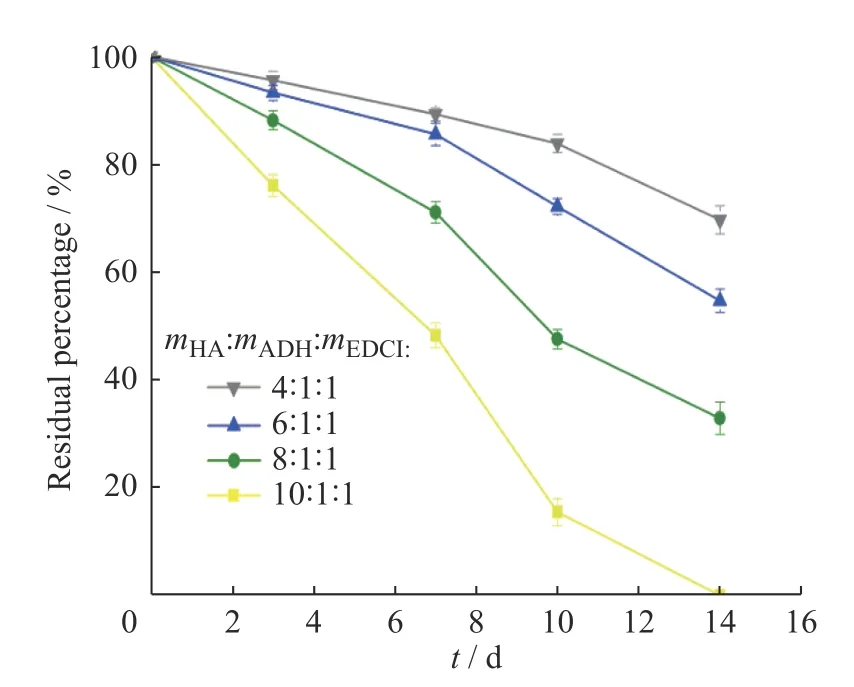
图5 不同配比的HA 薄膜的降解行为Fig.5 Degradation of HA films with different reagent ratios

图6 不同配比的HA 凝胶的细胞活性Fig.6 Cell viability of HA gels with different reagent ratios
2.5 表面具有微孔结构的HA 薄膜的制备与评价
硅模板的表面设计:4 种不同尺寸的微孔结构,孔径(d)分别为10、30、40、100 μm,相应微孔结构的间距(w)分别为15、10、40、20 μm,深度均为20 μm。HA 薄膜表面形貌如图7 所示。HA 薄膜表面具有与硅片母板表面相同的微孔结构,但由于模板的复制操作误差和材料特性,最后制作完成得到的HA 薄膜表面结构可能会发生变化。由于在制样过程中,薄膜表面微结构并非肉眼可见,截面脆断时无法保证断裂面全部为凹槽直径部位,所以断面图只用来观测凹槽深度,并不用来测量直径及凹槽间距。
以图7(d)图案为例,比较ADH-HA 干膜表面与硅设计模板、PDMS 模板的微孔结构差异。硅设计模板的孔径为100 μm、间距为20 μm、深度为20 μm,复制后PDMS 的间距略有减小(15 μm),孔径和深度基本维持不变(参见图8)。HA 干膜的圆柱凹槽直径和凹槽之间的间距与硅片母板没有显著差异,但凹槽深度仅为5 μm。这是因为HA 交联溶液具有较大的黏度,用等离子体对PDMS 表面进行处理,尽管HA 溶液完全浸入PDMS 表面微结构当中,制得的HA 薄膜失水冻干后用于SEM 观察,冻干制样过程对其结构有重要的影响,尤其是厚度方向,因此,HA 干膜的凹槽深度仅为5 μm 左右。
HA 干膜溶胀后,不同交联程度的HA 薄膜的表观形貌和溶胀系数如图9 所示,所用的PDMS 子板图案为孔径10 μm、间距15 μm。如图9(a)所示,HA 干膜的孔径约为10 μm,随着ADH 与EDCI 含量的减少,溶胀后微孔的直径逐渐增大,S4、S3、S2 的孔径分别为32、40、50 μm,S1 甚至变形到在显微镜下几乎观测不到微孔结构。图9(b)中的相对直径比更为直观地证实了交联剂含量对HA 薄膜溶胀特性的影响规律:交联剂含量越少,交联程度越小,微孔的变形越大,HA 凝胶的膨胀系数越大。为了构建变形小的微米图案,选用S4 用于不同微孔结构的制备。

图7 HA 薄膜表面的不同尺寸微孔结构的SEM 图:(a)孔径30 μm、间距10 μm,(b)孔径40 μm、间距40 μm,(c)孔径10 μm、间距15 μm,(d)孔径100 μm、间距20 μm,(e)c 图案的截面图,(f)d 图案的断面图Fig.7 SEM images of microwells structure on HA films with different dimensions: (a) d=30 μm、w=10 μm, (b) d=40 μm、w=40 μm,(c) d=10 μm、w=15 μm, (d) d=100 μm、w=20 μm, (e) & (f) are section structures of (c) & (d)

图8 PDMS 微结构的SEM 图片Fig.8 SEM images of PDMS microstructures
2.6 HA 薄膜表面的微孔结构对细胞增殖的影响
为了研究表面微结构尺寸和图案对成骨细胞的生物学行为的影响,选取了尺寸不同、图案密度不同的4组样品(样品 A: 孔径96 μm、间距32 μm;样品 B: 孔径128 μm、间距128 μm;样品 C: 孔径32 μm、间距48 μm;样品 D: 孔径320 μm、间距64 μm)进行研究,以未图案化的HA 平膜(Flat)作为参比样品,选用rBMSC 为细胞模型,通过MTT 法对细胞活性进行了测定(图10)。
MTT 实验结果表明,各组微结构材料表面的细胞总数均不低于对照组。与未图案化的HA 薄膜表面相比,随着凹槽直径的减小,细胞增殖能力呈现上升趋势。小尺寸HA 薄膜(样品 C)表面细胞活性最大,说明小尺度的凹槽结构对细胞增殖有着显著的促进作用。令人意外的是,具有较大微米尺寸的样品 B 相比于样品A,也有着较好地促进细胞增殖能力,这可能与rBMSCs细胞铺展后的直径有关(一般为120 μm 左右),与样品B 的微图案直径相近。
2.7 ADH-HA 微结构表面的骨诱导性碱性磷酸酶(ALP)活性比较
本实验测定rBMSC 在一系列不同微结构ADH-HA 薄膜上的ALP 活性,以评价微结构对成骨诱导能力的影响。
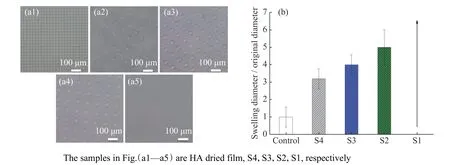
图9 HA 薄膜在PBS 溶液中(a)溶胀结构观察和(b)溶胀系数Fig.9 Swelling properties of HA films with well-defined microstructure (a) observed by microscopy and (b) swelling coefficient
如图11 所示,使用总蛋白量进行均一化后,不同天数各组薄膜上的细胞ALP 活性趋势大致相近。与未图案化的 HA 薄膜相比,随着圆形凹槽直径的减小,细胞ALP 活性水平逐渐上升。rBMSCs 在小微米结构(d=32 μm)ADH-HA 薄膜上有着更高的成骨ALP 活性;其他3 组微米结构表面的rBMSCs 的成骨活性略有提高。
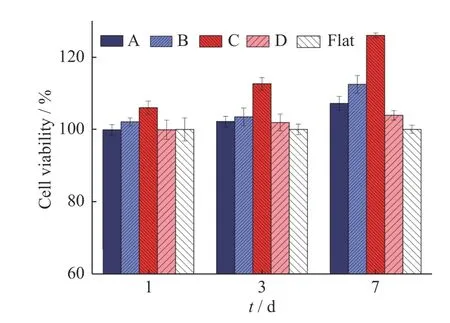
图10 微阵列结构对rBMSCs 细胞活性的影响:(A)孔径96 μm、间距32 μm;(B)孔径128 μm、间距128 μm;(C)孔 径32 μm、间 距48 μm;(D)孔 径320 μm、间 距64 μmFig.10 Effect of cell viability of rBMSCs on the microstructures with different dimensions: (A) d=96 μm、w=32 μm; (B)d=128 μm、w=128 μm; (C) d=32 μm、w=48 μm; (D)d=320 μm、w=64 μm
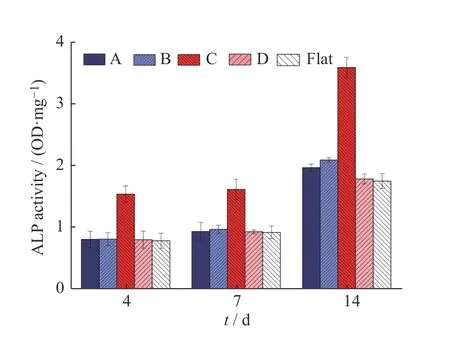
图11 微阵列结构对rBMSCs 的ALP 活性影响:(A)孔径96 μm、间距32 μm;(B)孔径128 μm、间距128 μm;(C)孔径32 μm、间距48 μm;(D)孔径320 μm、间距64 μmFig.11 Effect of ALP activities of rBMSCs cultured on different microstructure systems: (A) d=96 μm、w=32 μm; (B)d=128 μm、w=128 μm; (C) d=32 μm、w=48 μm; (D)d=320 μm、w=64 μm
3 结 论
(1)选用可降解高分子HA 作为基底材料,采用交联剂ADH 和EDCI 成功地交联成膜。
(2)利用PDMS 软刻胶技术和溶剂挥发法制备了表面具有微阵列结构的HA 凝胶薄膜,微阵列结构完整、均匀,微米结构精准、可控。
(3)与平滑的HA 薄膜相比,尺寸较大的微米图案对细胞的增殖没有显著影响,而尺寸较小的微米结构(d=32 μm)可以明显促进rBMSCs 的增殖。
(4)与其他尺寸图案相比,rBMSCs 在小微米结构(d=32 μm)ADH-HA 薄膜上具有更高的成骨ALP 活性。
(5)材料的仿生特征和优异的理化性质在刺激细胞行为和引导组织再生方面发挥着关键作用,然而,表面微结构形貌引导的骨间充质干细胞分化的潜在机制仍不够明确,材料特性/微阵列结构与细胞生物学的关系尚需进一步探索。

