过表达miR-31对结肠炎模型小鼠TLR4/NF-κB信号通路及凋亡蛋白的调控*
刘凯丽,都新新,张文琴,吴亚俐,王 茜,王春芳,崔香丽
(山西医科大学生理学系,太原 030001)
炎症性肠病 (inflammatory bowel disease,IBD) 包括两种慢性的炎症性疾病:溃疡性结肠炎和克罗恩病,其发病率和患病率在全球范围内均呈上升趋势,IBD发病机制复杂,病因尚不清楚,目前已有的治疗方法仍存在问题,因此阐明IBD的潜在的机制非常重要[1],而细胞凋亡和炎症是结肠炎发病机理中最重要的两个因素[2]。Toll样受体(toll-like receptors, TLR4)是跨膜蛋白家族受体,在非特异性或先天性免疫防御中起关键作用[3],TLR4是TLRs家族中的一个关键元素。有研究表明,经外部刺激后,生物体启动先天免疫反应,上调TLR4表达,TLR4激活增加NF-κB的表达,并诱导一系列炎症因子的表达[4]。因此,TLR4 / NF-κB信号转导通路可能是炎症发展的重要途径。
miRNA是一类具有22~24个核苷酸的小非编码RNA,有研究表明,miRNAs是炎症信号通路的重要介导因子和调节因子,参与包括IBD在内的多种炎症性疾病的发病机制[5]。本实验室前期通过基因芯片技术检测出miR-31在溃疡性结肠炎病人的结肠炎组织和正常组织中有显著差异性表达,因此本文使用miR-31转基因小鼠,通过DSS诱发肠炎模型,初步探究miR-31过表达对溃疡性结肠炎中TLR4/NF-κB信号通路和凋亡相关蛋白的影响,为溃疡性结肠炎的治疗提供新的思路和治疗靶点。
1 材料与方法
1.1 动物与试剂
SPF级miR-31转基因小鼠和非转基因对照FVB小鼠30只,6~8周龄,由山西医科大学实验动物中心提供,体重为20~30 g,雌雄不限。人的肠上皮细胞系HCT 116购自中国科学院细胞库。DSS购自美国MP Biomedicals公司。高铁饲料购自北京华阜康生物公司。转染试剂购自德国Qiagen公司。micrONTM miRNA mimic、micrOFFTM miRNA inhibitor购自锐博生物公司。免疫组化试剂盒购自北京中杉金桥生物公司。TUNEL细胞凋亡检测试剂盒购自凯基生物公司。NF-κB p65兔单克隆抗体、HRP 标记马抗鼠 IgG 二抗购自于美国Cell Signaling公司。Bax兔单克隆抗体、Bcl-2兔单克隆抗体、TLR4兔多克隆抗体购自美国Abcam公司。β-actin鼠单克隆一抗购自武汉Proteintech公司。HRP 标记羊抗兔 IgG 二抗购自北京全式金公司。
1.2 小鼠DSS诱导结肠炎模型的建立
14只FVB非转基因小鼠随机分为control组(n=6),DSS组(n=8),16只FVB miR-31转基因小鼠随机分为miR-31过表达组(n=8),miR-31过表达+DSS组(n=8),造模开始前称重并标记所有小鼠。造模周期为5周,造模期间小鼠均进食高铁饲料并饮用无菌水或1%DSS水,具体为control组和miR-31过表达组造模期间均饮用正常无菌水,DSS组和miR-31+DSS组小鼠第一周饮用1%DSS水,第二周饮用正常无菌水,第三周饮用1%DSS水,且每隔2 d换一次1%DSS水,确保饮用水的干净与充足,如此循环5周后造模完成,然后小鼠称重,安乐死,摘取小鼠结肠纵向切开,4%的多聚甲醛固定24 h后卷成瑞士卷,随后进行石蜡包埋、切片和HE染色[6]。结肠组织出现明显缩短、粘膜增厚,结肠切片HE染色出现杯状细胞和隐窝缺失及淋巴结肿大为模型成功。剩余结肠组织立即-80℃保存备用。通过Western blot和IHC检测NF-κB、TLR4、Bax和Bcl-2蛋白的表达以及通过TUNEL检测小鼠结肠组织细胞的凋亡。
1.3 细胞培养和转染
人肠上皮细胞系HCT 116细胞用含有10%的胎牛血清和含1%双抗的DMEM培养基于37℃并含有5% CO2的孵箱中进行培育,取对数生长期的细胞在六孔板中进行接种,并分别标记control组、mimic组和inhibitor组,每组均设置三个复孔,然后用脂质体转染的方法瞬时转染hsa-miR-31-5p的mimic和inhibitor,十字摇匀后将细胞置于CO2孵箱中孵育,48 h后收取细胞并通过Western blot检测NF-κB、TLR4蛋白的表达。
1.4 Western blot检测NF-κB p65、TLR4、Bax、Bcl-2蛋白的表达
收取六孔板中已经转染好的细胞或取小鼠结肠组织约50 mg,使用RIPA/PMSF裂解液裂解蛋白,BCA法测定蛋白浓度。总蛋白20 μg进行SDS-PAGE电泳,随后使用半干法将蛋白从凝胶转移到PVDF膜上,然后用5%的脱脂奶粉室温封闭1.5 h,TBST洗膜后分别用NF-κB p65一抗(1∶1 000)、TLR4一抗(1∶500)、Bax一抗(1∶2 000)、Bcl-2(1∶2 000)、β-actin一抗(1∶5 000)等于摇床室温孵育1 h后4℃过夜,HRP标记羊抗兔IgG(1∶2 000)或兔抗小鼠IgG(1∶2 000)二抗,室温孵育1 h,洗膜,将膜放入ChemicDocTMMP,滴加ECL发光液进行显影。Image Lab分析Western blot条带的灰度值,计算目的蛋白在各组的表达量。
1.5 免疫组织化学(IHC)法检测NF-κB p65、TLR4、Bax、Bcl-2蛋白的表达
将5 μm的结肠组织石蜡切片置于65℃烘箱中烤30 min,常规脱蜡复水,PBS冲洗后用EDTA抗原修复液在98℃水浴锅中修复抗原20 min,PBS冲洗,滴加内源性过氧化物酶阻断剂消除内源性过氧化物酶,分别加NF-κB一抗(1∶600)、TLR4一抗(1∶500)、Bax一抗(1∶500)、Bcl-2一抗(1∶500),阴性对照用PBS代替一抗,放入4℃冰箱过夜。加反应增强液室温避光反应30 min,PBS冲洗后滴加增强酶标山羊抗小鼠/兔IgG聚合物,室温孵育1 h,DAB染色,之后进行苏木素复染,脱水透明,最后中性树脂封片。将染色强度和染色范围计数结果的乘积作为免疫组化的评分结果[7]。
1.6 原位末端转移酶 ( TUNEL) 法检测小鼠结肠组织细胞凋亡
将5 μm的结肠组织石蜡切片置于65℃烘箱中烤30 min,常规脱蜡复水,EDTA抗原修复液在98℃水浴锅中修复抗原20 min,Proteinase K工作液37℃进行通透,内源性过氧化物酶阻断剂避光封闭,阳性片滴加DNase Ⅰ反应30 min,滴加TdT酶反应液避光孵育(阴性片不计入),Streptavidin-HRP避光反应,DAB显色,苏木素复染,脱水透明,最后中性树脂封片。凋亡细胞核呈棕褐色颗粒,每张片子随机选取五个区域,在高倍镜(×400)下计算每个区域的凋亡细胞数和细胞总数。凋亡细胞指数(apoptotic index,AI)=视野中凋亡细胞数/视野中细胞总数。
1.7 统计学处理
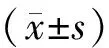
2 结果
2.1 Western blot检测miR-31对小鼠结肠组织中NF-κB和TLR4蛋白表达的影响
Western blot结果表明,与control组相比,DSS组NF-κB (P<0.01,图1A,表1)、TLR4(P<0.01,图1B,表1)蛋白表达显著升高,miR-31组NF-κB(P<0.05,图1A,表1)、TLR4(P<0.05,图1B,表1)蛋白表达也显著升高;同样的与DSS组相比,miR-31+DSS组NF-κB(P<0.01,图1A,表1)、TLR4(P< 0.01,图1B,表1)蛋白的表达也显著升高。说明miR-31对结肠炎的促进作用与TLR4/NF-κB通路有关。
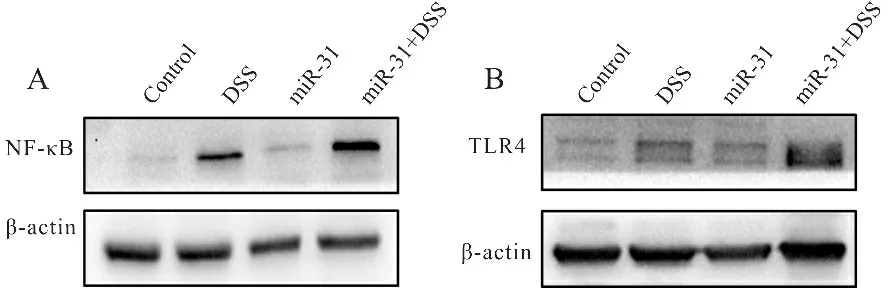
Fig. 1 Relative expressions of NF-κB and TLR4 in mouse colon
2.2 免疫组织化学法(IHC)检测miR-31对小鼠结肠组织中NF-κB和TLR4蛋白表达的影响
免疫组化结果表明,与control组相比,DSS组NF-κB (P<0.01,图2,表2)、TLR4(P<0.01,图2,表2)蛋白表达显著升高,miR-31组NF-κB(P< 0.01,图2,表2)、TLR4(P<0.01,图2,表2)蛋白表达也显著升高; 同样的与DSS组相比,miR-31+DSS组NF-κB(P<0.01,图2,表2)、TLR4(P<0.01,图2,表2)蛋白的表达也显著升高。进一步验证了miR-31对结肠炎的促进作用与TLR4/NF-κB通路有关(图2见彩图页Ⅰ)。
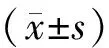
Tab. 1 Relative expressions of NF-κB, TLR4, Bcl-2/Bax ratioin and apoptotic index in mouse colon
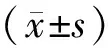
Tab. 2 Relative expressions of NF-κB, TLR4, Bax, Bcl-2 in mouse colon by IHC
2.3 Western blot检测miR-31对小鼠结肠组织中Bax和Bcl-2蛋白表达的影响
小鼠结肠组织Western blot结果表明,与control组相比,DSS组 (P<0.01)和miR-31组(P<0.05) Bcl-2/Bax的表达显著降低;与DSS组相比,miR-31+DSS组的Bcl-2/Bax表达也显著降低(P<0.01,图3,表1)。说明miR-31过表达会增加结肠炎组织的细胞凋亡。
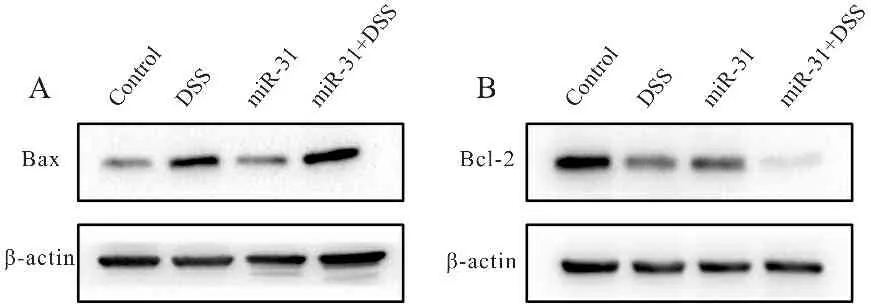
Fig. 3 Relative expressions of Bcl-2 and Bax in colonic tissue of mice
2.4 免疫组织化学法(IHC)检测miR-31对小鼠结肠组织中Bax和Bcl-2蛋白表达的影响
免疫组化结果表明,与control组相比,DSS组Bax蛋白表达显著升高(P<0.01,图4A,表2)、Bcl-2蛋白表达显著下降(P<0.01,图4B,表2),miR-31组Bax蛋白表达显著升高 (P<0.05,图4A,表2)、Bcl-2蛋白表达显著下降(P<0.01,图4B,表2); 与DSS组相比,miR-31+DSS组Bax蛋白表达显著升高 (P<0.01,图4A,表2)、Bcl-2蛋白表达显著下降(P<0.01,图4B,表2)。进一步证实miR-31过表达会使结肠炎组织的细胞凋亡增加(图4见彩图页Ⅱ)。
2.5 TUNEL法检测miR-31对小鼠结肠组织细胞凋亡的影响
TUNEL结果显示,与control组相比,DSS组(P<0.01)和miR-31组(P<0.05)凋亡细胞均显著增加,核固缩,凋亡细胞呈现棕褐色;与DSS组相比,miR-31+DSS组棕褐色的凋亡细胞也显著增加(P<0.01,图5,表1,图5见彩图页Ⅲ)。
2.6 miR-31对HCT 116细胞中NF-κB、TLR4蛋白表达的影响
为了进一步验证结肠炎中miR-31对TLR4/NF-κB信号通路的影响,我们使用miR-31的mimic和Inhibitor转染HCT 116细胞。Western blot结果表明,与control组相比,转染miR-31-mimic后,NF-κB (P<0.05,图6A,表3)、TLR4(P<0.01,图6B,表3)蛋白表达显著升高,转染miR-31-Inhibitor后NF-κB(图6A,表3)、TLR4(P<0.05,图6B,表3)蛋白表达降低,与小鼠结肠组织的结果一致。
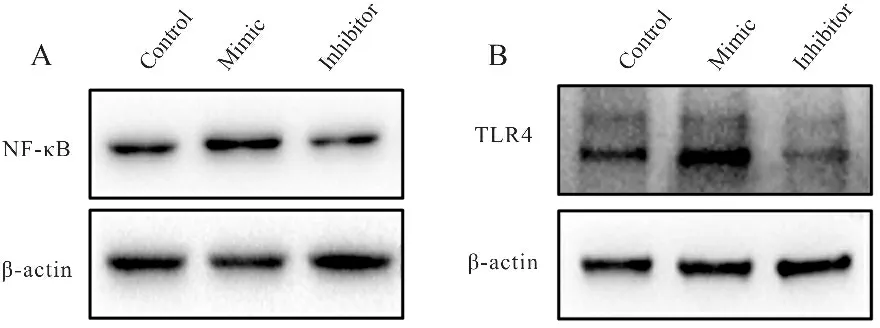
Fig. 6 Relative expressions of NF-κB and TLR4 in HCT 116 cells after miR-31 overexpression or knock-down
Tab. 3 Relative expressions of NF-κB and TLR4 in HCT 116 cells after miR-31 overexpression or knock-down
3 讨论
近年来miRNAs被用作生物标志物或治疗靶标备受关注,目前已有许多研究已经表明miRNAs与肿瘤、炎症性疾病、心脏疾病等多种疾病的发病机制有关,如miR-31在喉鳞状细胞癌、肾细胞癌和结直肠癌中均有miRNAs的异常表达[8-12]。我们实验室前期通过对溃疡性结肠炎患者结肠组织miRNAs筛选发现,与正常组织相比miR-31-5p有显著性差异性表达且目前研究较少,因此我们把miR-31作为本课题深入研究溃疡性结肠炎的靶标,本实验室利用DSS诱导溃疡性结肠炎小鼠模型已有多年且技术十分成熟[13,14],前期的结果也已经证明miR-31过表达的小鼠DSS诱导肠炎发生率和炎症程度均高于非转基因小鼠,说明miR-31过表达促进肠炎的发生[6],故适度抑制miR-31是否可以治疗肠炎也是我们关注的问题。本研究则在前期实验的基础上发现miR-31过表达会使溃疡性结肠炎小鼠组织中TLR4、NF-κB蛋白表达升高以及使凋亡相关蛋白Bcl-2/Bax比值下降,提示miR-31对结肠炎的促进作用与TLR4/NF-κB信号通路以及细胞凋亡相关。
炎症性肠病(inflammatory bowel disease, IBD)是由多种因素引起的慢性复杂疾病,其发病机制尚不清楚,因此受到越来越多的关注[1]。IBD期间炎症介质(包括促炎细胞因子)的过量产生可能促进结直肠癌的发生和发展,据报道,炎症过程中的几个关键因子如NF-κB与炎症和癌症之间的转换机制有关[15-17]。有研究表明,TLRs和TNFR的激活会导致NF-κB的活化并诱导许多促炎因子的表达,例如诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)[18-20],且越来越多的研究报道TLR4 / NF-κB信号传导在结肠炎及其相关结肠癌中的关键性作用[16,21],但目前对于结肠炎中miR-31与TLR4 / NF-κB之间的关系研究较少。我们的结果表明,在小鼠的结肠组织中,DSS诱发肠炎小鼠结肠TLR4、NF-κB的蛋白表达显著升高,同时miR-31组TLR4、NF-κB的蛋白表达水平也比正常对照组增加;与DSS组相比,miR-31+DSS组TLR4、NF-κB的蛋白表达水平也显著升高。提示miR-31对结肠炎的促进作用与TLR4/NF-κB信号通路有关。为了进一步验证我们的推断,我们在HCT 116细胞中分别过表达和抑制miR-31-5p,结果表明,miR-31-5p过表达组TLR4和NF-κB蛋白表达升高,miR-31-5p 敲低组TLR4和NF-κB蛋白表达水平相比于正常对照组下降。这些结果提示适度抑制miR-31可以通过下调TLR4/NF-κB信号通路的活性对结肠炎发挥治疗作用,但其详细的作用机制仍有待进一步研究。
结肠上皮细胞凋亡增加在UC发病中起重要作用[22],Bax可以促进细胞凋亡,Bcl-2是细胞凋亡抑制基因,增加Bcl-2的表达可以与Bax结合形成更稳定的异二聚体以抑制细胞凋亡,因此Bcl-2 / Bax的比例可以调节细胞凋亡[23]。而在本次研究中我们观察到,在小鼠的结肠组织中,相比于正常对照组,DSS组和miR-31组Bax蛋白表达水平升高,Bcl-2蛋白表达水平下降,Bcl-2/Bax的比值下降;同样的与DSS组相比,miR-31+DSS组Bax蛋白表达水平升高,Bcl-2蛋白表达水平下降,Bcl-2/Bax的比值下降。同样的,通过原位末端转移酶 (TUNEL) 法我们还观察到溃疡性结肠炎小鼠模型中存在大量凋亡的细胞核,且miR-31过表达会使小鼠结肠组织凋亡的细胞核增加。这些结果表明,miR-31可以通过介导肠上皮细胞(intestinal epithelial cells, IEC)的凋亡来促进结肠炎,但具体的凋亡途径仍然需要进一步探究。
综上所述,miR-31可以促进溃疡性结肠炎期间TLR4、NF-κB蛋白的表达,并使Bcl-2/Bax的表达在溃疡性结肠炎组织中降低,同时miR-31过表达使溃疡性结肠炎组织中细胞凋亡增加,提示我们miR-31对溃疡性结肠炎的促进作用与TLR4/NF-κB信号通路和凋亡相关,为溃疡性结肠炎的治疗提供新的思路和靶点,但其具体的机制仍需进一步的研究。

