杜仲叶提取物对人牙周膜干细胞体外增殖及成骨分化的影响
刘焱 陈青宇, 许凤 王忠厚 高翔 高俊武
(包头医学院 1口腔学院,内蒙古 包头 014060;2第一附属医院口腔科)
随着中国逐渐进入老龄化社会,老年口腔疾病的患病率呈上升趋势。牙周炎是老年人群中多见、发病率高、全世界范围内广泛流行的慢性病之一,已成为成人牙齿丧失的主要原因〔1〕。牙周炎是炎症破坏性疾病,会导致牙周韧带、牙骨质、牙槽骨等牙齿支持组织破坏吸收。有研究证实,牙周炎不但会对口腔系统组织结构和功能造成损伤,同时还是多种全身疾病的诱因〔2〕,例如冠心病、高血压、慢性呼吸系统疾病、胃炎及糖尿病等。在控制感染的基础上重建牙周组织是牙周炎治疗的最终目标。牙周组织工程研究的不断深入,给牙周组织再生带来新的机遇和挑战〔3〕。人牙周膜干细胞(hPDLSCs)是由人牙周膜分离出的间充质来源的多能干细胞,具有高增殖能力、自我更新能力和多向分化潜能〔4〕。通过诱导分化,hPDLSCs 可形成牙槽骨、牙周膜-牙骨质复合体的结构,从而实现真正意义上的牙周组织再生〔5〕。成骨潜能在牙周组织修复过程中发挥重要作用。中药杜仲为我国特有杜仲科植物。临床上常配伍他药用于治疗骨质疏松、骨性关节炎、骨折等疾病。现代药理学研究证实杜仲的有效化学成分具有调节骨代谢、加速成骨、促进骨形成等作用〔6〕。但杜仲对hPDLSCs体外扩增效率和生物学特性的影响尚不清楚,本实验旨在研究杜仲叶提取物对体外培养的hPDLSCs增殖与成骨分化的影响。
1 材料与方法
1.1材料和仪器 健康年轻恒牙,取自16~18周岁患者的正畸拔牙的前磨牙样本,由包头医学院第一附属医院口腔科提供;DMEM培养基、胎牛血清(Gibco,美国);青、链霉素(华北制药);0.01 mol/L磷酸盐缓冲液(PBS,pH 值7.2~7.4);Ⅰ型胶原酶(Sigma,美国)、0.25%胰蛋白酶-乙二胺四乙酸(EDTA,Hyclon,美国);地塞米松、β-甘油磷酸钠、抗坏血酸(Sigma,美国);小鼠抗人波形丝蛋白(Dako,美国)、羊抗小鼠 IgG-TRITC 荧光二抗(Sigma,美国)、荧光染料Hoechst33258(Sigma,美国);四甲基偶氮唑盐(MTT,Sigma,美国)、二甲基亚砜(DMSO,Amresco,美国);碱性磷酸酶(ALP)检测试剂盒(AAT,美国);Trizol、氯仿、异丙醇、反转录试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser)、实时荧光定量PCR试剂盒(SYBR Premix Ex TaqTM,Takara,日本)。二氧化碳恒温孵箱(Forma,美国);离心机(Kubota2100,日本);倒置相差显微镜及照相系统(Olympas,日本);荧光显微镜(BX61+DP-71,Olympus,日本);酶标仪(SpectraMax M2,Molecular Devices,美国);荧光实时定量PCR仪(Rotor-Gene 3000,Corbett,澳大利亚)。
1.2杜仲叶提取物的配制 将新鲜杜仲叶于60℃条件下干燥后细磨成粉,取1 g加入10 ml甲醇,室温震荡1 h,静置过夜,15 000 r/min离心10 min,弃沉淀,收集上清、真空浓缩,加水至10 ml溶解剩余物即得杜仲叶提取物原液。原液经0.22 μm膜过滤,以DMEM培养基稀释,分别配制成含杜仲叶提取物10-4,10-5,10-6g/ml的不同质量浓度的工作液待用。
1.3人牙周膜干细胞分离培养
1.3.1标本纳入标准 16~18周岁正畸拔牙的前磨牙。拔除的年轻恒牙无明显龋坏,无牙髓病变及根尖周病变,无牙周及黏膜疾患,同时可刮取到所需牙周膜组织,且所有纳入个体无系统疾病。患者知情同意并签署知情同意书。
1.3.2酶解组织块法原代培养、分离纯化hPDLSCs 牙拔除前以75%乙醇充分消毒牙体周围组织,拔除后立即放入预冷含高倍双抗DMEM培养基中保存备用,低温保存状态下送实验室,2 h内原代取材。在超净台内用PBS冲洗牙根部3~5次,刮取牙根中1/3部位的牙周膜组织,修剪组织块为约1 mm3,用2 mg/ml的Ⅰ型胶原酶在37℃下消化1 h,离心弃上清,加入含10%胎牛血清的DMEM培养基均匀所得沉淀,平铺于培养瓶底部,置37℃、5%CO2孵箱中培养,2 d后更换培养基并弃去未贴壁细胞,隔3 d换液1次。细胞生长达80%时,用0.25%的胰蛋白酶消化传代。
1.4免疫荧光染色鉴定细胞来源 取P4代hPDLSCs消化制成单细胞悬液,制备细胞爬片,使用免疫荧光染色方法进行波形丝蛋白(vimitin)鉴定,其中一抗为小鼠抗人vimitin。PBS漂洗细胞爬片,预冷的4%多聚甲醛固定30 min,1%牛血清白蛋白封闭30 min,加入抗vimitin一抗置于湿盒中过夜。次日PBS冲洗3次,避光条件下加入TRITC荧光标记二抗孵育1 h,PBS冲洗3次后用Hoechst33258复染核5 min,甘油封片、标记,于荧光显微镜下观察细胞表面标记物vimitin的表达情况。
1.5实验分组 实验分为5组:空白对照组,含10%胎牛血清的DMEM培养基;阳性对照组,即为传统成骨诱导剂组,在含10%胎牛血清的DMEM培养基中加入10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 mg/L抗坏血酸;3个实验组,在传统诱导剂组基础上分别加入质量浓度为10-4,10-5,10-6g/ml杜仲叶提取物。
1.6细胞增殖能力检测 取生长良好P4代hPDLSCs胰酶消化,细胞计数后,将密度调整为2×104/cm2接种于96孔板中,每孔100 μl,培养24 h。后弃上清,分别按照各实验设计组更换培养条件,继续培养1、3、5、7 d,每组设3个重复孔。培养结束后,每孔加20 μl MTT溶液,37℃、5%CO2培养箱内孵育4 h,弃上清、向每孔加150 μl DMSO,振荡10~15 min,使结晶物充分溶解。用酶联免疫检测仪在490 nm波长处测定各孔吸光光度值(OD值)。
1.7ALP活性测定 将P4代hPDLSCs消化、计数,调整密度为2×104/cm2接种于96孔板中,每孔100 μl,培养24 h。弃上清,分别按照5个实验设计组更换培养条件,继续分别培养3、5、7 d,每组设3个重复孔。按ALP试剂盒上所示的步骤进行检测,用酶联免疫检测仪在520 nm波长处测定各孔OD值。
1.8RT-PCR 分别按照5个实验设计组培养hPDLSCs细胞2 w后,采用Trizol法提取各实验设计组的细胞总RNA,用Nano Drop仪器对所提取的RNA进行质检。用逆转录试剂盒将RNA逆转录成cDNA(以β-actin为内参,逆转录Runx2、OPN和OCN目的基因)50℃ 60 min,85℃ 5 min,16℃ 10 min,合成cDNA第一链。之后利用Nano Drop仪器测定浓度,将其配平到50 mg/L,作为模板待用。按每孔20 μl体系加入96孔板,每组重复3次,进行RT-PCR扩增。扩增条件为:95℃10 min;95℃ 15 s,60~64℃ 30 s,72℃ 30 s,循环25~32次;72℃延伸7 min。扩增引物序列及反应体系:RUNX-2:上游:5′TGGTTACTGTCATGGCGGGTA3′、下游:5′TCTCAGATCGTTGAACCTTGCTA3′,长度101 bp;OPN:上游:5′CTCCATTGACTCGAACGACTC3′、下游5′CAGGTCTGCGAAACTTCTTAGAT,长度230 bp;OCN:5′CACTCCTCGCCCTATTGGC3′、下游5′CCCTCCTGCTTGGACACAAAG3′,长度112 bp。
1.9统计分析 采用SPSS17.0软件行方差分析。
2 结 果
2.1原代培养hPDLSCs的形态学观察 hPDLSCs原代培养7 d可见,细胞形态为长梭形或多边形,贴壁生长,较分散。14 d后,细胞增多,逐渐融合,呈放射状、旋涡状排列,胞体丰满,胞质均匀。培养21 d 后,细胞长至80%汇合,细胞形态均一,呈长梭形,核圆形或卵圆。见图1。
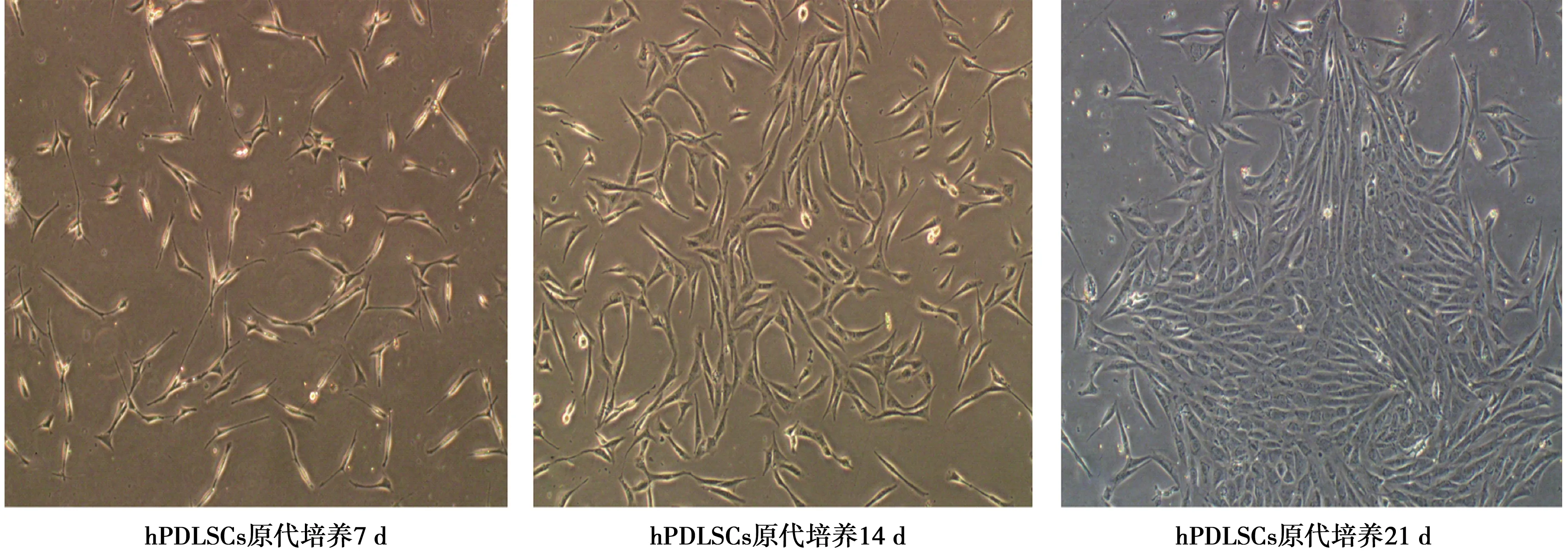
图1 倒置显微镜下观察原代培养的hPDLSCs(×100)
2.2免疫荧光染色鉴定hPDLSCs的来源 免疫荧光染色可见vimitin表达呈阳性,vimitin在胞质内表达呈红染,而不在细胞核中表达;荧光染料Hoechst33258将细胞核染为蓝色;两者复合。见图2。
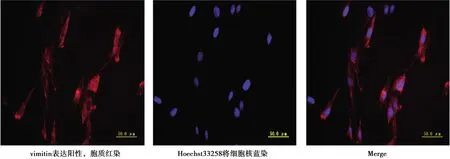
图2 免疫荧光法检测hPDLSCs的Vimitin表达(×400)
2.3细胞增殖情况 细胞接种后,随着培养时间的延长,5组细胞数量和细胞活性也逐渐增加。第1天时,OD值普遍较小,各组细胞之间增殖速度无显著差异(P>0.05)。第3~5天,细胞增殖速度明显加快,OD值持续增加,阳性对照组及3个实验组的OD值均高于空白对照组(P<0.05,P<0.01),同时3个实验组的OD值均高于阳性对照组(均P<0.05)。到了第7天,5组细胞均达到最高的OD值,细胞的增殖量达到最高,3个实验组的OD值均显著高于阳性对照组、空白对照组(均P<0.01)。各实验组中的OD值随着杜仲浓度的增加而增加,存在剂量依赖效应。见表1。

表1 MTT检测杜仲叶提取物对培养不同时间hPDLSCs增殖的影响
2.4ALP活性测定 hPDLSCs在阳性对照组和3个实验组分别培养的3、5、7 d中ALP活性均明显增高,在空白对照组则变化不显著。与空白对照组相比,阳性对照组和3个实验组ALP活性有显著差异(P<0.05,P<0.01),3个实验组与阳性对照组相比ALP活性的差异有统计学意义(P<0.05)。各实验组分别含质量浓度为10-4,10-5,10-6g/ml 的杜仲叶提取物均对hPDLSCs的ALP活力有上调作用,其中以质量浓度为10-4g/ml的杜仲叶提取物实验组的上调作用最明显,且各实验组上调的ALP活性具有时间依赖性,从第5天开始显著升高,第7天ALP活力最高。见表2。

表2 杜仲叶提取物对培养不同时间 hPDLSCs的 ALP活性的影响
2.5RT-PCR检测成骨相关基因的表达 在成骨诱导培养2 w后,对hPDLSCs成骨相关基因(Runx2,OPN,OCN)进行检测后显示,阳性对照组和各实验组的成骨分化基因的表达均增加且显著高于空白对照组(P<0.05,P<0.01),各实验组均明显高于阳性对照组(均P<0.05)。浓度为10-4,10-5,10-5g/ml的杜仲叶提取物对hPDLSCs作用后,Runx2,OPN,OCN表达均上调。见表3。

表3 RT-PCR检测成骨相关基因的表达
3 讨 论
牙周炎能够导致牙槽骨吸收及牙周组织损伤。由于人们通常对牙周炎的早期症状不够重视,使得牙周组织长时间处于慢性感染状态,这不但会引发和加重口腔系统疾病,同时还会影响全身健康。目前,我国60岁以上的老年人罹患牙周炎的概率高达 80%〔7〕。
牙周炎治疗的关键是牙周组织及骨再生。目前,体外构建牙周膜模型的主要方法就是牙周膜的体外培养。2004年,美国国家健康研究院和牙科和颅面研究中心的Seo等〔4〕从人恒牙牙周膜组织中通过酶消化法分离出克隆形成细胞,并证实其具有向成牙骨质/成骨细胞样细胞及脂肪细胞分化的能力,首次提出了hPDLSC的概念。hPDLSC具有较高的增殖及多向分化的潜能〔8〕,利用其进行体内和体外组织重建是使牙周组织修复再生的重要渠道。目前对PDLSC向牙周及成骨方向诱导,主要通过矿化诱导液、牙周细胞的条件培养及生长因子作用,缺乏特定有效的诱导微环境,因此寻找合适的诱导条件是牙周组织工程研究的重要方向。
很多中药有效成分已被证实可以促进干细胞增殖和成骨分化。杨玮等〔9〕研究发现小檗碱可促进大鼠骨髓间充质干细胞成骨分化,增强骨钙化。秦子顺等〔10〕将中药单体淫羊藿苷用于诱导hPDLSCs成骨分化,发现了淫羊藿苷可以促进hPDLSCs的增殖及骨向分化,提示淫羊藿苷代替常规生长因子应用于牙周组织工程具有一定可行性。杜仲为我国特有杜仲科植物,功效为补肝肾,强筋骨。研究发现杜仲具有提高成骨细胞的活性,抑制骨吸收,提高骨密度,防治骨质疏松,加速骨痂的改建等作用。曾建春等〔11〕通过研究杜仲含药血清诱导骨髓间充质干细胞向成骨细胞定向分化过程中蛋白的表达差异,发现杜仲可能通过上调波形蛋白、核纤层蛋白A的表达促进细胞分化,下调钙网织蛋白表达,释放细胞内钙,参与矿化过程。
在细胞学研究中,细胞增殖是一个重要的内容,组织的生长、修复与重建都需要依靠细胞的增殖来完成。本实验说明浓度为10-4,10-5,10-6g/ml的杜仲叶提取物均可促进hPDLSCs的增殖。
hPDLSCs 在矿化诱导条件下,可以表达成牙骨质/成骨样特性标记物,说明其具有分化为成骨特性细胞的功能。ALP在骨形成和矿化中发挥重要的作用,它被认为是反映成骨活性水平的标志,即当组织中的成骨细胞或某些具有成骨分化特性的细胞开始成骨分化时,ALP的活性可显著增高〔12〕。Runx2是参与成骨细胞分化和骨形成的关键转录因子,可以控制许多骨基质蛋白的表达。同样关键的成骨基因OPN,OCN的表达与hPDLSCs形成矿化基质的能力是一致的〔13,14〕,因此也可以作为hPDLSCs成骨分化和矿化能力的特殊标记。
综上,本实验先通过MTT评价含质量浓度10-4,10-5,10-6g/ml的杜仲叶提取物的矿化诱导培养基对hPDLSCs增殖的影响,发现一定浓度的杜仲叶提取物可促进hPDLSCs的增殖。后又以同样浓度范围的杜仲叶提取物成骨诱导hPDLSCs,以ALP活性和成骨相关基因(Runx2,OPN,OCN)的表达情况,评价其对hPDLSCs成骨分化的影响,结果显示相同浓度的杜仲叶提取物也可促进hPDLSCs成骨分化。本实验为体外杜仲促进人牙周膜干细胞增殖及成骨分化奠定了实验基础,也为进一步杜仲应用于临床治疗牙周组织疾病及修复骨组织缺损提供了实验依据。

