炎症因子在肩袖损伤大鼠中的表达及其临床意义
郭锐, 董云, 杨勇, 关浩, 王福川*, 张芳, 许啸, 郑小飞, 王华军*
(1.河北医科大学 附属邢台市人民医院,河北 邢台 054001;2.河北省邢台市第五医院,河北 邢台 054000;3.解放军第四二一医院,广东 广州 510318;4.暨南大学 第一临床医学院/附属第一医院,广东 广州 510632)
肩袖损伤已经成为最常见的肩部疾病.在英国,每100人中就有1.6人至少做过1次镜下肩袖修复术.过去10年间,关节镜下的肩袖修复手术增长了600%[1-3].据统计,在美国80岁以上老年人群中,患有肩袖损伤约占51%,其中每年超过25万患者需要肩袖修复手术治疗,医疗花费甚至超过70亿美元[4-5].因此,深入了解肩袖损伤诊治及康复的病理生理学过程,促进损伤肩袖的愈合成为亟待解决的问题.近年来,关节液生物因子表达变化的研究逐渐受到国内外学者的重视.损伤组织代谢释放入关节液中的生物因子,不仅可以反映关节组织损伤病情进展,往往还发挥其生物学作用,参与疾病的发生和发展[6-7].目前,在膝关节液生物因子与骨性关节炎(osteoarthritis, OA)的相互作用中开展了深入的研究[6-8].但关于肩关节液生物因子的研究相对较少,尤其是肩袖损伤后关节液中生物因子的表达变化,及其与肩袖损伤的病理生理进展和患者症状之间的关系还未明确.因此,本研究检测了大鼠肩袖损伤关节液中重要炎症因子白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)的表达,并对肩袖损伤大鼠疼痛与炎症因子之间的相关性进行研究,以期为明确关节液中生物因子在肩袖损伤和愈合过程中作用提供理论基础.
1 材料与方法
1.1 材料
1.1.1 实验动物
取清洁级雄性spraguedaw(SD)大鼠60只,鼠龄3~4个月,平均体质量为(278.35±21.42)g.根据随机数据表法将其随机分为手术组及假手术组,每组30只.所有实验动物在相同标准环境下分笼饲养,每笼2~3只,动物房安静,无强光直射,温度维持于20~25℃,湿度60%~70%,大鼠自由饮食及饮水.实验过程中对动物的处置参照国家科学技术部2006年发布的《关于善待实验动物的指导性意见》[9].
1.1.2 试剂及设备
戊巴比妥钠(上海榕柏生物技术有限公司)、全能台式高速冷冻离心机(Sorvall Biofuge Stratos,美国 Thermo Scientific公司);酶标仪(奥地利 CliniBio128 型);IL-1β、IL-6、TNF-α ELISA 试剂盒(美国 R&D 公司).
1.2 方法
1.2.1 大鼠肩袖损伤模型制备
参照经典肩袖损伤模型方法造模[6].大鼠禁食、水24 h称质量后腹腔注射体积分数为10%戊巴比妥钠(30 mg/kg),按40 mg/kg腹腔注射进行麻醉[7],麻醉成功后俯卧固定.以大鼠右侧肩胛区剪毛、消毒,铺无菌手术巾.手术组建立肩袖损伤模型,于大鼠右肩胛冈肩峰端作一纵行切口,长约1.5 cm,分离浅筋膜至暴露肩胛区及上臂肌肉,找到斜方肌附着部,分离并向前上方翻开即可见冈上肌位于斜方肌覆盖之下.仔细分离整条冈上肌至肱骨大结节止点,显露大鼠冈上肌腱,将冈上肌腱横行切断约1/2(切忌全部切断,防止肌腱回缩),压迫止血,逐层缝合切口.假手术组(对照组)于右肩胛部做相同皮肤切口,暴露冈上肌腱后不做剪切,缝合切口.术后单笼饲养,自由饮食、饮水及活动.术后予以肌注青霉素(40万单位/d),持续1周.在大鼠苏醒后密切观察其步态、进食和伤口愈合情况,评价造模效果.
1.2.2 大鼠关节疼痛评分(缩腿嘶鸣评分)
参照文献检测疼痛方法[8,10],于术后第2、4、8周,将SD大鼠头部套上软套,放入特制的塑料筒内,两前腿露出筒外,稳定3~5 min后进行测定.向脚掌侧缓慢屈曲(跖屈)大鼠的右侧肩关节,观察其嘶叫或短促而明显的缩腿反应,无反应评分为0,若出现一种反应评分为1,两者均出现评分为 2,两种指标的总评分为0~10.由同一名具有丰富相关测试经验的人员,每隔5 s进行一次,进行5次测试.将肩关节向足背侧弯曲,可测得背屈关节疼痛实验评分,评分方法与跖屈关节评分方法相同.用缩腿、嘶鸣两者的总评分来反映关节疼痛的程度更为全面,且可弥补两种评分各自的缺点,可有效客观衡量大鼠关节疼痛.
1.2.3 测定IL-1β、IL-6 和 TNF-α含量
于术后第2、4、8周在2组中各取10只大鼠,用过量的戊巴比妥腹腔注射进行处死,在原手术区备皮后常规消毒、铺无菌巾,按原切口进入,暴露肩关节,切开肩关节囊及滑囊,抽取关节液,离心去除组织细胞和碎屑,取上清液.采用酶联免疫吸附试验(enzyme-linked immunosorbent assays,ELISA)方法检测上清液TNF-α、IL-1β、IL-6 水平,检测过程严格按 ELISA 试剂盒说明书进行加样,每个标本设置两个复孔,重复3次试验,取其结果平均值.完成后使用酶标仪于 450 nm 波长下测得吸光度值(optical density,OD)进行检测.根据标准品的浓度及对应的D(450nm)值计算出标准曲线方程,再依据样品D(450nm)值计算出相应IL-1β、IL-6和TNF-α的含量.
1.2.4 统计方法
采用SPSS 19.0软件行相应的统计学分析,计量资料采用(平均数±标准差)的方式表示.采用成组设计资料的t检验及Pearson相关分析进行统计学处理.P<0.05表示差异有统计学意义.
2 结果
2.1 一般情况
两组大鼠造模当天即自主进食,但均有不同程度的摄食减少,跛行步态.对照组大约2~5 d后逐渐恢复正常;手术组食量2~5 d恢复,跛行步态持续存在;所有大鼠术口均未发生红肿感染,实验中途未见死亡脱落.
2.2 疼痛评分
手术组在3个观察时点的疼痛评分均高于假手术组,差异有统计学意义(P<0.05),见表1.
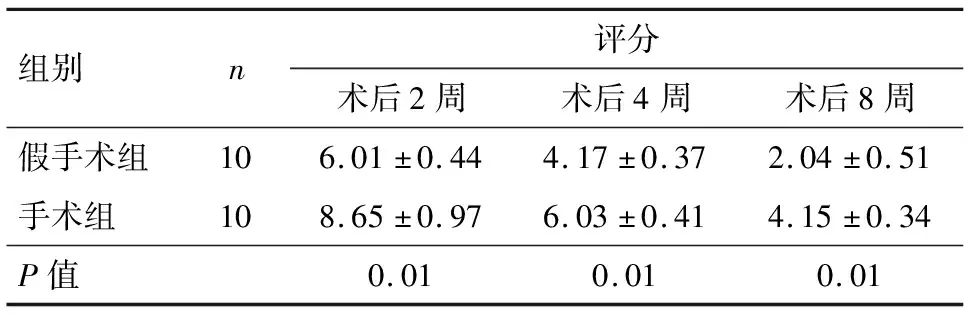
表1 两组造模后疼痛评分的对比
2.3 IL-1β质量浓度对比
手术组在3个观察时点的IL-1β含量均高于假手术组,差异均有统计学意义(P<0.05),见表2.
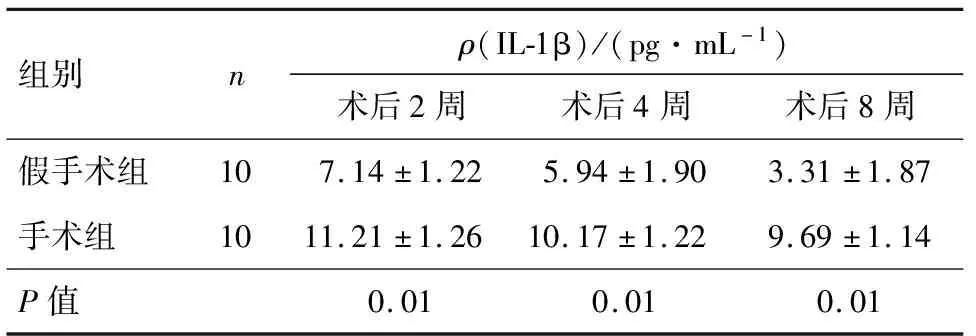
表2 两组造模后IL-1β质量浓度的对比
2.4 IL-6质量浓度对比
手术组在3个观察时点的IL-6含量均高于假手术组,差异均有统计学意义(P<0.05),表3.
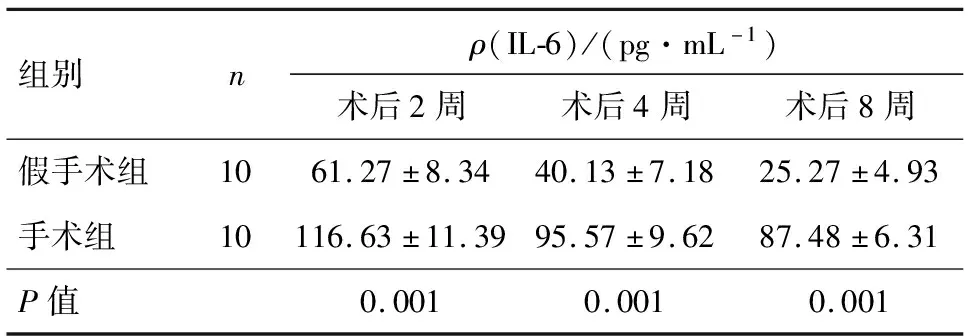
表3 两组造模后IL-6质量浓度的对比
2.5 TNF-α质量浓度对比
手术组在3个观察时点的TNF-α含量均高于假手术组,差异均有统计学意义(P<0.05),见表4.
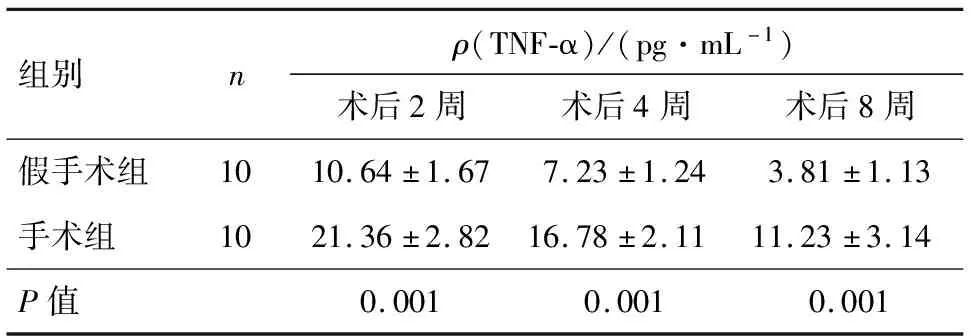
表4 两组造模后TNF-α质量浓度的对比
2.6 疼痛评分与炎症指标的相关性
手术组疼痛评分与IL-1β、IL-6、TNF-α的质量浓度分呈正相关(r=0.329,P=0.028;r=0.861,P=0.001;r=0.907,P=0.001),随着炎症指标含量的下降,关节疼痛评分也逐渐降低,见表5.
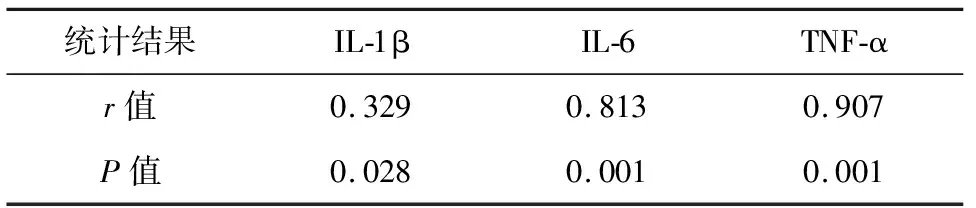
表5 疼痛评分与3个炎症指标的相关性
(1)手术组中SD大鼠肩关节液中IL-1β质量浓度与疼痛评分呈正相关(r=0.329,P<0.05)(图1),随着IL-1β表达水平的升高,大鼠关节疼痛加重.
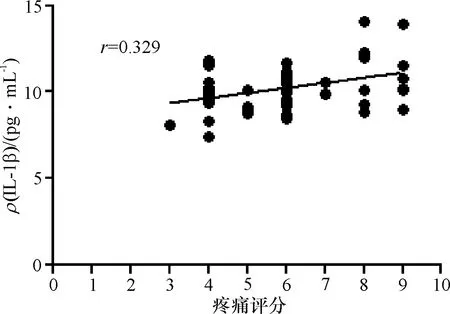
图1 IL-1β质量浓度与疼痛评分相关性
(2)手术组中SD大鼠肩关节液中IL-6水平与疼痛评分呈正相关(r=0.813,P<0.05)(图2),IL-6表达水平的升高,大鼠关节疼痛加重.

图2 IL-6质量浓度与疼痛评分相关性
(3)手术组中SD大鼠肩关节液中TNF-α水平与疼痛评分呈正相关(r=0.907,P<0.05)(图3),TNF-α表达水平的升高,大鼠关节疼痛加重.
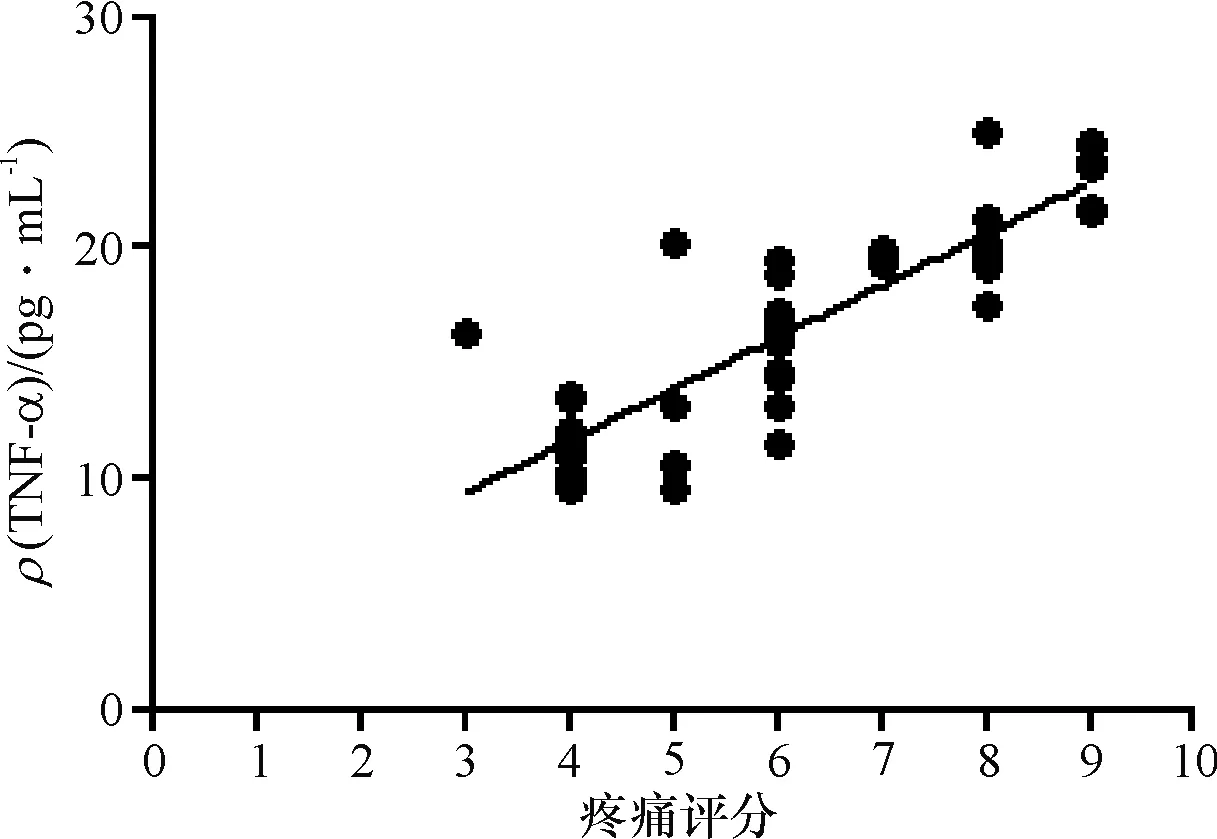
图3 TNF-α质量浓度与疼痛评分的相关性
3 讨论
肩袖在肩关节动态稳定中发挥重要作用,在运动乃至生活中很容易受到损伤.肩袖损伤是导致肩关节疼痛及活动障碍的最主要原因之一,约占肩关节疾病的50%[11].随着年龄的增加,发病率逐步增高,60岁以上人群约25.6%患有肩袖损伤,70岁以上人群更是高达45.8%[12].目前我国60岁以上人口达到2.22亿,占人口总数的16.1%,因此,我国肩袖损伤患者人群十分庞大,深入了解肩袖损伤诊治及康复的病理生理学过程,促进损伤肩袖的愈合成为亟待解决的问题.
肩袖损伤导致疼痛的确切机制目前尚不清楚,通常认为肩袖损伤疼痛是由于局部损伤肌腱牵拉而引起.近年来,关节液中生物因子表达变化及其与关节疾病的关系越来越受到国内外学者的重视[13-15].当关节出现病变时,损伤组织代谢释放入关节液中的生物因子,不仅可以反映关节组织损伤病情进展,往往还发挥其生物学作用,参与疾病的发生和发展,能更直接更敏感的反映关节的生理病理情况[16-18].目前,对膝关节关节液已经开展了深入的研究.有研究发现OA患者关节液中IL-1、IL-2、IL-6和 TNF-α的含量与膝关节影像学分级以及临床症状有明显相关性,较影像学检查更具敏感性,可辅助 OA 的早期诊断[13].在膝关节感染的早期诊断中关节液检测也起到了重要作用,例如关节液中α-防御素较血清学检测中的C-反应蛋白和血沉具有更好的敏感性及特异度[14].但是目前关于肩关节液的研究相对较少,鉴于肩袖损伤是肩关节最常见的疾病,本研究通过大鼠肩袖损伤模型,研究肩关节液中生物因子的表达变化,继而阐明其与肩袖损伤的病理生理进展和疼痛等症状之间的关系.
在以往的研究中,Siu等[18]收集了68名肩袖损伤患者关节液,检测并分析了IL-1β 和 IL-6与患者肩关节功能评分,关节活动度以及疼痛评分之间的关系,结果显示肩关节液中IL-1β 和 IL-6水平与患者的症状呈负相关.但也有研究发现不同的结论.Abrams等[19]对比研究了19名肩袖损伤患者和11名肩袖完整志愿者的关节滑膜和滑液炎症因子的表达,证明肩袖损伤患者炎症因子表达确实升高,但与患者的症状无相关性.而Chaudhury等[20]的研究甚至得到相反的结论.他们对比了16名肩袖损伤患者和12名肩袖完整志愿者的肩袖基因表达变化,分析发现IL-6等多种炎症因子基因表达显著下降.由此可见目前对于肩袖损伤患者关节液炎症因子表达变化还存在争议.本研究同时检测了肩袖损伤愈合过程中3个时间点进行纵向的对比分析,结果证明肩袖损伤后炎性因子IL-1β、IL-6和TNF-α含量显著升高,随着损伤愈合含量逐渐降低.而大鼠患肢的疼痛也随着炎性因子的降低而缓解.进一步的相关性分析证明IL-1β、IL-6和TNF-α与大鼠疼痛呈正相关,与Siu等的研究结果一致.我们利用大鼠构建肩袖损伤模型,具有高度的统一性和可比性进行研究.而上述研究中纳入的患者数量有限,而且基本资料不具有可比性,患者身高、性别和年龄等干扰因素较多,影响结果可比性.其次,设立了多个标本采集的时间点,可以进行纵向的对比分析.而以往的研究多为横断面研究,缺乏随访资料的收集分析,因此结论具有一定的局限性.
肩袖损伤后往往伴有肩关节疼痛等症状,严重损害了患者的生活质量.对于疼痛的准确原因目前还存在争议.我们认为肩关节局部的炎症反应是疼痛的重要原因之一.炎症是机体对体内外物理化学等伤害性刺激引起的损伤所发生的防御反应,致炎因素引起组织局部血管扩张、充血、血浆蛋白外渗等炎症反应的同时也导致大量的炎症介质释放引起疼痛[21-22].本研究针对性地选择IL-1β、IL-6以及TNF-α等3种典型炎症因子进行检测,研究其表达情况及其与大鼠疼痛的相关性.其中IL-1β能够协调白细胞、免疫细胞和血细胞生长因子,通过传递细胞信息影响造血系统和免疫系统,在炎症反应中发挥重要作用[22-23].TNF-α可以刺激白细胞,内皮细胞等快速聚集,活化核因子-κB(nuclear fac-tor-κB,NF-κB)信号通路,从而诱导更多的致炎因子生成,进而促进炎症反应的发生.本研究发现,术后两组大鼠肩关节液中的IL-1β、IL-6和TNF-α的表达水平都比较高,这是由于手术创伤所引起的.但随后假手术组的表达水平迅速降低,而手术组大鼠由于肩袖损伤导致3个炎性因子的表达水平有所下降,但依然较高.进一步通过相关性分析发现上述3种典型炎症因子的表达水平与大鼠疼痛成正相关,从而证明肩袖损伤与局部的炎症反应是引起患者疼痛的主要原因.由此可见,肩关节液相关因子的检测可以作为患者病情变化的预测方法.
综上所述,本研究证实大鼠肩袖损伤疼痛与关节液中IL-1β、IL-6、TNF-α 3种炎症因子之间成正相关,肩袖损伤后局部的炎症反应加重了疼痛症状.随着肩袖的愈合,关节液中的炎症因子表达逐渐减少,炎症反应和大鼠疼痛表现明显缓解.本研究结果为肩袖损伤疼痛和关节液炎症反应提供了进一步的理论基础,也提示该炎症因子可以作为肩袖损伤疼痛疗效评价的客观依据.

