多壁碳纳米管负载FeS2的制备及脱汞性能分析
吉睿,吴昊,周长松,杨宏旻
(南京师范大学能源与机械工程学院,江苏南京210046)
汞具有易挥发性、剧毒性,逐渐成为人们关注的大气污染物之一。燃煤电厂是目前汞污染的主要排放源。燃煤烟气中的汞主要以3 种形态存在,即单质汞(Hg0)、氧化态汞(Hg2+)和颗粒态汞(Hgp)[1]。其中,Hg2+极易溶于水,可随烟气进入湿法烟气脱硫系统被脱除;Hgp因其本身的特性可以被除尘设备脱除;Hg0不溶于水,又具有极高的挥发性,很难通过现有污染物控制装置脱除。固体吸附剂法是目前研究较为广泛的燃煤烟气脱汞技术[2-3]。其中,活性炭喷射技术作为较成熟的烟气脱汞技术已被广泛研究;其技术原理是在空气预热器后的烟道中喷入活性炭[4],利用活性炭吸附烟气中的单质汞,并在除尘装置中脱除。然而,活性炭喷射技术受成本及尾部烟气条件影响很大,因此探索新型的复合型吸附材料越来越受到关注。
自然界中存在有黄铁矿(FeS2)、闪锌矿(ZnS)等矿物储量,可以直接通过研磨、冶炼等方式提纯,而且硫化物还可以用较少的原料通过水热法、液相沉淀法等在水溶液中合成。过渡金属硫化物表面硫含量丰富,本身就是由含硫的活性位点组成,跟汞具有较强的亲和力,为汞的吸附提供了有效的路径[5-6]。而多壁碳纳米管(MWCNTs)是一维纳米材料,其本身的C==C 共价键是自然界中最稳定的化学键。MWCNTs的优势在于它是多孔结构并且比表面积足够大,将二者结合制备出负载有硫化物的MWCNTs 复合吸附剂,既具有较大的比表面积,能够提供硫化物足够多的孔道,又拥有较多含硫的吸附位点,对Hg0的吸附具有突出的潜在优势。
虽然过渡金属硫化物逐渐受到重视,被认为是未来活性炭的替代品,但是目前关于过渡金属硫化物的深入研究还鲜有报道。因此,本文采用浸渍法制备FeS2/MWCNTs 复合吸附剂,通过扫描电镜(SEM)、X 射线衍射(XRD)、BET 比表面等分析手段对吸附剂进行表征,深入研究其理化特性;通过固定床实验系统研究不同实验条件下吸附剂对单质汞的吸附能力,以期为该类吸附剂的应用提供一定的技术指导。
1 实验部分
1.1 吸附剂的制备
采用溶剂热法制备纳米级别的FeS2。首先称取2.4g 硫脲溶于50mL 乙醇,搅拌至无色透明溶液;然后,往溶液中加入1.6g硝酸铁和少量聚乙烯吡咯烷酮(PVP,分析纯)后再次充分搅拌至悬浊液;随后,将溶液放入100mL 不锈钢高压反应釜内,在200℃烘箱中反应24h 后冷却至室温;最后,将产物取出并用无水乙醇和去离子水反复洗涤3 次;洗涤后的产物采用抽滤获得滤饼,滤饼放入60℃的烘箱中干燥1h,得到黑色FeS2粉末。取一定量的多壁碳纳米管(MWCNTs)溶于去离子水中,利用超声波清洗器超声后再加入一定量的FeS2混合超声,随后将样品搅拌1h 后利用旋转蒸发器烘干。最终,通过研磨并用40 目筛网筛分出粒径大小为0.4mm 左右的吸附剂样品,根据FeS2负载量的不同,将所得样品分别记作5%FeS2/MWCNTs、10%FeS2/MWCNTs和15%FeS2/MWCNTs。
1.2 表征
样品形貌采用JSM-5610LV型高分辨率扫描电子显微镜(SEM);样品晶体结构采用日本理学公司的D/max 2500/PC转靶X射线衍射仪(XRD);样品比表面积采用美国Quantachrome 公司生产的NOVA1000e 型比表面积与孔隙率分析仪(BET);样品元素价态分析采用美国Thermo Fisher Scientific公司的ESCALAB Xi+型X 射线光电子能谱仪(XPS)。
2 实验装置与方法
2.1 实验系统
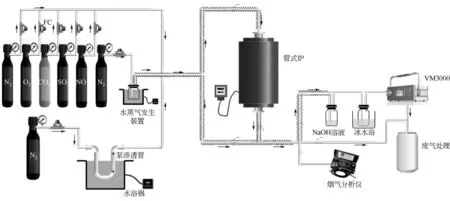
图1 实验装置系统图
实验系统如图1 所示,主要由烟气模拟系统、汞蒸气发生装置、水蒸气发生装置、固定床反应器以及在线检测系统组成。在烟气模拟系统中,利用钢瓶气模拟所需的烟气组分,各组分比例通过质量流量计来控制,模拟烟气的总流量为2L/min;在汞蒸气发生装置中,通过水浴锅加热U形管中的汞渗透管获得气态汞,并利用氮气携带至模拟烟气,氮气气量为300mL/min;在水蒸气发生装置中,利用氮气携带鼓泡瓶中蒸发出的水蒸气,水蒸气沿途所经的管道采用加热带进行保温,防止水蒸气冷凝在管道内壁,通过气体流速以及水浴锅温度来控制水蒸气含量;在固定床反应器中,每次所用的吸附剂量为0.4g,平铺在放有石英棉的石英管中,气体流量通过吸附剂的空速(GHSV)约为40000h-1;在线检测系统由VM3000在线汞分析仪及预处理装置构成,主要用于测量经过固定床反应器后气体中的汞浓度变化。在气体组分中加入酸性气体时,反应后需通入NaOH溶液除去酸性气体并通过冰水浴去除水蒸气,才能接入VM3000测汞仪。此外,出口气体经活性炭吸附装置处理后排入大气,避免对环境造成危害。
2.2 吸附剂性能评价指标
通过固定床对吸附剂进行脱汞性能测试,吸附时间设为60min,脱汞性能通过单质汞的汞脱除率来体现[6],Hg0脱除率按式(1)计算。

式中,ηHg0为单质汞的脱除率,%;Cout为固定床出口处汞浓度,µg/m3;Cin为固定床入口处汞浓度,µg/m3。
某时刻吸附量的计算:从吸附初始时刻开始直到t 时刻为止吸附剂所吸附汞的总量,可用式(2)表达。

式中,Q 为单位质量吸附剂所吸附的总吸附量,µg/g;t 为吸附时间,min;qt为流经吸附剂中单位时间内的总烟气流量,L/min;m 为所放入的吸附剂质量,g。
3 结果与讨论
3.1 表征
通过SEM分析了FeS2的微观形貌。图2(a)显示所得产物FeS2的微观形貌,从中可以清楚地观察到许多均匀性良好的球形晶体,尺寸大小基本一致,约为2µm,且颗粒之间比较分散,表面有褶皱现象。这是由于实验样品制备过程中添加了PVP 表面活性剂,PVP 表面活性剂不仅可起到分散作用,还可作为FeS2粒子的凝聚体[7]。图2(b)为5000 倍和20000 倍下10% FeS2/MWCNTs 的SEM 图,从图中可以看出,FeS2粒子被MWCNTs覆盖,MWCNTs的包覆会使得FeS2粒子之间相互联结,形成较大的团聚体。团聚体分布不均匀、大小不一,主要是由于浸渍法负载方式所导致。

图2 FeS2和10%FeS2/MWCNTs的SEM图

图3 FeS2、10%FeS2/MWCNTs、MWCNTs的XRD图谱
为了进一步考察FeS2的晶相结构,利用XRD进行表征,结果如图3所示。经检验,样品所有衍射峰都与FeS2标准图谱(JCPDS:42-1340)基本一致,表明溶剂热反应制备出的FeS2为纯净立方晶型的黄铁矿[8]。此外,样品分别在33.5°、37.3°、41.2°、47.6°和51.5°处有强烈的衍射峰,且衍射峰非常尖锐,分别对应于FeS2的(200)、(210)、(211)、(220)和(221)衍射平面[9]。图中另外两个XRD图谱分别是MWCNTs 和10% FeS2/MWCNTs。从图中可以看出,MWCNTs 仅有一个明显的衍射峰,而吸附剂中FeS2特有的衍射峰仍然存在,峰的强度却明显降低,这是由于负载FeS2的量较低,进而导致所测的峰强度较弱。
利用XPS 分析了10% FeS2/MWCNTs 表面的化学形态,对C 1s、Fe 2p和S 2p这3种元素窄区进行分峰拟合,结果如图4所示。C1s主要分出3个峰,分别位于284.0eV、286.8eV、287.7eV 处,主要归属于石墨的C—C 键以及表面基团的C—O 键和C==O 键[10][图4(a)]。Fe 2p 光谱如图4(b)所示,其中706.4eV、710.5eV处的峰值分别归因于Fe 2p3/2轨道杂化以及与O2-键结合的Fe2+[11],而719.3eV 和724.9eV 处的结合能较弱,并不影响FeS2的结构组成,进一步验证了吸附剂中Fe 的价态是以二价为主。此外,S 2p 光谱如图4(c)所示,161.5eV、162.8eV和167.8eV处有3个不同的特征峰,分别归属于S2-、和,这意味着不同的S 价态组成有助于后续对Hg0的吸附。

图4 10%FeS2/MWCNTs的XPS图谱
3.2 脱汞特性
3.2.1 负载量对脱汞性能的影响
考虑到FeS2/MWCNTs 复合吸附剂中FeS2应为Hg0脱除的活性成分,因而研究负载量的变化是该吸附剂脱汞反应不可或缺的因素。从图5 可以看出,随着负载量的增加,比表面积逐渐降低。纯MWCNTs 比表面积为272.34m2/g,但脱汞效率仅为11.2%,主要靠分子间的范德华力使得Hg0停留在碳纳米管的孔隙中[12]。根据图6(a)得知,纯MWCNTs 的脱附温度在100~150℃,属于低温段脱附,因此主要以物理吸附为主;当FeS2负载量为5%时,比表面积降为230.78m2/g,物理吸附减弱,但吸附剂脱汞性能有所改善,脱除效率可达62.2%左右,主要增加了化学吸附。因为根据图6(b)所显示的FeS2脱附曲线,FeS2脱附峰值温度在300℃左右,属于高温段脱附,Hg0在FeS2可能生成了HgS化合物[13]。当负载量增加到10%时,比表面积降为218.92m2/g,物理吸附受到抑制,此时脱汞效率却达到90.2%,主要是吸附剂的活化点位增加,有利于化学吸附。当增加负载量达到15%时,比表面积降为206.54m2/g,吸附剂脱除效果呈小幅下降趋势。根据单层分散理论[14],在分散过程中,分散物与载体之间会产生强烈的相互作用。这种分散行为通常有一个最大分散阈值,超出此界限后分散物将会以团聚物的形式出现。这很好地解释了当负载量高于10%的时候,活性组分FeS2达到了它的最大分散值,可能会以团聚的状态出现进而降低本身的反应活性,从而表现为过高的负载量对脱汞性能的提升作用不明显。
3.2.2 初始汞浓度对脱汞性能的影响
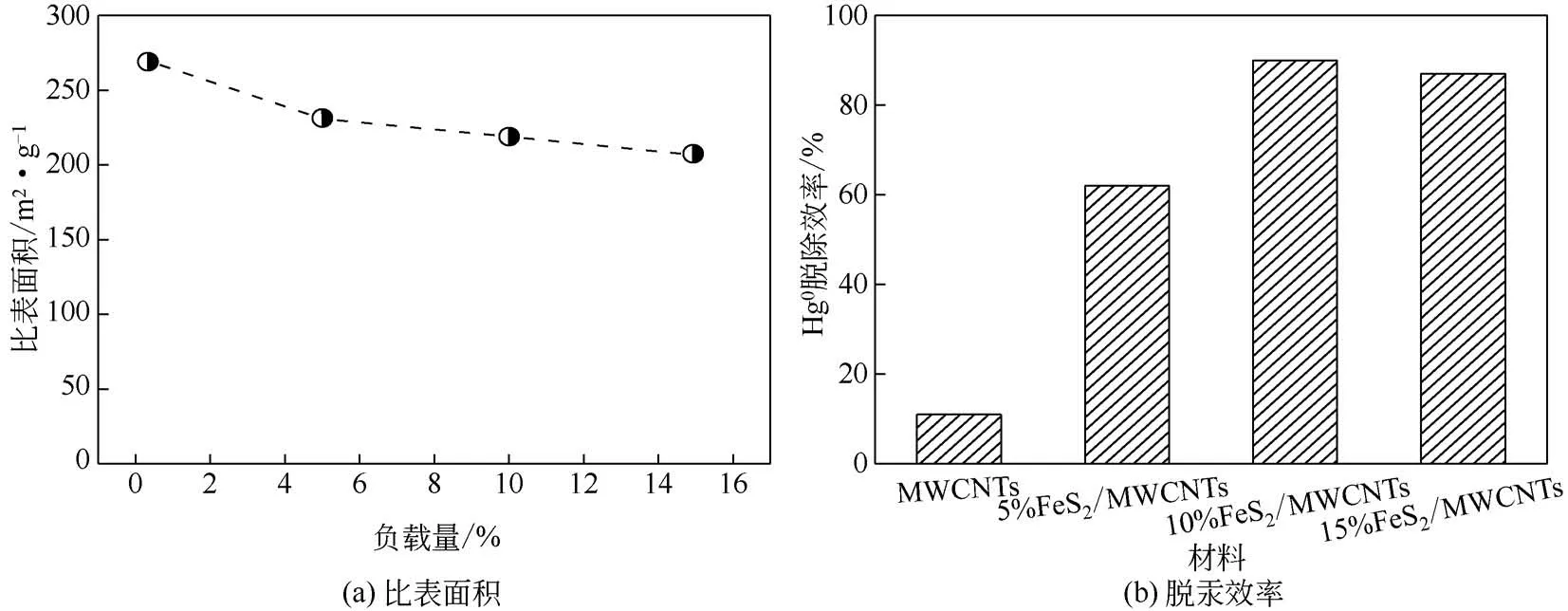
图5 负载量对复合材料比表面积和对脱汞性能的影响

图6 纯MWCNTs和纯FeS2的TPD脱附曲线
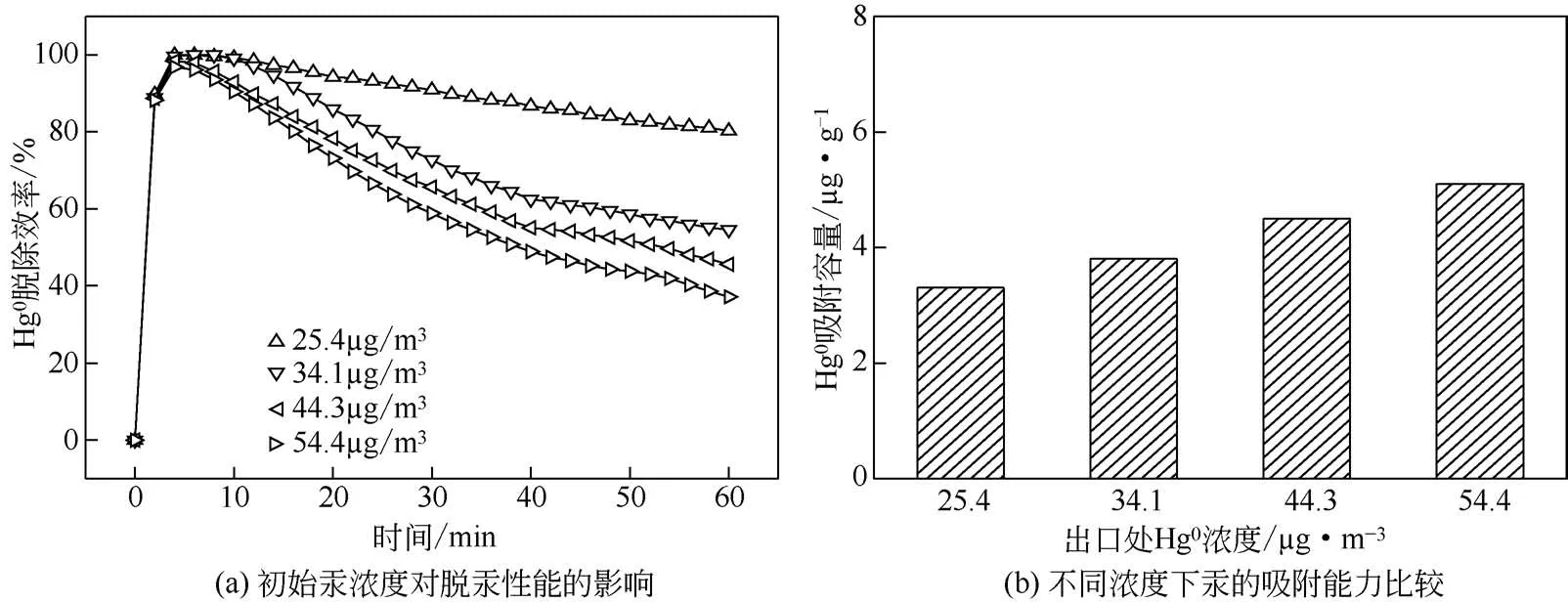
图7 初始汞浓度对脱汞性能的影响和不同浓度下汞的吸附能力比较
初始汞浓度对Hg0脱除效果的影响如图7(a)所示。 初 始 汞 浓 度 为25.4µg/m3、 34.1µg/m3、44.3µg/m3、54.4µg/m3 时,吸附剂吸附60min 后的脱除率分别为80.3%、54.6%、45.6%、37.1%。随着初始汞浓度的上升,吸附剂脱除效率整体上呈下降趋势。因为本实验所采取的吸附剂为0.4g 10%FeS2/MWCNTs,纯MWCNTs 对Hg0吸附效果有限,起决定性作用的是接近40mg 的FeS2。由于FeS2用量较少,吸附剂表面活化点位的数量是一定的[15],吸附剂在高浓度的情况下会达到饱和状态,从而导致脱汞效率的下降。虽然吸附剂的脱汞效率随浓度的增加有所下降,但却增加了Hg0与吸附剂表面的接触机会,更有利于Hg0进入孔道内部而被吸附,进而使得对Hg0的吸附容量逐渐上升,并且与入口处的汞浓度呈正相关性[如图7(b)][16]。经实验测得,汞浓度为54.4µg/m3 时吸附剂所吸附的量最多,大约为5.1µg/g。因此,初始汞浓度的升高对吸附量有一定的促进作用。
3.2.3 反应温度对脱汞性能的影响
由图8 可见,当温度在70℃、90℃、110℃、150℃时,吸附剂吸附60min 后的脱除效率分别为80.3%、68.1%、57.4%、46.6%。随着温度的升高,吸附剂对单质汞的脱除效率逐渐降低,这说明吸附剂可以在较高温度条件下工作,但是吸附效果受到较大的影响。研究表明,MWCNTs具有较弱的物理吸附,当反应温度超过100℃时吸附在表面的Hg0会释放出来,进而影响吸附剂整体的吸附效果。此外,FeS2作为过渡金属硫化物,其中硫的活性点位很容易跟Hg0起作用,形成Hg-S形式的汞化合物,当反应温度达到110℃以上时,部分吸附在FeS2表面的Hg0开始解吸,吸附过程伴随着部分解吸过程,从而导致吸附剂在温度过高时吸附效果受到抑制。
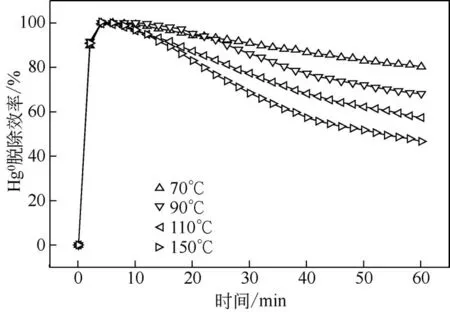
图8 温度对脱汞性能的影响

图9 10%FeS2/MWCNTs的TPD脱附曲线
结合图9 的TPD 脱附曲线分析,当温度升至100℃时Hg0开始逐渐被解吸;当温度从200℃升温至300℃时,所吸附的Hg0释放速度骤升,并且在300℃左右达到一个峰值;当升温至300℃以后,释放的Hg0会逐渐减少直至完全释放。通过对该曲线的分析可以看出,吸附剂表面吸附的汞主要以化学吸附为主。图中汞大量释放的温度区间是250~350℃,吸附剂跟Hg0的分离需要高温才能解吸,这意味着两者之间形成新的化学键。为了进一步了解吸附剂的反应机理,利用XPS分析吸附剂表面汞的价态,如图10 所示。由图10 可见,在100.5eV 和104.2eV 处有两个明显的峰,分别对应于自旋轨道分裂导致的Hg 4f7/2和Hg 4f5/2,这意味着吸附剂表面的Hg0被氧化成Hg2+。Hg2+不能单独存在,它的亲硫性使它吸附在FeS2表面形成较稳定的化合物HgS。此外,图4(d)为吸附后S 2p 的XPS 图谱,与吸附前相比归属于SO2-4 的特征峰强度明显变低,这意味着吸附汞之后S杂化轨道之一的SO2-4 的占比变少,而形成HgS 的S2-价态比例明显增多,进一步证明了吸附剂表面汞化合物的生成。研究表明[17],HgS 分解温度的峰值大约为300℃,属于高温段脱附,与本实验吸附剂的解吸温度相一致。因此,推测反应机理可能如式(3)~式(5)所示。
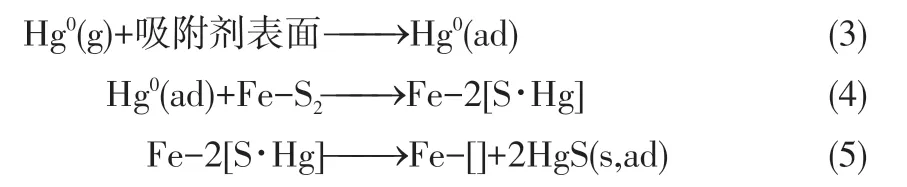

图10 Hg 4f的XPS图谱
3.2.4 O2对脱汞性能的影响
图11为不同O2体积分数条件下吸附剂对Hg0的脱除效率。由图可见,O2体积分数分别为0、2%、6%时,吸附剂对Hg0 的最高脱除效率都能达到100%,吸附60min 后对Hg0 的脱除效率分别为72.4%、73.7%、77.1%。结果表明,有O2存在情况下吸附剂捕获Hg0的速率跟无O2条件下的吸附速率相差不大,并且吸附60min后脱汞效率波动范围很小,这表明O2的存在对吸附剂的吸附效果影响较弱。因为吸附剂本身是由MWCNTs和FeS2组成,并没有晶格氧的存在,无法跟Hg0形成如HgO 的稳定化合物[18]。有研究表明,O2的存在可能会导致金属硫化物的氧化,这将抑制对Hg0的捕集,但经过实验证实对磁黄铁矿捕获Hg0没有明显的抑制作用[19]。
3.2.5 水蒸气对脱汞性能的影响
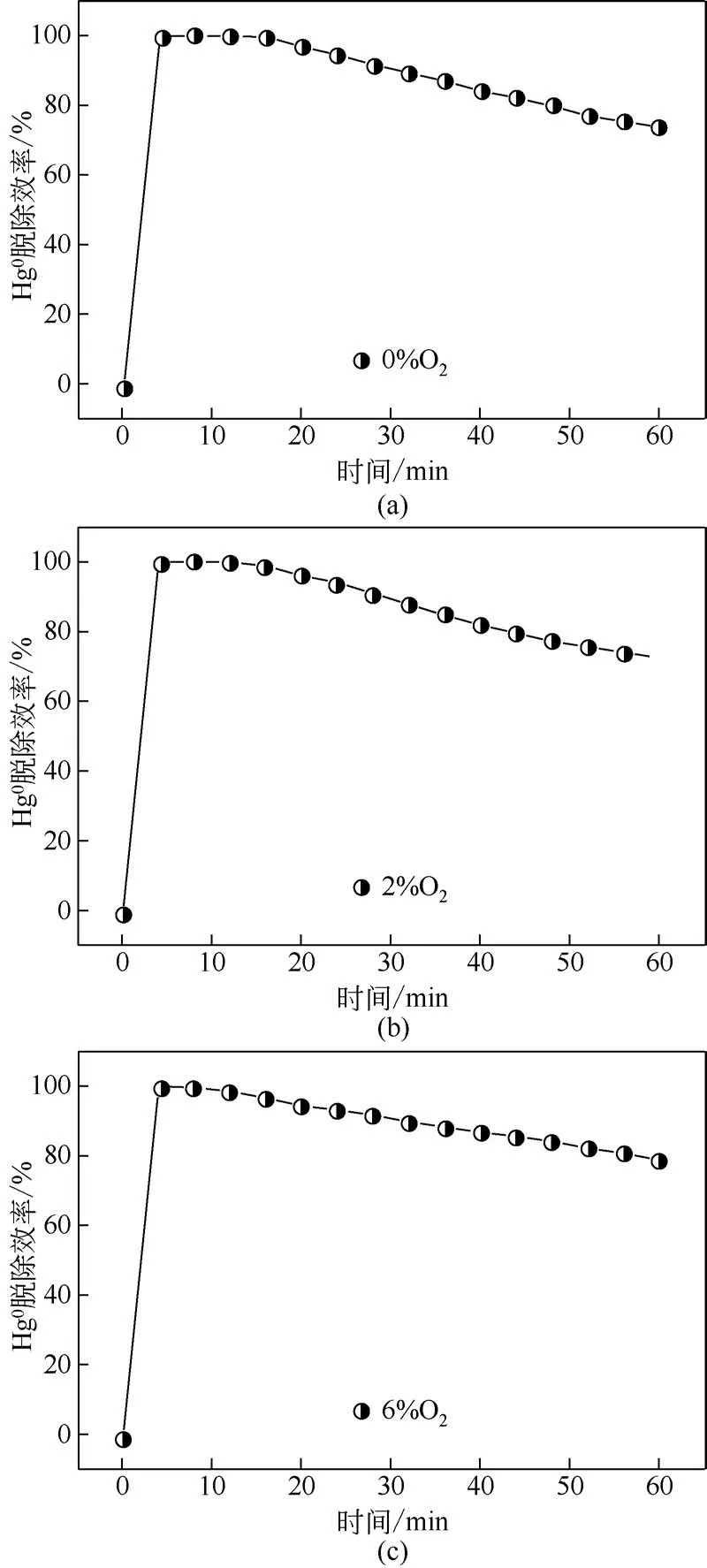
图11 O2对脱汞性能的影响
由图12 可见,当水蒸气体积分数分别为0、1%、4%、7%时,吸附剂吸附60min的平均脱汞效率分别为90.2%、76.9%、71.3%、61.8%。当水蒸气体积分数为1%时,吸附剂的平均脱除效率从90.2%降到76.9%,降低了13.3%,这意味着在水蒸气体积分数较低情况下对吸附剂的抑制作用比较明显;当水蒸气体积分数持续升高时,脱除效率仍在降低,7%水蒸气对应的脱汞效率已经降到61.8%,这说明水蒸气的存在对吸附剂的吸附有很大的影响。造成这一现象的主要原因可能是水蒸气的参与会占有吸附剂表面的活性点位[20],跟Hg0产生竞争吸附;当水蒸气体积分数过高时,被吸附在表面的水蒸气很可能在吸附剂表层形成水膜[21],更加阻碍与Hg0的接触,进而造成脱汞效果的降低。
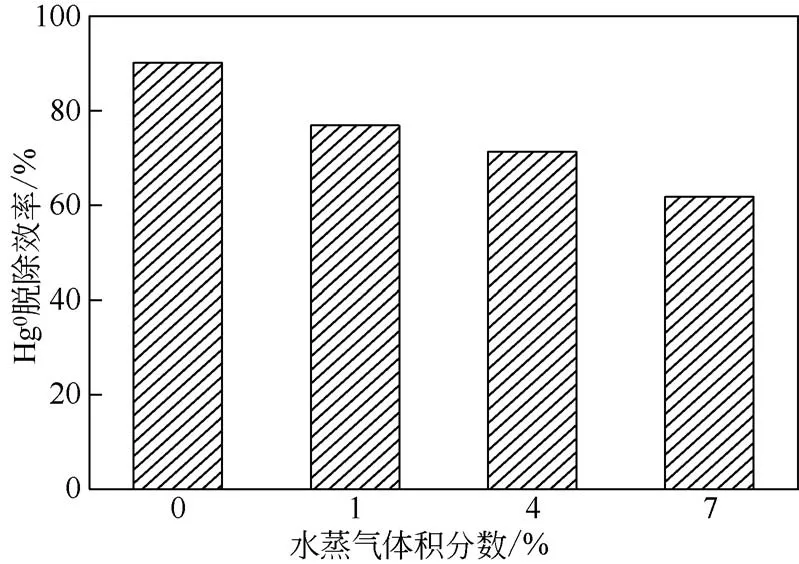
图12 水蒸气对脱汞性能的影响
3.2.6 NO及SO2对脱汞性能的影响
图13(a)给出了不同NO 体积分数对Hg0吸附1h时平均脱除效率的影响。在基础烟气条件下,通入少量的NO,当体积分数分别为0、200µL/L、400µL/L、600µL/L、800µL/L时,平均脱汞效率为90.2%、89.9%、90.1%、88.4%、86.1%。从脱除效率上来看,NO 的存在对吸附剂吸附有微弱的抑制作用,但总体上仍能保持较强的吸附效果。当浓度过高达到600µL/L 以上时,NO 的抑制作用比较明显。研究表明,NO 起抑制作用主要是因为NO 会与Hg0产生竞争吸附从而占据吸附位点[22];当NO浓度达到一定程度时,聚集在吸附剂附近的NO分子可能会吸附在FeS2表面,部分Hg0就无法与FeS2表面相接触进而导致吸附效率的降低。
图13(b)为不同SO2体积分数对吸附剂脱汞效率的影响,由图可见,随着SO2体积分数从300µL/L到900µL/L逐渐升高,吸附剂脱汞效率整体上逐渐降低。在低SO2体积分数情况下(300µL/L),吸附剂脱汞效率变化幅度在10%以内;当SO2体积分数达到900µL/L时,吸附剂脱汞效率大幅下降,吸附1h 后脱汞效率仅剩50.6%。烟气中SO2的存在会使很多吸附剂失去活性,造成吸附剂的实际应用受到极大的限制。较高浓度的SO2会与烟气中的汞产生竞争吸附,SO2的存在会占据吸附剂表面的活化点位,降低金属硫化物对Hg0催化氧化的活性甚至使活性组分失去活性,造成吸附剂硫中毒[23],进而导致脱汞性能的降低。
4 结论
本文采用溶剂热法合成FeS2,利用浸渍法制备出FeS2/MWCNTs 复合吸附剂,通过固定床实验系统研究不同实验条件下对Hg0的吸附效果,得出以下结论。
(1)通过SEM、XRD、XPS等测试手段分析结构特性。分析结果表明,该实验制备的FeS2纯度较高,基本无其他杂相,MWCNTs则包覆在FeS2粒子上形成较大的团聚体。此外,吸附剂的XPS结果证实了Fe的价态以及表面存在S的不同吸附位点,进一步解释了跟Hg0具有较强的亲和力。
(2)模拟烟气条件下,当负载量为10%,床层温度为70℃时,吸附剂的吸附效果最佳,最高脱除效率接近100%。O2的存在对吸附剂的整体吸附效果无太大影响。此外,H2O、NO和SO2的存在会占据吸附剂表面的活性位点,与Hg0产生竞争吸附,对脱汞效果起到抑制作用,SO2的存在还可能会使吸附剂中毒,破坏内部结构。
(3)TPD实验结果表明,吸附剂吸附的单质汞需要在高温下才能解吸,分解温度大约为300℃;通过XPS 分析得出,Hg0被吸附剂氧化成Hg2+并形成HgS 化合物,证明该吸附剂脱汞以化学吸附为主。

图13 NO和SO2对脱汞性能的影响

