玉米毛状根再生植株叶片光合特性对干旱胁迫和复水条件的响应
武佶 王禹佳 张欣玥
摘要:玉米(Zea mays L.)是重要的粮食作物和饲料作物。近年来,干旱对玉米的生产构成严重威胁。以玉米毛状根再生植株为试验材料,分别进行干旱胁迫4、6、8 d以及分别复水4、8 d的试验处理,研究玉米毛状根再生植株叶片光合特性对干旱胁迫和复水条件的响应规律。结果如下:随着干旱胁迫程度增加,毛状根植株和对照组植株的净光合速率(Pn)、气孔导度(Gs)及葉绿素含量(SPAD值)呈下降趋势,细胞间隙CO2浓度(Ci)呈先下降后上升趋势,水分利用效率(WUE)呈先上升后下降趋势,干旱胁迫6、8 d,毛状根植株受影响较小,各光合指标显著高于对照组植株(P<0.05)。毛状根植株干旱胁迫8 d的SPAD值、Pn、Gs与对照组干旱胁迫6 d的SPAD值、Pn、Gs相当,干旱胁迫 4 d,差异虽不显著,但趋势相同。说明毛状根植株有较强的光合能力及耐旱性。随着复水天数增加,不同干旱胁迫处理的毛状根植株和对照组植株生理生化水平逐渐恢复,甚至干旱胁迫4 d处理的毛状根植株的Gs出现了超补偿现象,干旱胁迫6、8 d处理的毛状根植株恢复良好,均显著高于对照组植株(P<0.05)。对照组植株除干旱胁迫4 d能恢复至接近正常供水水平外,干旱胁迫6、8 d处理恢复较难。结果表明,玉米毛状根再生植株光合能力强,这是由于其具有强大的根系,所以其对干旱的抵抗能力强,旱后复水的恢复能力显著。
关键词:玉米毛状根再生植株;干旱胁迫;复水;光合特性;叶片
中图分类号: S513.01 文献标志码: A 文章编号:1002-1302(2020)15-0106-06
玉米(Zea mays L.)是禾本科玉蜀黍属一年生草本植物,是重要的粮食作物[1]。在自然环境下,作物容易受各种因素影响,降低品质和产量,其中干旱是一种主要的非生物胁迫,威胁着世界范围内玉米的生产[2]。尤其近年来,气候的全球性变化引发的干旱发生的周期越来越短,程度越来越重,对粮食生产构成了严重的威胁。因此,在有限的水资源条件下提高作物产量显得极为重要[3-4]。考虑到现实中作物遭遇干旱胁迫的间歇性,对干旱-复水效应的研究变得更加有意义。
作物的抗旱性是指作物在干旱条件下通过自身一系列的变化所表现出的对干旱环境的适应性和抵抗的能力[5]。干旱胁迫引起植物在基因、细胞、器官、形态等多个层次上的响应[6]。当作物根系感知到水分缺乏时,就以化学信号(ABA)的形式将干旱信息传递到地上部,在叶片水分状况尚未发生改变时即主动降低气孔开度,抑制蒸腾作用,平衡植物的水分利用,叶片吸收CO2能力下降,光合速率降低,此时主要是受气孔限制因素影响[7-8]。随着胁迫程度的加重或胁迫时间的延长,光合作用的限制因素逐渐变为诸如Rubisco酶活性降低、对CO2的亲和力降低、PSⅡ光合效率下降等生化原因引起的非气孔限制因素[9-11]。2018年,麻雪艳等在不同苗期对夏玉米施加了不同程度的干旱处理,观察干旱胁迫对植株叶片气体交换参数的影响,结果发现干旱初期植物主要受气孔限制,由于CO2供应减少使细胞内O2成为电子传递的受体而使活性氧自由基增加,诱发了非气孔限制的产生,随着干旱发展,非气孔限制逐渐成为光合速率的主要限制因素[12]。2019年,胡明新等对拔节期春玉米进行了干旱胁迫及复水处理,结果发现干旱胁迫下,植株的光合速率下降,轻度干旱下复水,植株表现出高于正常供水植株的光合速率,这种机制被称为补偿效应[13]。
本研究采用笔者所在实验室具有自主知识产权的玉米毛状根再生植株为材料,该植株由发根农杆菌介导的基因对植物体进行遗传转化后获得,在形态学上表现为根系发达,侧根增多[14]。旨在研究干旱胁迫及复水处理条件下植物叶片光合特性的变化规律,由此观察毛状根再生植株的抗旱性和复水后的恢复能力以及前期干旱胁迫的生理响应对后期恢复能力的影响。本研究可为提高玉米耐旱性提供理论基础,也为研究玉米在其他生物胁迫下的响应机制提供理论依据。
1 材料与方法
1.1 植物材料
玉米毛状根再生植株的获得参照笔者所在实验室已获国家专利授权的试验方法,利用发根农杆菌15834遗传转化玉米自交系P131产生,作为试验材料(TK);玉米自交系P131作为对照材料(CK),由吉林省农业科学院惠赠。
1.2 试验设计
盆栽试验于2019年8—10月吉林省植物资源科学与绿色生产重点实验室内进行。盆栽使用的花盆直径28 cm、高25 cm,土壤取自梨树试验田,土质为黑土,每盆装土1.2 kg,土壤含水量为9%,pH值为6.3,含有机质59.3 g/kg、氮2.6 g/kg、磷 1.9 g/kg、钾13.2 g/kg。播种前利用蒸馏水室温浸泡种子22~23 h,每盆播种3穴,每穴5~6粒种子。并于二叶一心期定植每盆3株,在四叶一心期开始试验处理。试验设置正常供水(DS0)和自然干旱胁迫处理4 d(DS4)、6 d(DS6)、8 d(DS8),在胁迫结束当天、复水4 d(R4)和8 d(R8)时进行各项参数测定,每个样品进行3次生物学重复。
1.3 叶绿素含量的测定
选择生长状态良好且长势一致的玉米植株,将叶片表面的尘土清除干净后,采用叶绿素测定仪TYS-A测定叶片的SPAD值,分别于相同位置的叶片选取6个测量点,最后将记录的数据取平均值。
1.4 叶片净光合速率(Pn)、气孔导度(Gs) 、细胞间隙CO2浓度(Ci)以及水分利用效率(WUE)的测定
在光照充足的上午,用便携式光合作用测定系统(PPSystems,英国)测定植株叶片的光合参数,设定仪器的光量子通量密度为1 600 μmol/(m2·s),叶室温度为25 ℃,选第5片完全展开叶,在距叶尖端1/3处进行测定。测定参数包括了净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)及水分利用效率(WUE)等。
1.5 数据处理与统计分析
本研究中的数据采用统计软件SPSS 22.0进行差异显著性分析,采用Sigma Plot作图。
2 结果与分析
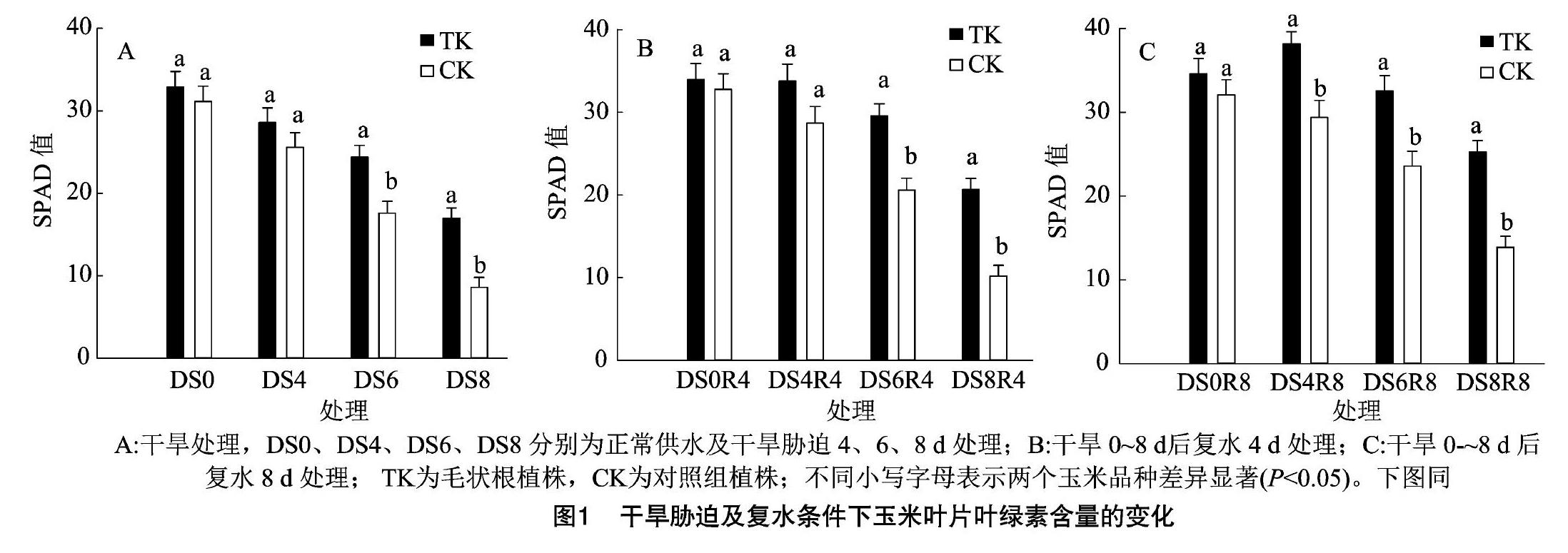
叶绿素是植物进行光合作用的主要色素之一,叶绿素含量直接影响植物的光合效率。由图1-A可见,在本研究中,正常供水条件下,毛状根植株和对照组植株的叶绿素含量没有明显不同,SPAD值分別为32.90、31.14。在干旱胁迫4 d后,毛状根植株和对照组植株的叶绿素含量均有所下降,但无明显差异。干旱胁迫6、8 d,与正常供水水平相比,毛状根植株和对照植株分别下降25.8%、48.3%和43.5%、72.4%,差异显著(P<0.05),毛状根植株干旱胁迫8 d的叶绿素含量与对照组干旱胁迫6 d的叶绿素含量相当。说明随着干旱胁迫程度加深,毛状根植株的光合机构损伤较轻,可以维持较高的光合效率。
由图1-B、图1-C可见,干旱胁迫4 d后复水4 d,毛状根植株恢复至正常供水水平,而对照组恢复至正常供水水平的87.5%;干旱胁迫6、8 d后复水4 d,毛状根植株和对照组植株分别恢复至正常供水水平的87.1%、60.9%和62.8%和31.1%,毛状根植株和对照组植株差异显著(P<0.05),毛状根植株干旱胁迫8 d后复水4 d的叶绿素含量与对照组干旱胁迫6 d后复水4 d的叶绿素含量相当,说明相比于对照组植株,毛状根植株在经过干旱胁迫后复水,其叶绿素能够更加快速合成,恢复力更强。复水8 d,干旱胁迫4 d处理的毛状根植株,其叶绿素含量高于正常供水水平,出现超补偿现象,对照组恢复至正常供水水平的91.6%,干旱胁迫6 d处理的毛状根植株叶绿素含量恢复至正常供水水平的94.2%,而对照组植株仅为73.5%,差异显著(P<0.05),干旱胁迫8 d处理的毛状根植株叶绿素含量为正常供水水平的73.1%,大约为对照组植株的2倍,差异显著(P<0.05),说明干旱胁迫8 d已经对对照组植株产生了严重的伤害,叶绿素不能快速合成来弥补干旱胁迫带来的损害,而毛状根植株仍能够保持叶绿素含量的相对稳定,可以得到较好的恢复。
2.2 干旱胁迫及复水条件下叶片净光合速率(Pn)的变化
干旱条件下,作物光合能力的高低和光合速率
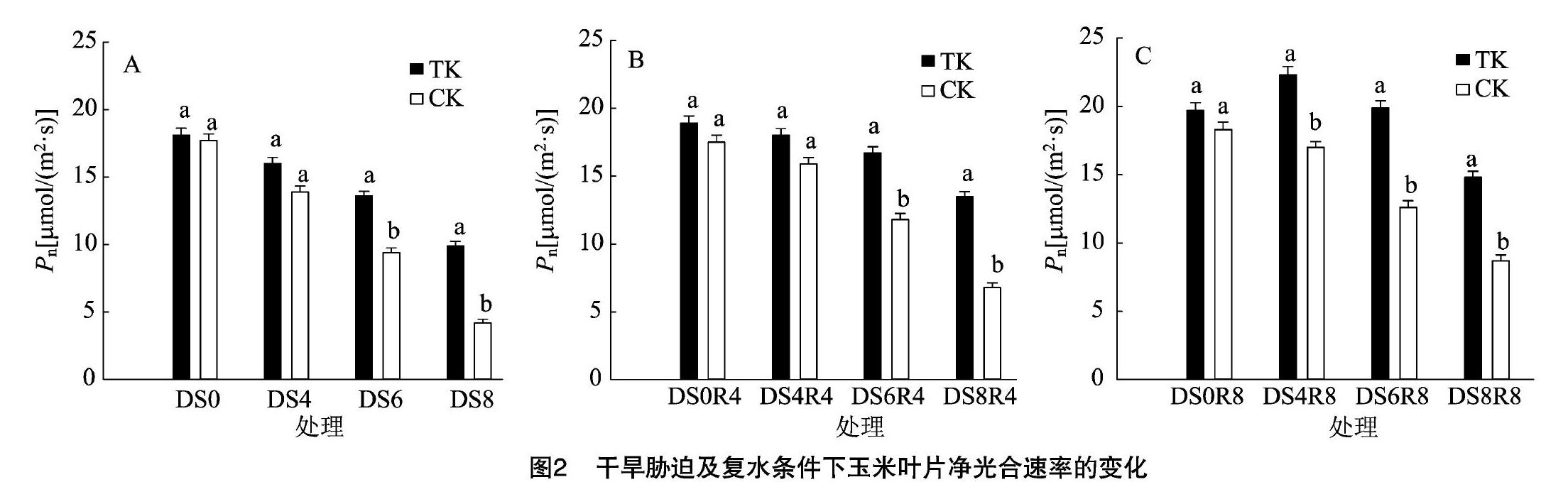
的快慢直接反映出该作物的竞争能力和干旱适应能力。由图2-A可见,正常情况下,毛状根植株和对照组植株Pn无明显差别,毛状根植株和对照组植株分别为18.1、17.7 μmol/(m2·s)。随着干旱胁迫时间增长,毛状根植株和对照组植株Pn逐渐降低,与正常供水水平相比,干旱胁迫4、6、8 d,毛状根植株和对照组植株Pn分别下降11.6%、24.9%、45.3%和21.5%、46.9%、76.3%,毛状根植株干旱胁迫8 d的Pn与对照组干旱胁迫6 d的Pn相当,说明随着干旱胁迫程度加深,毛状根植株可以稳定保持气孔的开放,以维持更高的光合速率。毛状根植株的Pn值始终大于对照组植株。
图2-B、图2-C数据显示,复水4 d,干旱胁迫4 d处理的毛状根植株和对照组植株Pn都能恢复至接近正常供水水平,无明显差别;干旱胁迫6、8 d处理的毛状根植株和对照组植株Pn分别恢复至正常供水水平的88.4%、71.4%和67.4%、38.9%,说明干旱胁迫程度加深时,对照组植株受其影响较大,自我调节能力有限,不能降低干旱胁迫带来的损害,恢复供水后无法快速恢复;而毛状根植株可以迅速恢复,维持光合机构的活性。复水8 d,干旱胁迫4 d处理的毛状根植株Pn高于正常供水水平,出现超补偿现象,而对照组植株恢复至正常供水水平的92.9%;干旱胁迫6 d处理的毛状根植株Pn完全恢复至正常供水水平,而对照组植株只恢复到正常供水水平的68.9%,两者差异显著(P<0.05);干旱胁迫8 d分别恢复至正常供水水平的75.1%和47.5%,差异显著(P<0.05),说明对照组植株无法随着复水时间延长而得到良好的恢复,而毛状根植株相反,在进一步复水后自身代谢加快,光合速率得到恢复。
2.3 干旱胁迫及复水条件下叶片气孔导度(Gs)的变化
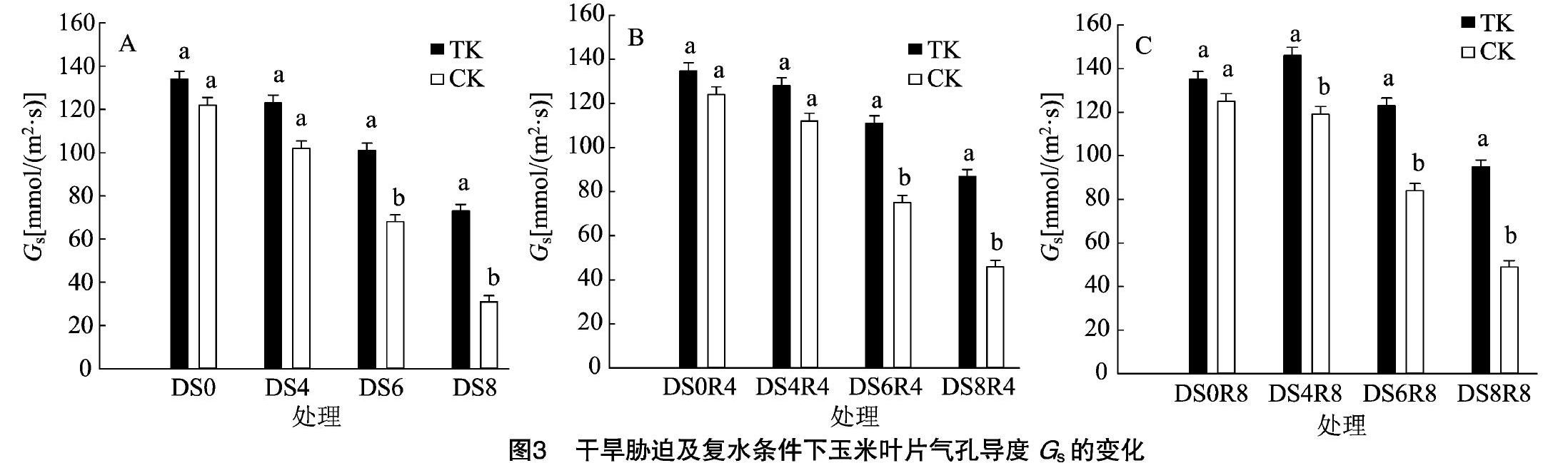
气孔是植物叶片与外界进行气体交换的主要通道,干旱胁迫会使部分气孔关闭,减少水分的散失。由图3-A可见,与正常供水相比,干旱胁迫4、6、8 d,毛状根植株和对照组植株Gs分别下降8.2%、24.6%、45.5%和16.4%、44.3%和74.6%,毛状根植株干旱胁迫8 d的Gs与对照组干旱胁迫 6 d 的Gs相当,说明与对照组植株相比,毛状根植株气孔导度下降幅度小,能在一定程度上保持水分和气体的交换。
由图3-B、图3-C数据分析表明,复水4 d,干旱胁迫4、6、8 d处理的毛状根植株和对照组植株Gs分别恢复至正常供水水平的95.5%、82.3%、64.5%和90.3%、60.5%、37.1%。复水8 d,毛状根植株和对照组植株继续恢复,干旱胁迫4 d处理的毛状根植株Gs产生了超补偿现象,与对照组植株差异显著,说明随着复水时间延长,毛状根植株的Gs一直保持较快的恢复。
2.4 干旱胁迫及复水条件下叶片细胞间隙CO2浓度(Ci)的变化
干旱初期,气孔限制是导致光合作用下降的主要原因,判断气孔限制的必不可少的依据就是胞间CO2浓度(Ci)的降低。由图4-A分析得出,正常供水条件下,毛状根植株和对照组植株Ci分别为186、174 μmol/mol。随着干旱胁迫时间加长,毛状根植株和对照组植株Ci呈先下降后上升的趋势,且毛状根植株始终高于对照组植株。干旱胁迫4 d,毛状根植株和对照组植株分别下降10.2%、17.8%,与Gs趋势一致,可能是由于气孔关闭,进入细胞内的CO2减少,并且光合作用仍然在进行的原因所致,而干旱胁迫6、8 d,Ci持续增加,且干旱胁迫8 d时超过了正常供水水平,可能是CO2利用率低以及植株由于自身代谢产生CO2,导致CO2含量增多。
由图4-B、图4-C可见,复水4 d,干旱胁迫4、6 d处理的毛状根植株和对照组植株的胞间CO2浓度(Ci)分别恢复至正常供水水平的96.8%、90.4%和93.7、85.1%;干旱8 d处理的毛状根植株高于正常供水水平1.2%,而对照组植株高了2.9%,说明干旱胁迫8 d难以恢复至正常水平,但毛状根植株Ci的恢复程度更好。复水8 d,毛状根植株和对照组植株Ci较复水4 d略有提高,基本趋于稳定,无显著变化。
2.5 干旱胁迫及复水条件下叶片水分利用效率(WUE)的变化
水分利用效率是评价玉米耐旱能力的重要指标之一,反映了作物生产过程中单位水分的能量转化效率,受蒸腾速率和光合速率共同影响。由图 5-A 可得,正常供水条件下,毛状根植株和对照组植株的WUE分别为8.52、7.62 g/kg。干旱胁迫4 d后,毛状根植株和对照组植株的WUE分别提高25.9%、13.8%,差异显著(P<0.05)。说明毛状根植株能够快速进行自我调节,提高对水分的利用,抵御干旱胁迫。干旱胁迫6 d,毛状根植株和对照组植株WUE水平均下降,但毛状根植株仍高于正常供水水平,而对照组植株却比正常供水水平下降15.7%,干旱胁迫8 d,与正常供水水平相比,毛状根植株和对照组植株WUE分别下降25.5%、64.7%,差异显著(P<0.05),说明毛状根植株在干旱胁迫加重时仍能较好地保持对水分的利用,而对照组植株不能及时适应环境的变化,失水较多。
由图5-B、图5-C可见,复水4 d,干旱胁迫 4 d 处理的毛状根植株和对照组植株WUE分别高于正常供水水平5.0%、1.2%。干旱胁迫6 d,毛状根植株高于正常供水水平1.9%,对照组植株恢复至正常供水水平的90.9%;干旱胁迫8 d处理的毛状根植株和对照组植株WUE分别恢复至正常供水水平的82.3%、47.4%,差异显著(P<0.05)。复水8 d,干旱胁迫4 d处理的毛状根植株恢复至正常供水水平,而对照组植株高于正常供水水平的2.6%。干旱胁迫6、8 d处理的毛状根植株和对照组植株分别恢复至正常供水水平的97.7%、83.8%和87.0%、55.6%。
3 讨论与结论
3.1 毛状根植株叶片光合特性对干旱胁迫和复水条件的响应规律
SPAD值是衡量叶片叶绿素含量的指标值,与叶绿素含量呈正相关,所以SPAD值的高低反映了叶片捕获光能的能力[15-16]。结果显示,毛状根植株在干旱胁迫下仍可以保持相对稳定的叶绿素含量,从而保持较高的光合效率;復水后,叶绿素可以快速合成。说明在干旱胁迫及复水条件下,毛状根植株仍可高效地合成叶绿素,这与其具有生长速度快、根系发达的优点有关,可以高效地利用养分。
气孔是植物与外界环境进行水分和 CO2 气体交换的重要通道。人们在研究气孔开闭的过程中发现,气孔导度(Gs)的升高与降低与净光合速率(Pn)有关[17-18]。当气孔导度降低致使光合速率降低时,叶肉细胞间的CO2浓度(Ci)会降低。相反,叶肉细胞间的 CO2浓度增高说明光合速率的降低导致了Gs的降低[19]。在干旱胁迫下,毛状根植株可通过调节气孔的开闭来保持较高的气体交换速率,用于维持自身的代谢以及保持高效的光合作用,从而来抵抗干旱胁迫对自身带来的损害。
在水分利用率(WUE)方面,适度的干旱胁迫可以使WUE值增加,而当干旱胁迫程度加重时,WUE随之降低[20],说明植株受到了较为严重的伤害,复水后植物叶片的气孔限制解除,气孔重新打开,光合机构受到的损伤又可得到缓解。研究结果显示,干旱胁迫及复水条件下,玉米毛状根再生植株叶片光合特性强,这是由于其具有强大的根系,可以高效地吸收水分,所以其对干旱的抵抗能力强,旱后复水的恢复能力显著。
3.2 玉米毛状根植株水分高效利用机制
在干旱程度较轻时,毛状根植株与对照组植株净光合速率差异并不明显,而随着干旱胁迫程度的加深,毛状根植株与对照组植株净光合速率差异显著。这说明在水分供应不足的情况下,玉米毛状根再生植株可以更充分地利用水分,具有更强的光合能力。2013年,周晓馥等研究了水分胁迫下玉米毛状根再生植株的形态特征,证明了其根系在水分胁迫下可以保持良好的根源水分信号和水分利用效率[21]。一些研究认为,较多的深层根、根系较长的品种在受到水分胁迫时,可以吸收土壤深层水分,抗旱性较强[22]。玉米毛状根再生植株可通过发达的根系对环境中水分进行高效利用,保持了植株较高的光合速率,减弱了干旱胁迫对植株光合作用的影响。
综上所述,玉米毛状根再生植株在干旱胁迫和复水条件处理下,通过其发达的根系调节自身代谢效率以及养分和水分的利用率,从而高效地进行光合作用,表现出强大的耐旱性以及复水后良好的恢复性。
参考文献:
[1]Lobell D B,Roberts M J,Schlenker W,et al. Greater sensitivity to drought accompanies maize yield increase in the U.S.Midwest[J]. Science,2014,344 (6183):516-519.
[2]Sajedi N A,Ardakani M R,Madani H,et al. The effects of selenium and other micronutrients on the antioxidant activities and yield of corn (Zea mays L.) under drought stress[J]. Physiology and Molecular Biology of Plants,2011,17(3):215-222.
[3]徐洪伟,周晓馥. 玉米毛状根再生植株对水分胁迫的响应[J]. 农业工程学报,2009,25(11): 80-84.
[4]宁 芳,张元红,温鹏飞,等. 不同降水状况下旱地玉米生长与产量对施氮量的响应[J]. 作物学报,2019,45(5):777-791.
[5]Khajeddin S J,Matinkhah S H,Jafari Z. A drought resistance index to select drought resistant plant species based on leaf water potential measurements[J]. Journal of Arid Land,2019,11(4): 623-635.
[6]郭丽丽,张茜茜,郝立华,等. 大气CO2倍增条件下冬小麦气体交换对高温干旱及复水过程的响应[J]. 作物学报,2019,45(6):949-956.
[7]张馨月,王 寅,陈 健,等. 水分和氮素对玉米苗期生长、根系形态及分布的影响[J]. 中国农业科学,2019,52(1):34-44.
[8]满欣雨,郭亚蓉,葛红娟,等. 植物地下部与地上部远端相互调控研究进展[J]. 植物生理学报,2018,54(6):931-942.
[9]Sun X,Lu J,Yang M Y,et al. Light-induced systemic signalling down-regulates photosynthetic performance of soybean leaves with different directional effects[J]. Plant Biol,2019,21(5):891-898.
[10]Zhu M,Li F H,Shi Z S. Morphological and photosynthetic response of waxy corn inbred line to waterlogging[J]. Photosynthetica,2016,54(4):636-640.
[11]Vitale L,Tommasi P,Arena C,et al. Growth and gas exchange response to water shortage of a maize crop on different soil types[J]. Acta Physiologiae Plantarum,2009,96(2):330-336.
[12]麻雪艷,周广胜. 夏玉米叶片气体交换参数对干旱过程的响应[J]. 生态学报,2018,38(7): 2372-2383.
[13]胡明新,周广胜. 拔节期干旱和复水对春玉米物候的影响及其生理生态机制[J]. 生态学报,2020,40(1):1-10.
[14]Xu H W,Zhou X F,Lu J M,et al. Hairy roots induced by Agrobacterium rhizogenes and production of regenerative plants in hairy root cultures in maize[J]. Sci China C(Life Sci),2006,49(4):305-310.
[15]Rotundo J L,Tang T,Messina C D.Response of maize photosynthesis to high temperature: Implications for modeling the impact of global warming[J]. Plant Physiology and Biochemistry,2019,141:202-205.
[16]Wu Y W,Li Q,Jin R,et al. Effect of low-nitrogen stress on photosynthesis and chlorophyll fluorescence characteristics of maize cultivars with different low-nitrogen tolerances[J]. Journal of Integrative Agriculture,2019,18(6):1246-1256.
[17]Liu C C,He N P,Zhang J H,et al. Variation of stomatal traits from cold temperate to tropical forests and association with water use efficiency[J]. Functional Ecology,2017,32(1):20-28.
[18]江晓东,梁红丽,李伟燕,等. 长江下游地区不同播期玉米光合特性研究[J]. 江苏农业科学,2018,46(6):78-81.
[19]Zhao W S,Sun Y L,Kjelgren R,et al. Response of stomatal density and bound gas exchange in leaves of maize to soil water deficit[J]. Acta Physiologiae Plantarum,2015,37(1):1-9.
[20]Blum A. Effective use of water (EUW) and not water-use efficiency (WUE) is the target of crop yield improvement under drought stress[J]. Field Crops Research,2009,112(2):119-123.
[21]Zhou X F,Wu H,Wei X W,et al. The morphological characteristics of regenerative plants of hairy root cultures in maize and its effect on water use efficiency[J]. Journal of Food Agriculture & Environment,2013,11(1):357-360.
[22]徐洪伟,陆静梅,周晓馥.水分胁迫条件下玉米毛状根再生植株耐旱性研究[J]. 农业工程学报,2007,23(7):19-23.

