河北省治疗前人群HIV-1耐药毒株分子传播网络研究
刘 萌,邢 辉,张玉琪,李 岩,王莹莹,安 宁,路新利
高效抗逆转录病毒治疗(Highly active anti-retrovirus therapy, HARRT)可以有效抑制HIV病毒的复制,从而降低HIV感染者/艾滋病患者体内病毒载量,使机体免疫能力得到恢复或部分恢复,因此HARRT可以作为预防HIV病毒传播的有效手段[1],但随着发现即治政策的实施,HARRT范围进一步扩大,HIV-1耐药基因突变已成为治疗效果下降的主要原因[2]。因此加强对抗病毒治疗前人群的HIV-1耐药监测,可以为阻断HIV-1耐药株的传播提供早期预警,并对监控HIV-1耐药毒株传播规律具有重要社会意义。本研究对河北省2018年上半年抗病毒治疗前人群开展了HIV-1耐药毒株流行情况横断面调查,为本省预防HIV-1耐药毒株传播及建立有效耐药预警机制提供参考依据。
1 资料与方法
1.1研究对象 河北省辖区内2018年1月至6月新诊断报告的HIV-1感染者。入组标准为:年龄≥18岁、均未参加抗病毒治疗、本省籍、已提供知情同意书。
1.2研究方法
1.2.1样本采集 使用EDTA抗凝采血管采集研究对象的外周静脉血10 mL,24 h内离心分离血浆,-70 ℃保存备用。同时,收集包括人口学信息、感染途径等流行病学信息。
1.2.2目的基因片段扩增 采用QIAsymphony SP全自动核酸提取仪提取血浆HIV-1 RNA,通过In-house法扩增HIV-1pol区基因(1.3 kb),对应国际标准参考株HXB2的位置为2253-3553b。第一轮RT-PCR外引物扩增以RNA为模板,使用F1a(5′-TGAARGAITGYACTGARAGRCAGGCTAAT-3′, HXB2:2057-2085)和RT-R1(5′- ATCCCTGCATAAATCTGACTTGC-3′, HXB2:3370-3348)引物,按照TaKaRa One Step RNA PCR Kit说明书要求配置反应体系和设置反应条件。第二轮PCR扩增以外引物扩增产物的1∶10稀释液作为模板,以F2(5′-CTTTARCTTCCCTCARATCACTCT-3′, HXB2:2243-2266)和R2(5′-CTTCTGTATGTCATTGACAGTCC-3′, HXB2: 3326-3304)为引物,按照TaKaRaTaq说明书配制反应体系和设置反应条件。扩增产物用1%琼脂糖凝胶电泳进行鉴定,将扩增阳性产物送上海生工生物工程技术服务有限公司进行测序。
1.2.3序列分析 用Sequencher4.10.1软件对原始反应序列进行校对和拼接,用BioEdit7.0软件进行序列比对和整理。使用MEGA 6.0软件构建N-J (Neighbor-joining)系统进化树(bootstrap设定为1000,校验值≥70%判定为同一亚型);将目的基因序列提交斯坦福大学HIV耐药数据库(http://hivdb.stanford.edu),根据2014版WHO耐药监测方案[3],选择耐药数据库全部20种耐药药物进行耐药基因型分析及耐药水平判定;将比对好的序列导入Hyphy2.2.4,利用TN93模型计算所有序列两两之间的基因距离,通过观测不同阈值下传播网络中的传播簇总数和连接总数的变化来确定最适基因距离阈值,序列间基因距离小于阈值表示他们感染密切相关,在网络内会连接在一起,利用Cytoscape3.6.1软件构建HIV-1分子传播网络。
1.2.4统计学分析 利用SAS 9.2软件进行多因素Logistic回归分析,探讨HIV-1耐药相关影响因素。
2 结 果
2.1流行病学特征 在获得目的基因序列的276例HIV-1感染者中,以18~49岁(84.4%,233/276)、男性(94.2%,260/276)、已婚(47.8%,132/276)、汉族(97.1%,268/276)、初高中及中专文化学历(63.0%,174/276),同性性传播途径(75.0%,207/276)为主;CRF01_AE是最主要基因型,占49.6%(137/276),其次是CRF07_BC(29.7%,82/276)、B(9.8%,27/276)、URFs(4.3%,12/276)、CRF55_01B(2.9%,8/276)、CRF08_BC(1.1%,3/276)、CRF68_01B(1.1%,3/276)、CRF65_cpx(1.1%,3/276)和CRF80_0107(0.4%,1/276)。URFs重组模式包括URF_01B(2.9%,8/276)、URF_01C(0.3%,1/276)、未知(1.1%,3/276)。
2.2耐药位点及耐药程度分析 HIV-1耐药率为6.16%(17/276)。其中,NRTI类耐药率为0.36%(1/276),出现耐药的位点为L74I,对阿巴卡韦(ABC)中度耐药、去羟基苷(DDI)高度耐药;NNRTI类耐药率为4.35%(12/276),其中有5例携带耐药位点K103R/V179D,导致依非韦伦(EFV)、奈韦拉平(NVP)中度耐药,利匹韦林(RPV)低度耐药;有2例研究对象对EFV、NVP产生高度耐药;PI类耐药率为1.09%(3/276),耐药突变为M16I/L,对奈非那韦(NFV)产生耐药;NNRTI及PI类药物的双重耐药率为0.36%(1/276);HIV-1耐药突变位点及其耐药程度详见表1。
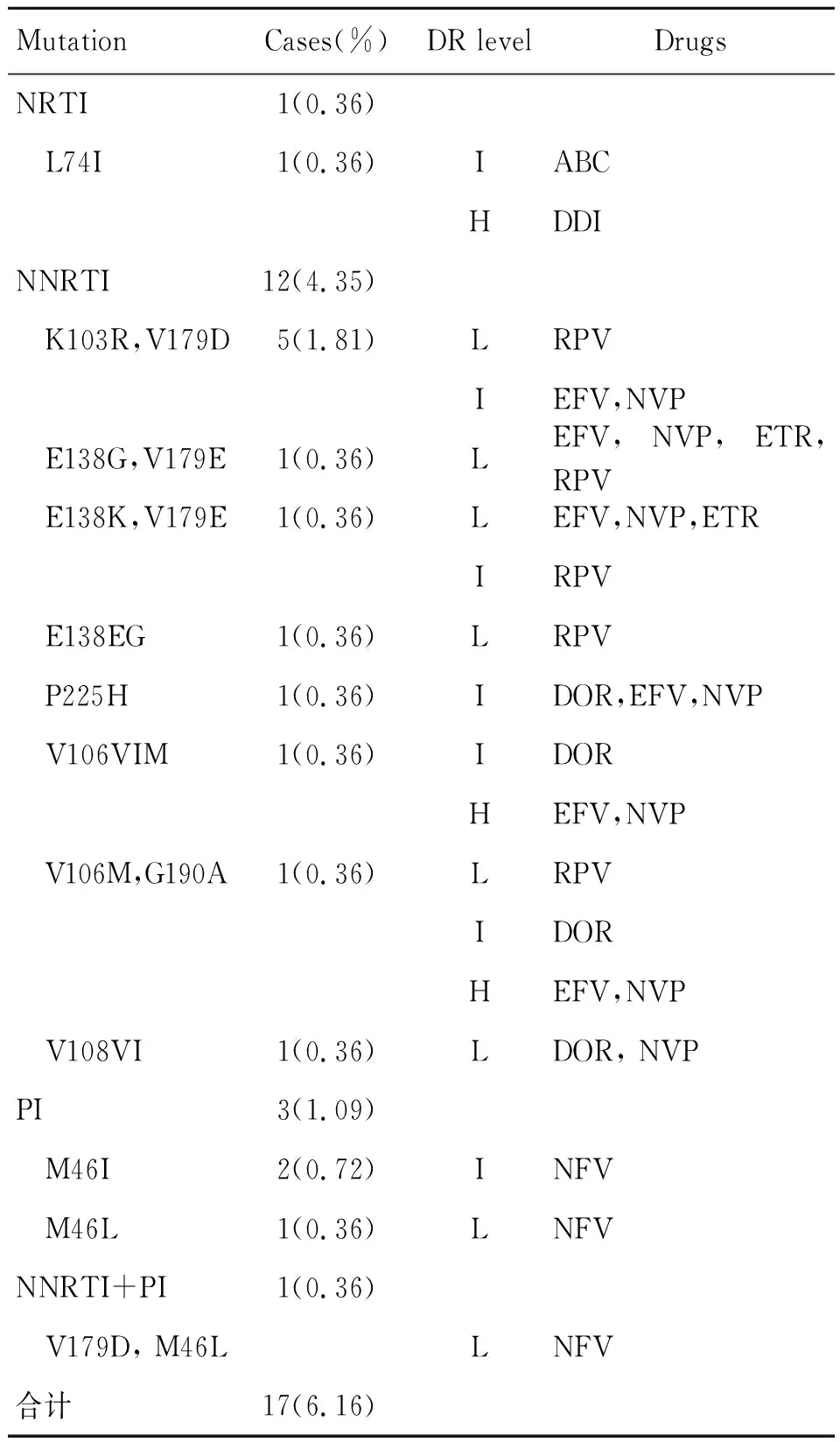
表1 抗病毒治疗前HIV-1耐药突变分析Tab.1 HIV-1 drug resistance mutations before antiviral therapy
2.3耐药影响因素分析 针对性别、民族、婚姻、感染途径、年龄、文化程度、亚型6个变量进行耐药多因素Logistic回归分析(见表2)。 结果显示年龄(P<0.05)和亚型(P<0.05)是HIV-1发生耐药突变的显著性影响因素。18~29岁处于性活跃期的青年耐药发生率最高,达到8.16%,其次是50岁以上的老年人(6.98%);作为河北省主要的3种流行毒株,CRF01_AE亚型耐药率为8.03%(11/137),CRF07_BC亚型耐药率为2.44%(2/82),B亚型耐药率为3.70%(1/27)。而其他变量对耐药突变的影响无统计学意义(P>0.05)。
2.4HIV-1分子传播网络 利用TN93模型计算276条pol基因序列基因距离,在0.5%~2.0%的基因距离间,1.5%基因距离阈值下,传播簇分辨率高且分子网络中能区别的传播簇最多,在此阈值下,构建HIV-1分子网络图,共有95条序列入网,入网率为34.4%(95/276),共鉴别出30个传播簇,其中≥3个节点的传播簇共有9个。CRF07_BC序列在网络中构成比最高,包括9个传播簇,其中1个传播簇包含27个节点,是网络内最大的传播簇,传播风险较高;CRF01_AE序列在网络中共包含16个传播簇,其中发现K103R/V179D耐药突变毒株在沧州地区同性性行为人群构成的三节点传播簇中传播,造成对EFV/NVP中度耐药,RPV低度耐药;M46I耐药突变毒株在张家口地区同性性行为人群构成的两节点传播簇中传播; URF_01B序列在网络中包括2个传播簇(7例),该传播簇携带V106I潜在耐药突变,在保定、沧州地区同性及异性性行为人群构成的五节点传播簇中传播,在石家庄地区同性性行为人群构成的二节点传播簇中传播;B亚型序列在网络中形成1个三节点传播簇,同样携带V106I潜在耐药突变位点。详见图1与表3。

图1 抗病毒治疗前HIV-1分子传播网络图Fig.1 HIV-1 molecular transmission network before antiviral therapy
2.5URF_01B重组亚型鉴定 利用邻接法构建N-J系统进化树(图2),共检出8例(2.90%) URF_01B重组亚型。8例URF_01B与石家庄地区2015年、2018年报道[6-7]的CRF01_AE/B重组亚型独立聚集成簇,校验值为100%,初步判定这8例URFs为CRF01_AE/B重组亚型,通过HIV Database在线RIP 3.0软件对8例URFs的基因序列进行镶嵌结构分析,确定其为CRF01_AE和B亚型重组体。
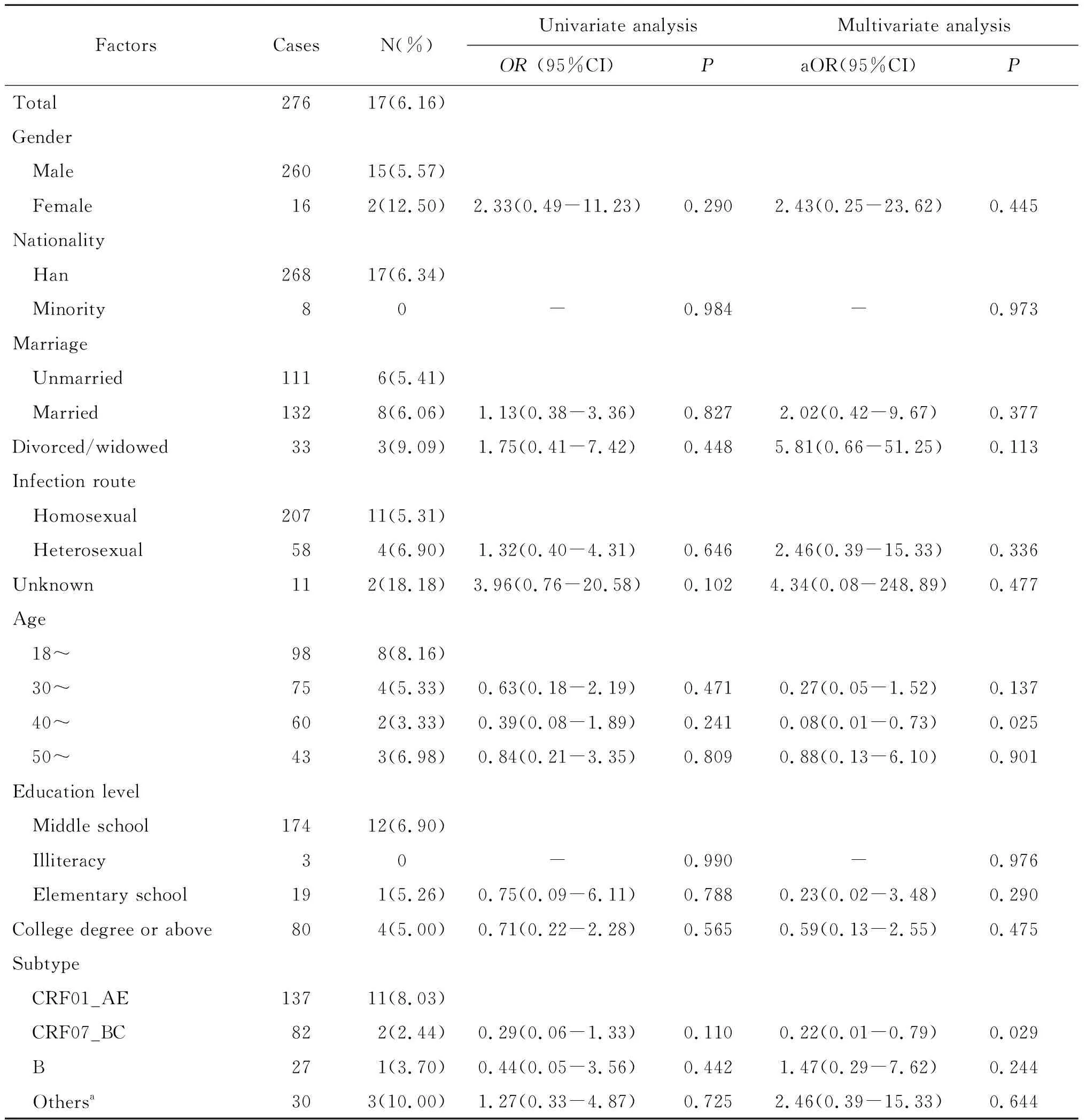
表2 抗病毒治疗前HIV-1耐药影响因素分析Tab.2 Factors influencing HIV-1 drug resistance before antiviral therapy
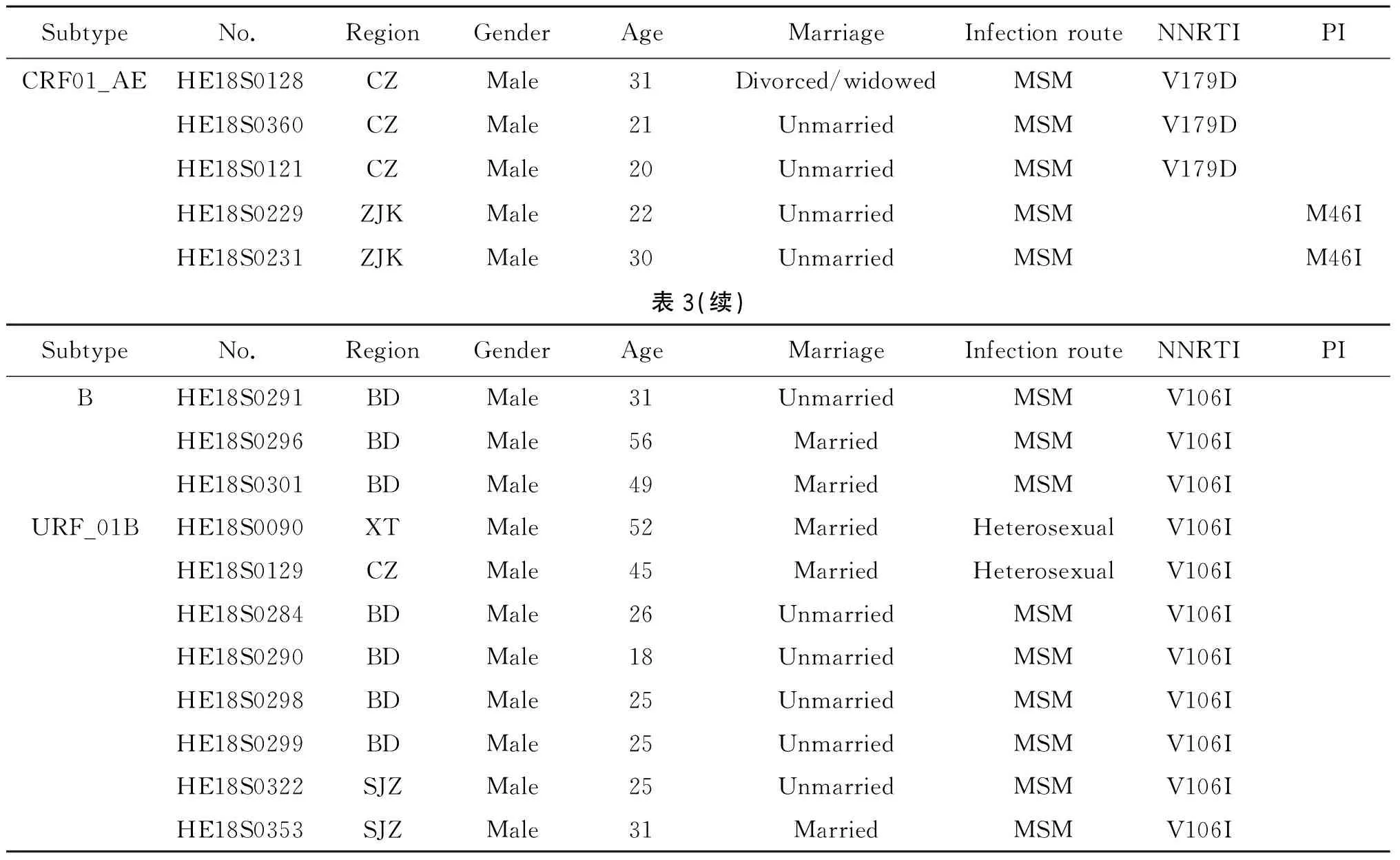
表3 抗病毒治疗前HIV-1分子网络中耐药株情况Tab.3 Information of HIV-1 resistant strains circulating in the molecular network before antiviral therapy

Black dot(●) denotes HIV-1 URF_01B; Black triangle(▲) denotes reference sequences图2 8例URF_01B重组毒株pol区序列Neighbor-Joining进化树分析Fig.2 Phylogenetic tree analysis based on HIV-1 pol gene sequences from URF_01B strains
3 讨 论
本研究结果显示CRF01_AE、CRF07_BC和B亚型是目前河北省前3个主要HIV-1流行毒株,与河北省邻近地区北京和天津市的HIV-1流行毒株流行形式基本一致[4-5]。8例URF_01B与石家庄地区2015年、2018年报道[6-7]的CRF01_AE/B重组亚型独立聚集成簇,在1.5%基因距离阈值下,7例URF_01B序列入网,这7例感染者分布在河北省中部及南部地区的石家庄、保定、沧州的同性传播及异性传播人群中,表明该重组亚型已通过性传播方式发生跨地区传播,且传播关系相对较近。而且,7例URF_01B患者均携带V106I潜在耐药突变位点。
同时证明抗病毒治疗前HIV-1耐药突变发生率为6.16%,低于北京市[4]、河南省[8]等临近省市,与全国耐药数据平均水平基本持平[9]。其中有3例产生高度耐药,10例产生中度耐药,4例产生低度耐药。NNRTI类耐药率最高为4.35%,主要耐药突变为K103R/V179D,对依非韦伦(EFV)、奈韦拉平(NVP)中度耐药,对利匹韦林(RPV)低度耐药;NRTI类耐药率为0.36%,出现耐药的位点为L74I,对阿巴卡韦(ABC)中度耐药、去羟基苷(DDI)高度耐药;PI类耐药率为1.09%,耐药突变为M16I/L,对奈非那韦(NFV)产生耐药;NNRTI及PI类药物的双重耐药率为0.36%,尚未发现三重耐药HIV-1感染者。
CRF01_AE作为目前河北省最主要流行毒株,其在沧州地区同性性行为人群中存在K103R/V179D耐药突变位点的三节点传播簇传播,张家口地区同性性行为人群中存在M46I耐药突变位点两节点传播簇传播,这两簇传播簇同样存在较大的跨地域扩散传播风险。虽然HIV-1耐药突变在CRF07_BC(2.44%)亚型中的分布明显低于CRF01_AE(8.03%)和B(3.70%)亚型,然而CRF07_BC序列构建的分子传播网络最多,传播速度最快。在当前性传播(特别是男男同性传播)已成为河北省主要传播途径的背景下,处在性活跃期的18~29岁青年成为耐药突变产生的影响因素,会加速耐药毒株向外传播。
综上所述,河北省抗病毒治疗前HIV-1耐药毒株传播风险较高,且有新型重组毒株URF_01B携带相关潜在耐药突变位点成簇传播。因此,加强HIV-1耐药毒株分子传播动态监测,实时实施精准治疗和干预措施,对降低耐药突变对抗病毒治疗效果的影响,防止耐药毒株传播具有重要意义。
利益冲突:无

