加减枇杷清肺饮对痤疮模型大鼠耳廓组织炎症的影响
薛兵,任威威,薛思思,杨彩瑞,王迪,方惠敏,成秀梅
痤疮是一种常见的累及毛囊皮脂腺的慢性炎症性皮肤病,大约85%的青少年会受到痤疮的影响,严重者会遗留永久性凹陷瘢痕,给患者的生理和心理带来影响[1]。研究显示炎症反应是诱发痤疮发病的重要因素之一[2]。痤疮炎症的产生与痤疮丙酸杆菌(P.acnes)诱发免疫应答有关,其中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β和干扰素(IFN)-γ等炎性因子在痤疮炎症反应中具有重要促炎和抑炎作用[3-5]。枇杷清肺饮出自《外科大成》,该方治疗痤疮,取得了较好的临床效果[6-7]。为进一步证实这一疗效,本研究通过皮内注射P.acnes构建大鼠耳廓痤疮局部炎症模型,采用枇杷清肺饮加减方对其进行干预,探索其治疗耳廓痤疮的作用机制。
1 材料与方法
1.1 实验动物及主要材料 SPF级Wistar大鼠40只,雌雄各半,体质量(200±10)g,购自河北医科大学实验动物中心。许可证号:SCXK(冀)2018-004;合格证编号:1903089;动物伦理号:DWLL2019011。于河北中医学院科研中心饲养,温度(24±2)℃,相对湿度50%~60%。枇杷清肺饮加减方(枇杷叶9 g,桑白皮9 g,黄芩9 g,黄连6 g,栀子6 g,连翘9 g,金银花12 g,槐花9 g,生山楂12 g,皂角刺6 g,赤芍9 g,浙贝母9 g,甘草3 g)为中药颗粒制剂,购自河北中医学院国医堂;异维A 酸软胶囊(国药准字H10930210)购自上海信谊延安药业;P.acnes(ATCC6919)购自广东省微生物研究所;TNF-α、IFN-γ酶联免疫吸附测定(ELISA)试剂盒分别购自赛默飞生物、优尔生生物;兔TNF-α、IFN-γ 多克隆抗体均购自武汉Abclonal 公司;兔 IL-1β 多克隆抗体购自英国 Abcam 公司;RNA 逆转录试剂盒购自诺唯赞生物。TE2101-L 电子天平(德国Sedoris 公司);DP72 光学电子显微镜购自日本OLYMPUS公司;CV18超声波细胞破碎器购自美国SONIC公司;164-5052 蛋白电泳和转膜转移仪购自美国Bio-rad 公司;ImageQuant LAS-4000 化学发光成像分析仪购自美国GE公司);Nanodrop 2000c 超微量分光光度计、Applied biosystems 7500 qPCR 仪及PCR 试剂购自美国赛默飞世尔公司。
1.2 实验方法
1.2.1 大鼠耳廓痤疮模型制备及给药 将40只大鼠编号后按照随机数字表法分为空白组、模型组、异维A酸组(阳性对照)和枇杷清肺饮组,每组10只。除空白组外,其余3组大鼠均于右耳廓皮内注射痤疮丙酸杆菌混悬液(6×107cfu/mL),每日1 次,每次250 μL/kg,连续注射5 d[8],末次给药后通过表观指标和病理指标判断模型是否建立成功。表观指标变化是痤疮最直接的判定标准,是判定大鼠痤疮模型制备成功与否的核心指标[9]。局部皮肤病理指标是判定大鼠模型成功与否的直接证据[10]。模型建立后表观指标:(1)局部组织增厚、变硬、红肿。(2)局部皮肤隆起呈丘疹、出现脓疱。(3)毛囊口出现黑色角栓,并开放增大。局部皮肤病理:(1)表皮、真皮、皮下组织界限模糊。(2)表皮增厚且过度角化。(3)毛囊皮脂腺增大明显,毛囊漏斗部扩大成壶状并且充满角化物质。(4)真皮层毛细血管明显扩张明显,出现炎症细胞浸润[8]。
模型制备成功后异维A酸组给予异维A酸胶囊,枇杷清肺饮组给予枇杷清肺饮加减方。参照人与动物等效剂量换算法(体表面积换算法)[11],异维A酸软胶囊取6.25倍成人用量(按体质量60 kg 计算为0.5 mg/kg)即3.125 mg/kg,灌胃给药体积为10 mL/kg;枇杷清肺饮加减方成人生药量为1.8 g/kg,Wistar 大鼠按照成人用量的6.25 倍计算,即11.25 g/kg,灌胃给药体积为10 mL/kg。空白组和模型组给予等剂量生理盐水,1次/d,连续给药21 d。
1.2.2 标本收集 末次给药后24 h禁食不禁水,剃除大鼠耳背皮肤周围的毛,腹腔注射10%水合氯醛(3 mL/kg)麻醉。麻醉后开腹,分离腹主动脉,进行腹主动脉采血,于真空促凝采血管静置待凝后,4 ℃、3 000 r/min 离心15 min,留取上清液-80 ℃冰箱保存备用。取病灶部位的耳组织,部分置于4%多聚甲醛溶液固定,另一部分冻存于液氮备用。
1.2.3 大鼠耳廓外观形态变化 给药期间肉眼观察大鼠耳廓痤疮模型的耳外观及形态变化:局部组织是否出现粗糙、增厚;局部皮肤是否出现丘疹、脓疱;皮肤注射处是否出现水肿;毛囊口是否出现黑色角栓。用游标卡尺测量大鼠耳廓厚度,计算耳廓肿胀率。耳廓肿胀率=(注射后耳廓厚度-注射前耳廓厚度)/注射前耳廓厚度×100%。
1.2.4 HE染色观察各组大鼠耳廓组织病理改变 耳廓组织经4%甲醛固定液24 h 后,脱水、透明、浸蜡、包埋、切片制成6 μm 切片,进行常规HE 染色,光镜下观察大鼠耳廓组织的病理改变。
1.2.5 大鼠血清TNF-α、IFN-γ、IL-1β水平检测 将大鼠血清样品、ELISA 试剂盒取出复温,严格按照试剂盒说明书进行操作,以空白对照孔调零后检测450 nm 波长处的光密度(OD)值并根据标准曲线计算TNF-α、IFN-γ、IL-1β水平。
1.2.6 Western blot 检测大鼠耳廓组织TNF-α、IFN-γ、IL-1β蛋白表达 取大鼠耳廓组织研磨制成蛋白匀浆,取上清进行蛋白测定。取相同浓度的蛋白行SDS-PAGE,半干法转膜,5%脱脂牛奶室温封闭2 h,TBST 洗膜后以TNF-α(1∶500)、IFN-γ(1∶800)、IL-1β(1∶500)一抗4 ℃孵育过夜(以GAPDH为内参),次日室温下孵育二抗(1∶1 000)1 h,显影,使用Image J 18.0软件进行图像分析并量化目标条带的灰度值。
1.2.7 qPCR检测大鼠耳廓组织TNF-α、IFN-γ、IL-1β mRNA表达 取大鼠耳廓组织制成组织匀浆,Trizol法提取总RNA。根据逆转录试剂盒说明将提取后的总RNA逆转录为cDNA,再进行qPCR 反应,以GAPDH 作为内参,引物序列见表1。qPCR 反应条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 1 min,40个循环。取循环阈值(Ct),采用2-ΔΔCt法计算表示各基因的相对表达水平。

Tab.1 Real-time fluorescence quantitative PCR primer sequences表1 实时荧光定量PCR引物序列
1.3 统计学方法 采用SPSS 21.0软件进行统计分析。符合正态分布的计量资料以均数±标准差()表示,组内治疗前后各指标的比较采用配对样本t检验,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1 4 组大鼠耳廓外观形态变化 灌胃给药21 d后,空白组大鼠耳廓柔软淡红,毛细血管清晰可见,耳管开口处无粉刺、丘疹、脓疱等皮损;模型组大鼠耳廓颜色暗红,毛囊口增厚、粗糙、干燥,皮肤表面高低不平,兼有散在丘疹、脓疱,注射处真皮上层毛细血管扩张明显;枇杷清肺饮组和异维A 酸组与模型组相比,丘疹、脓疱不同程度减少,毛囊口处略缩小、平整,毛细血管较清晰,见图1。

Fig.1 Changes of auricle in four groups of rats图1 各组大鼠耳廓变化
2.2 4组大鼠耳廓组织病理改变 空白组大鼠耳廓组织未见明显异常,无炎症细胞浸润,表皮各层界限清晰、完整;模型组大鼠耳廓组织可见表皮、真皮、皮下组织界限模糊,毛囊表皮增厚、过度角化,毛囊相互融合,角化物质堵塞毛囊口并且延伸至皮脂腺(箭头示),真皮层毛细血管扩张,炎症细胞浸润毛囊周围;异维A酸组表皮增厚缓解,毛囊口角化减轻,仅有少量炎症细胞浸润;枇杷清肺饮组毛囊扩张和炎症明显减轻,且角化层逐步恢复完整规则,见图2。
2.3 4组大鼠耳廓厚度及肿胀率变化 与空白组比较,模型组大鼠耳廓厚度及肿胀率明显升高(P<0.05);与模型组比较,异维A 酸组和枇杷清肺饮组的大鼠耳廓厚度和肿胀率均出现下降(P<0.05),与异维A 酸组比较,枇杷清肺饮组大鼠耳廓厚度和肿胀率下降(P<0.05),见表2。

Fig.2 Pathological changes of auricle tissues in four groups of rats after treatment(HE stianing,×200)图2 治疗后各组大鼠耳廓组织病理变化(HE染色,×200)
2.4 4 组大鼠血清TNF-α、IL-1β、IFN-γ 水平的变化 与空白组比较,模型组大鼠血清TNF-α、IL-1β水平升高,IFN-γ 水平降低(P<0.05);与模型组比较,枇杷清肺饮组和异维A 酸组大鼠血清TNF-α、IL-1β水平降低,IFN-γ水平升高(P<0.05);与异维A 酸组比较,枇杷清肺饮组大鼠血清TNF-α、IL-1β水平降低(P<0.05),IFN-γ差异无统计学意义(P>0.05),见表3。
2.5 4组大鼠耳廓组织TNF-α、IL-1β和IFN-γ的蛋白和mRNA 表达水平比较 与空白组相比,模型组大鼠耳廓组织TNF-α、IL-1β 的蛋白和mRNA 表达水平均升高(P<0.05),IFN-γ 表达水平降低(P<0.05);与模型组相比,异维A 酸组和枇杷清肺饮组大鼠耳廓组织TNF-α、IL-1β 的蛋白和mRNA 表达水平下降(P<0.05),而IFN-γ 蛋白表达增加(P<0.05),异维A 酸组IFN-γmRNA 表达水平差异无统计学意义(P>0.05),枇杷清肺饮组IFN-γmRNA表达水平增加(P<0.05);与异维A 酸组比较,枇杷清肺饮组大鼠耳廓组织TNF-α、IL-1β 的蛋白表达均有所下降,IFN-γ 的蛋白和mRNA 表达水平均升高(P<0.05),而TNF-α、IL-1βmRNA表达水平无明显变化(P>0.05),见图3、4。
Tab.3 Comparison of serum levels of TNF-α,IL-1β and IFN-γ between four groups of rats表3 4组大鼠血清TNF-α、IL-1β和IFN-γ水平比较(n=10,ng/L,)

Tab.3 Comparison of serum levels of TNF-α,IL-1β and IFN-γ between four groups of rats表3 4组大鼠血清TNF-α、IL-1β和IFN-γ水平比较(n=10,ng/L,)
**P<0.01;a与空白组比较,b与模型组比较,c与异维A 酸组比较,P<0.05
组别空白组模型组异维A酸组枇杷清肺饮组F TNF-α 89.441±5.902 397.001±43.662a 284.702±19.041ab 176.201±5.552abc 30.472**IL-1β 16.451±1.190 50.630±2.294a 35.830±1.672ab 25.301±1.322abc 77.223**IFN-γ 15.573±0.895 4.791±0.221a 10.752±0.591ab 12.901±0.632ab 52.781**

Fig.3 Protein expressions of IFN-γ,TNF-α and IL-1β in auricle tissues detected by Western blot assay图3 Western blot检测各组大鼠耳廓组织IFN-γ、TNF-α和IL-1β蛋白表达
Tab.2 Comparison of auricle thickness and swelling rate after treatment between four groups of rats表2 4组大鼠耳廓厚度及治疗后肿胀率的比较 ()

Tab.2 Comparison of auricle thickness and swelling rate after treatment between four groups of rats表2 4组大鼠耳廓厚度及治疗后肿胀率的比较 ()
**P<0.01;a与空白组比较,b与模型组比较,c与异维A酸组比较,P<0.05
组别空白组模型组异维A酸组枇杷清肺饮组F n t 10 10 10 10耳廓厚度(mm)注射前0.530±0.041 0.522±0.060 0.530±0.051 0.553±0.011 0.811注射后0.540±0.052 0.902±0.111a 0.813±0.031ab 0.682±0.020abc 61.952**0.491 9.593**15.191**18.390**肿胀率(%)2.872±1.640 75.483±30.690a 52.530±12.064ab 25.541±18.580abc 27.874**
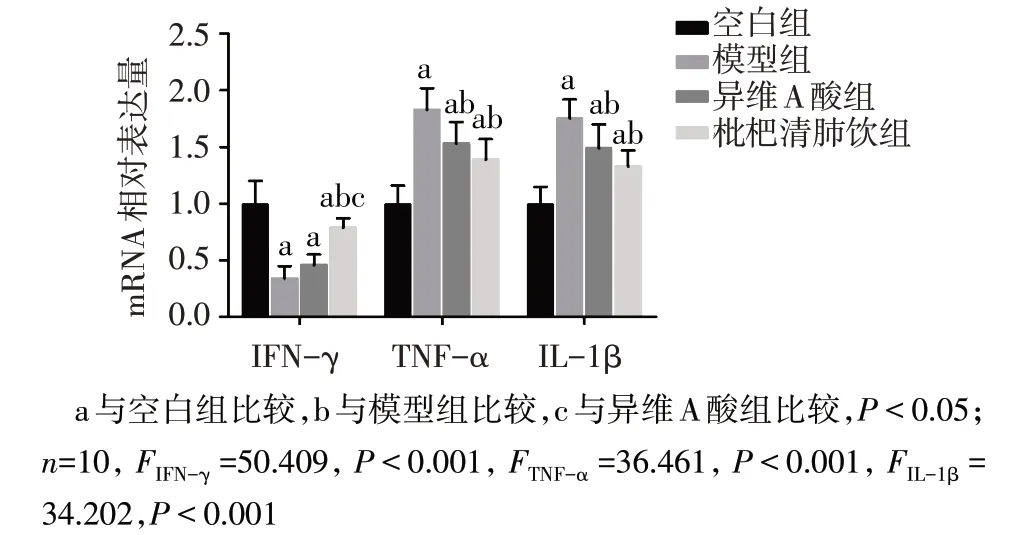
Fig.4 IFN-γ,TNF-α and IL-1β mRNA expressions of auricle tissues detected by qPCR图4 qPCR检测各组大鼠耳廓组织IFN-γ、TNF-α和IL-1β mRNA表达
3 讨论
痤疮是一种慢性炎症性皮肤病,具有常见性和多发性。痤疮通常会遗留凹陷性瘢痕,严重影响了患者的美观和生活质量[12]。现代医学认为其发病与雄激素水平偏高、皮脂腺分泌旺盛、微生物的感染、炎症反应等多种因素相关,其中炎症反应贯穿痤疮发病的始终且P.acnes是痤疮的重要致病菌之一,P.acnes可诱发免疫应答并释放一系列炎症因子,从而导致痤疮炎症反应的出现。其中TNF-α、1L-1β和IFN-γ 炎性因子在痤疮炎症反应中具有重要作用[13-14]。TNF-α 是一种多肽类细胞因子,由单核巨噬细胞产生,是调节机体炎症及免疫应答的重要因子[12]。IL-1β 是一种具有多向性功能的炎症介质,1L-1β 表达升高是痤疮炎症反应的重要标志之一[13]。TNF-α 和1L-1β 通过作用于内皮细胞产生黏附分子来促进炎症细胞向皮肤损伤部位聚集,从而导致炎症反应的出现。IFN-γ是一种免疫调节因子,可以激活巨噬细胞,具有促进组织相容性复合体分子的表达和抗原提呈的作用,可抑制TNF-α、1L-1β等炎症细胞因子的分泌,从而抑制炎症反应[14]。
本实验结果显示,与空白组比较,模型组大鼠耳廓增厚、干燥、粗糙,毛细血管扩张;病理可见表皮明显角化,毛囊上皮与表皮颗粒层均增厚,毛囊口被角化物质堵塞且延伸到皮脂腺,毛囊周围炎症细胞浸润;同时血清和耳廓组织中TNF-α和1L-1β表达升高,IFN-γ表达下降,提示痤疮模型大鼠的耳廓皮肤出现严重的炎症反应,模型建立成功。
中医称痤疮为“粉刺”,《外科正宗·肺风粉刺酒鼻》云:“粉刺属肺,齄鼻属脾,总皆血热瘀滞不散,所谓有诸内、形诸外”,《黄帝内经》云:“痤,疖也,内蕴血肿,形大如枣者”,即痤疮病机为肺经风热、脾胃积热、痰湿瘀热[15]。针对痤疮的病理机制、病变特点以及外在表现,本研究采用加减枇杷清肺饮治疗痤疮,枇杷清肺饮由枇杷叶、桑白皮、黄连、人参、甘草等组成。此方从古至今作为治疗痤疮的名方,相关临床试验均证实了该方治疗痤疮的显著效果[16-17],但是对其机制缺少深入实验研究。为加强此方剂的疗效,本课题组在原方的基础上去掉人参,加入金银花、黄芩、栀子、连翘、山楂、皂角刺、赤芍、浙贝母。方中以枇杷叶、桑白皮、金银花为君药,以黄柏、黄芩、黄连为臣药,以栀子、连翘、山楂、皂角刺、赤芍、浙贝母为佐药,诸药共奏清热解毒,疏散风热,软坚散结之效,疗效颇佳。
本研究结果显示,与模型组比较,枇杷清肺饮组大鼠耳廓变软,变薄,毛细血管较清晰,丘疹、脂栓、脓疱减少;大鼠耳廓组织病理结果显示表皮层变薄,毛囊扩张程度减轻,且炎症细胞的浸润程度明显降低;大鼠血清和耳廓组织中IFN-γ明显升高,TNF-α和1L-1β 明显降低,证实枇杷清肺饮加减方对P.acnes诱导的大鼠耳廓炎症有明确的抗炎作用。现代药理学研究发现,枇杷叶中的主要提取物挥发油、三萜酸类化合物,具有抑菌和抗炎的作用[18];桑白皮中的主要成分总黄酮具有抗炎、抗感染、免疫调节的作用[19];黄连的主要成分是异喹啉类生物碱,具有抗炎抗菌的作用[20]。黄芩提取物主要为黄芩苷,具有抗炎、抗感染的作用[21],上述药物用于临床治疗痤疮,疗效确切,因而进一步证实了枇杷清肺饮加减方对痤疮炎症改善的效果。
综上所述,枇杷清肺饮加减方可能通过抑制TNF-α、1L-1β 的表达和促进IFN-γ 的表达来改善痤疮模型大鼠的症状。本研究为加减枇杷清肺饮治疗痤疮的作用机制的研究奠定了基础,由于P.acne诱导的炎症免疫应答还与Toll样受体(TLR)/核因子(NF)-κB 信号通路相关[22],枇杷清肺饮加减方是否通过影响TLR/NF-κB 信号通路调节炎性因子的表达,有待进一步研究。
——护肾

