化学品固有生物降解性试验OECD标准方法的适用性检验与改进
杨婧,陈晓倩,殷浩文,张瑛,杨希晨,刘亚楠,赵伟刚
上海市检测中心,上海 201202
生物降解性评估是化学品环境行为研究的重要环节之一。实验室条件下的评估主要有快速生物降解(ready biodegradation)、固有生物降解(inherent biodegradation)及模拟生物降解(simulation biodegradation)等3个不同层级。通常在化学品快速生物降解为阴性结果时,进一步的研究评估可直接开展模拟生物降解性研究,也可通过固有生物降解试验进行降解潜能的补充研究。尽管模拟生物降解占据最高评估层级,被认为可为化学品尤其新化学物质降解性评估提供更可靠、准确的基础,但受有效暴露场景选择、低暴露浓度研究及分析条件、试验周期和成本等诸多因素限制,目前多见于科研层面,化学品管理层面的应用相对较少。我国《新化学物质申报登记指南》[1]提出对于不具快速生物降解性的化学品还应提交固有生物降解数据,尚无提交模拟生物降解数据的明确要求。因此,固有生物降解性评估仍是现阶段获知化学品生物降解潜能的实用方法。此外,在高层级化学品风险评估中,固有生物降解数据亦是修改默认降解半衰期参数的依据。
经济合作与发展组织(Organization for Economic Co-operation and Development, OECD)用于评估固有生物降解性的标准方法主要有改进的半连续活性污泥(SCAS)试验(OECD 302A)[2]、赞恩-惠伦斯试验(OECD 302B)[3]及改进的MITI Ⅱ试验(OECD 302C)[4]等3项。其中,OECD 302C方法因可适用于难溶、吸附及弱挥发的化学品生物降解性评估,较前2项仅适合具一定水溶性的非挥发化学品测试的方法而言,OECD 302C方法具更广泛的适用性。然而,OECD 302C方法对接种物要求较为严苛,方法规定:(1) 需定期采集一个城市涵盖受试化学品可能暴露(使用和处置)场景内不少于10个位点的接种物;(2) 通过配制大量人工污水的方式对多位点混合接种物进行至少1个月的驯养;(3) 驯养3个月后需重新补充多位点采集的接种物。接种物采集、驯养和维持成本高于其他生物降解试验且操作复杂程度相对高。已有文献提示,人工污水驯养后的接种物部分碳源利用能力有所下降[5],这可能是导致OECD 302C试验降解能力弱于其他固有生物降解试验[6]的原因之一。另有研究表明,在结果受接种物影响较大的快速生物降解试验中,MITI方法下驯养的接种物生物降解能力相对弱于其他采用活性污泥作为接种物的试验[7],但上述结论是据不同降解方法获取的降解及不降解结果的分布比例推断而来,具一定局限性。尽管已有较多关于接种物对降解试验影响的研究[8-11]以及MITI培养条件下接种物群落结构变化的研究,但均未直接采用多位点采集的接种物进行研究。10位点采集并按照OECD 302C方法驯养后的接种物在群落结构及功能上的变化及其对生物降解性产生的影响,尚无直接且相对明确的研究。
本研究通过Biolog微孔板及磷脂脂肪酸(PLFA)分析对多位点采集驯养前及驯养不同时间的接种物微生物群落变化情况进行研究,并与污水处理厂曝气池采集的单一来源活性污泥样本群落特征进行比较,从群落特征变化角度对多来源的2类接种物进行分析;同时,选择了6种降解能力各异的化学品,比较驯养污泥与活性污泥对上述化学品的降解延滞期和最终降解率等参数,研究接种物对固有生物降解结果的影响。通过上述研究,探讨多来源采集接种物的合理性与必要性以及OECD 302C方法可能的改进。
1 材料与方法(Materials and methods)
1.1 接种物来源
活性污泥采自上海污水处理厂(杨浦、嘉定区的生活污水处理污泥及宝山、奉贤区的工业污水处理污泥)曝气池;驯养接种物为涵盖3种不同生态类型环境水体(淀山湖、川杨河及苏州河、长江口)的水样、2种类型活性污泥(同上述活性污泥来源)以及3种土样(农用土、湿地土及园林土),混和后参照OECD 302C[4]方法驯养后使用。
1.2 主要仪器及试剂
微生物鉴定仪(MicroStation,Biolog公司,美国),安捷伦气相色谱(Agilent 6890N,安捷伦公司,美国),BOD分析仪(Oxitop,WTW公司,德国),恒温培养箱(MI-250A,STIK公司,中国)。
GN(Gram-negative,革兰氏阴性)/GP(Gram-positive,革兰氏阳性)微孔板(Biolog公司)(用于革兰氏阴/阳性好氧菌分析),ATP标准试剂及微生物细胞活性检测试剂盒(Promega公司),脂肪酸标样(上海恒奇生物有限公司)。
脂肪酸抽提试剂(见1.3.2)及固有生物降解实验用化学品(见1.3.3)均为分析纯,分别购自西格玛奥德里奇(上海)贸易有限公司和上海万宏生物科技有限公司。
1.3 实验方法
1.3.1 Biolog微生物群落分析
选取采集自生活污水处理厂及工业污水处理厂的2个批次的污泥样本各1份,2个批次的驯养接种物分别取驯养0 d(即多位点采集接种物混合当天)、7 d、14 d及1个月的接种物各1份,以灭菌的0.85%(m/V)NaCl溶液离心清洗上述污泥样本2次(4 000 r·min-1、4 ℃,10 min)后,用0.85%(m/V)的NaCl溶液搅拌后,重悬接种物至相同细菌细胞数(即活菌数约1010个·L-1),采用ATP法进行活菌计数[12]。2号滤纸过滤后,滤液分别接种至Biolog GN2及GP2微孔板,每孔150 μL菌液,每个样本设置2个重复。置于恒温培养箱中(25±1) ℃培养48 h后,在590 nm处读数并记录每孔的光吸收值。
1.3.2 磷脂脂肪酸(PLFA)分析
取1.3.1中污泥及接种物样本进行PLFA抽提,提取方法如下。(1)提取与分离:污泥离心(4 000 r·min-1、4 ℃,20 min)后,取约0.5 g置于20 mL离心管中,根据《SHERLOCK微生物鉴定系统操作手册》上所述方法进行抽提,分别采用试剂1(mNaOH∶V甲醇∶V蒸馏水=45 g∶150 mL∶150 mL)进行皂化、试剂2 (VHCl∶V甲醇=325 mL∶275 mL)进行甲基化、试剂3(V正己烷∶V甲基叔丁醚= 200 mL∶200 mL)萃取及试剂4(质量分数2%的NaOH溶液)洗涤后,取顶部2/3溶液加入气相色谱进样品瓶中,压盖待分析。通过微生物鉴定系统(Microbial Identification System, MIDI),采用带有MIDI峰识别软件的Agilent N6850气相色谱进行PLFA分析,系统根据各组分保留时间与标样保留时间的比较自动识别目标组分。
1.3.3 固有生物降解试验
采用驯养1个月的驯养接种物与生活污水处理厂采集的污泥进行苯甲酸钠、二甘醇、3,5-二叔丁基-4-羟基苯丙酸异辛酯(简称为AO-1135)、1,4-双(氨基甲基)环己烷(简称为BAMCH)、N-[4-(磺酰胺)苯基]甲基丙烯酰胺(简称为ASPMAA)和2-羟基-4-甲氧基二苯甲酮-5-磺酸(简称为BP-4)等6种化学品的固有生物降解试验,试验参照OECD 302C方法[4]进行,培养温度为(25±1) ℃,试验周期为28 d。固有生物降解曲线采用GraphPad Prism 5软件进行拟合。
1.4 数据处理方法
1.4.1 Biolog结果数据处理
(1)碳源利用活性
一位被访者谈及他们的殡仪馆硬软件设施时这样描述:“您不知道,我们殡仪馆晚上看过去就像一个高级宾馆一样,灯火通明。但引进的软件只有我一个人会使用,所以,平时日常工作,我会很累。很多任务压在我的身上,有些可以教会他们,有些只能在下午大家休息时,我再专门去做。”
采用微平板平均每孔颜色变化率(average well color development, AWCD)作为反映接种物微生物利用单一碳源的能力。GN及GP板计算公式为:
AWCD=[∑(Ci-R)]/95
(1)
式中:Ci为反应孔所测得的光吸收值,R为对照孔A1的光吸收值。
(2)多样性指数
采用Shannon-Wiener指数(H’)反映物种丰富程度,计算公式为:
H’=-∑(Pi×lnPi)
(2)
式中:Pi为第i孔的相对吸光值与整个平板相对吸光值总和的比率;以Shannon均匀度(E)衡量群落及种间个体分布均一程度,计算公式为:
E=H’/lnS
(3)
式中:S为颜色变化孔的数目。
1.4.2 PLFA分析结果数据处理
采用峰面积归一化法计算各组分相对含量。采用Origin 2018软件对活性污泥及驯养接种物样本各组分含量特征进行主成分分析(Principal Component Analysis, PCA)。
生物降解数据的处理方式参照OECD 302C方法[4]进行。
2 结果(Results)
2.1 Biolog微生物群落分析
1.3.1中所述驯养0 d(即混合当天)、7 d、14 d及1个月的接种物与工业及生活污水处理厂采集的活性污泥样本在Biolog GN2及GP2这2种微孔板中的AWCD、Shannon-Wiener指数及Shannon均匀度如表1所示。从反映微生物碳源整体利用能力及代谢活性的AWCD值来看,GN板(革兰氏阴性菌分析用)经48 h培养后,驯养0 d(即混合当天的接种物)及7 d的接种物AWCD分别为0.596±0.0988及0.859±0.390,均高于生活污水处理厂与工业污水处理厂采集的污泥的AWCD值,其值分别为0.144±0.0377及0.227±0.0834,驯养7 d的接种物比驯养0 d的接种物碳源利用活性增强;但随驯养时间的增加,驯养接种物碳源利用活性反而出现下降,驯养14 d及1个月的AWCD值分别降低为0.254±0.0377及0.244±0.0259。t-test双侧检验结果显示,驯养0 d及7 d的接种物碳源利用活性明显高于其他组别接种物(P值为0.0230~0.0447,P<0.05),但二者之间无碳源利用活性上的明显差异(P=0.453,P>0.05);驯养14 d及1个月的接种物与生活污水处理厂与工业污水处理厂采集的活性污泥碳源利用活性无显著性差异(P值为0.0991~0.718,P>0.05)。此外,反映微生物多样性程度及各类微生物分布数量的微生物群落多样性(H’)及均匀度指数(E)也在驯养7 d时达到最高值,驯养14 d及1个月的接种物的微生物群落的H’及E值低于驯养0 d、7 d的接种物、污水处理厂采集的活性污泥。
GP板(革兰氏阳性菌分析用)的AWCD值变化表明,驯养接种物的碳源利用活性亦在驯养7 d时达到最高值,驯养14 d及1个月后活性随驯养时间增加而下降。与GN板略不同的是,驯养14 d的接种物活性仅略低于驯养0 d及7 d的接种物,而驯养1个月的接种物碳源利用能力下降,明显低于驯养7 d的接种物(P=0.0379,P<0.05)。驯养1个月的接种物与污水处理厂采集的活性污泥在代谢活性上没有明显差异(P值为0.792~0.916,P>0.05)。驯养7 d的接种物H’及E值最高,驯养1个月后的接种物反而出现下降,H’及E值低于其他组别的驯养接种物,也低于污水处理厂采集的活性污泥。
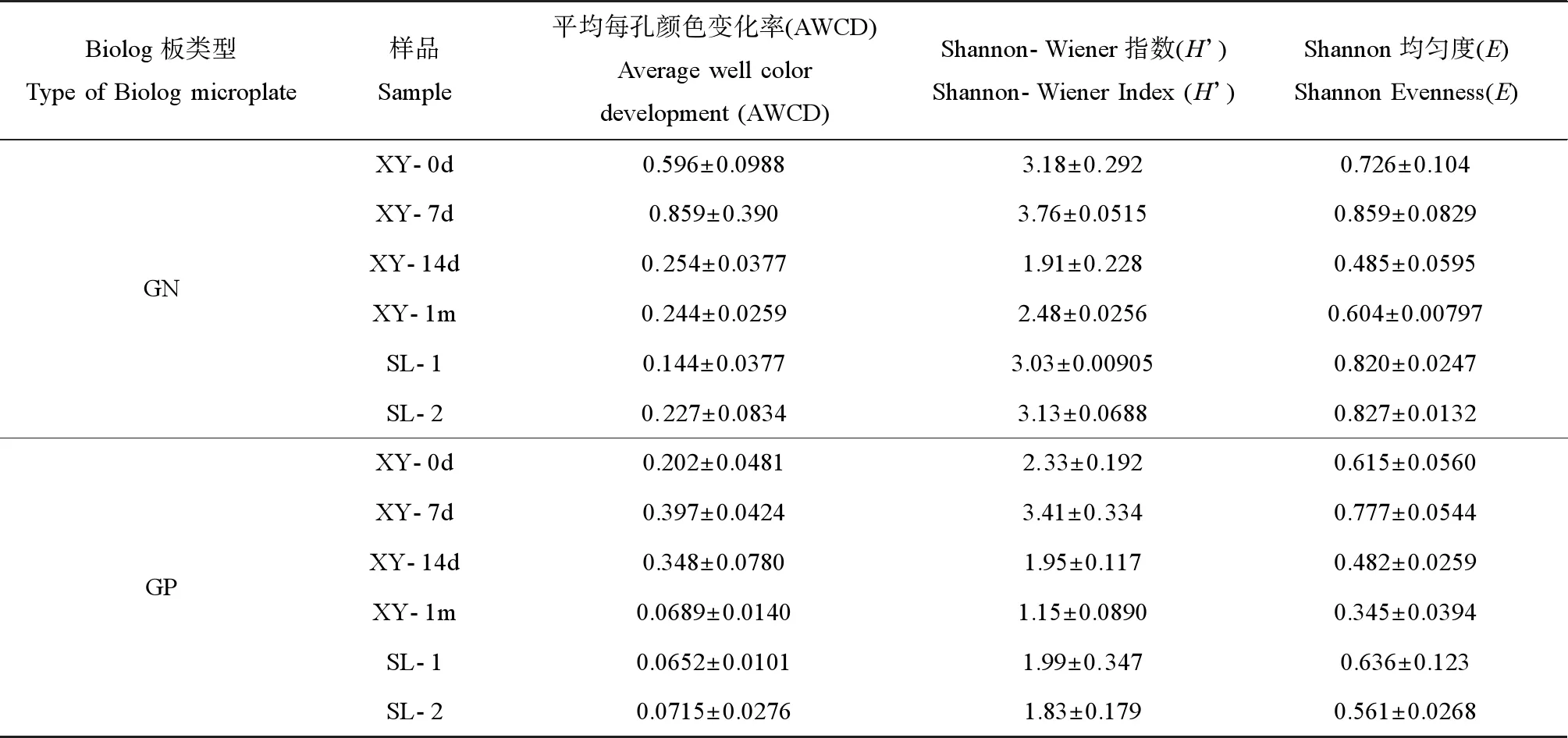
表1 不同接种物中微生物的碳源利用活性及群落多样性指数比较Table 1 Comparison of microbial utilization of carbon sources and community diversity index in different inoculum
2.2 PLFA分析
PLFA组成差异一定程度反映不同接种物中活体微生物的不同类群生物量及总体生物量的差异。不同接种物(见1.3.1所述)PLFA组成主成分分析结果如图1所示。PC1和PC2分别代表了52.7%和10.4%的差异,结果大致分布于3个区域。其中,驯养0 d与驯养7 d的驯养接种物分别分布在2个不同区域中,表明这2种接种物之间在PLFA组成上均存在较大差异;另一个区域中,分布有驯养14 d、1个月的驯养污泥以及生活及工业污水处理厂采集的活性污泥等不同类型的接种物,表明从PLFA组成来看,这几种接种物间的区分度略低,但其组成与驯养0 d及7 d的驯养接种物存在一定差异,尤其与驯养7 d的驯养接种物微生物组成上差异较大。
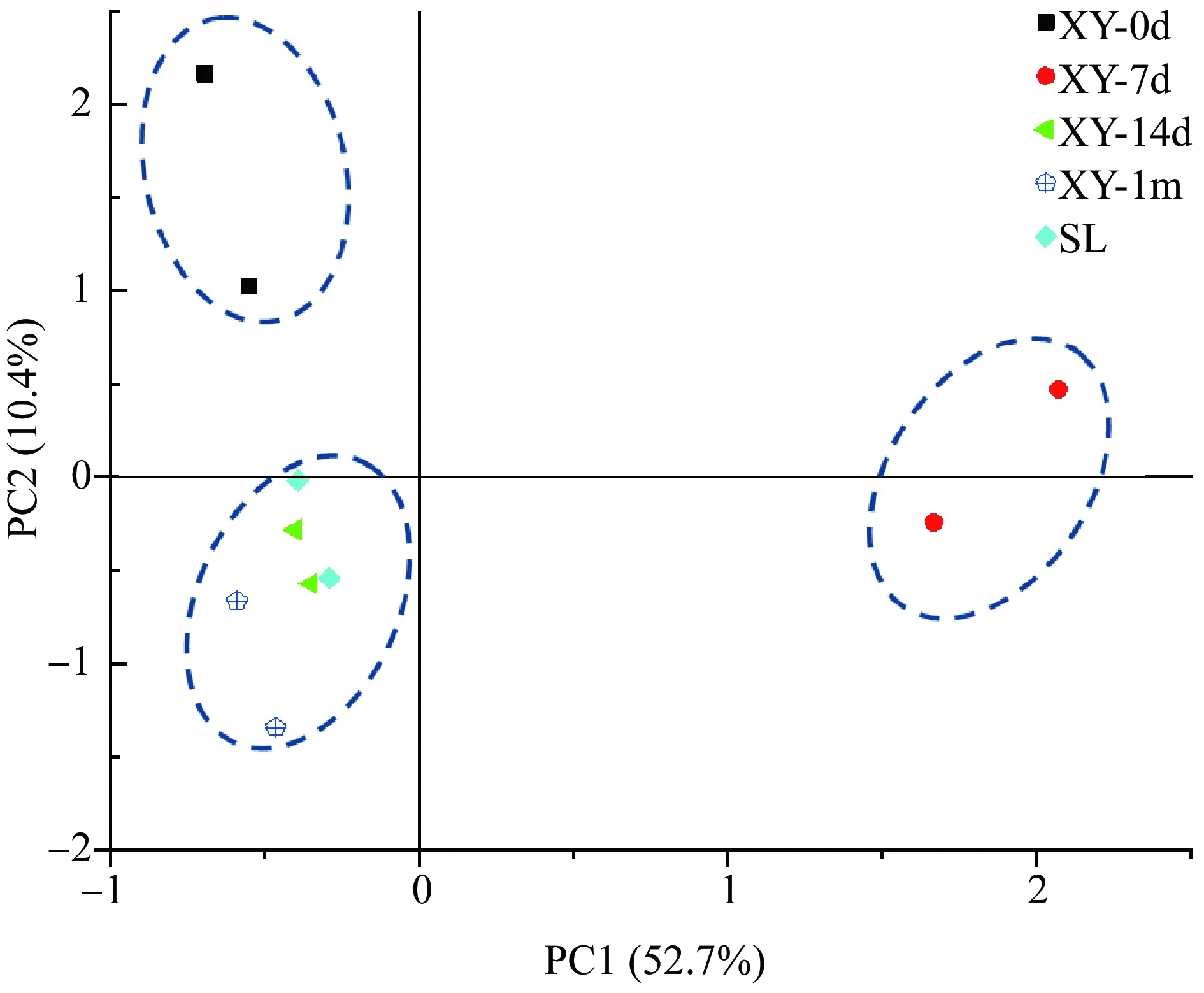
图1 不同接种物磷脂脂肪酸(PLFA)组成主成分分析注:XY为驯养接种物,标号中的0d、7d、14d及1m分别表示多位点接种物混和后驯养0 d、7 d、14 d及1个月;SL为活性污泥(采集自生活污水处理污泥和工业污水处理污泥)。Fig. 1 PCA analysis on phospholipid fatty acid (PLFA) composition of different inoculumNote: XY is the domesticated inoculum, and 0d, 7d, 14d and 1m are the mixed inoculum collected from different places and domesticated for 0 d, 7 d, 14 d and 1 month respectively; SL is activated sludge (collected from domestic sewage treatment plant and industrial sewage treatment plant).
2.3 驯养污泥与活性污泥的固有生物降解试验
按OECD 302C标准实验方法,分别采用驯养1个月的驯养污泥与生活污水处理厂曝气池采集的活性污泥对6种降解能力各异的物质开展固有生物降解试验,各平行组之间的降解率差异<20%,故采用平均生物降解率绘制固有生物降解曲线(图2)。固有生物降解结果表明,2种接种物对于6种化学品的生物降解能力处于相近水平:对可固有生物降解的化学品苯甲酸钠及二甘醇的生物降解率为81%~85%,均超过固有生物降解的判定水平(降解率达70%)。2种接种物对化学品ASPMAA、BP-4的固有生物降解率分别为29%~31%及20%~28%,具初步固有生物降解迹象;对化学品AO-1135和BAMCH的生物降解率分别为12%~14%及5%,未表现出固有生物降解能力。
进一步采用GraphPad Prism 5软件非线性拟合2种接种物对6种化学品的降解曲线,拟合度(R2)在0.83~0.99之间,驯养污泥对苯甲酸钠、二甘醇、AO-1135、BAMCH、ASPMAA和BP-4等6种化学品的降解延滞期分别为0.42、2.2、13、>28、7.2和5.4 d;活性污泥对上述6种化学品的降解延滞期分别为0.51、1.7、13、>28、9.1和11 d,活性污泥对6种化学品的降解延滞期普遍长于驯养接种物。
而从曲线拟合获取的最终降解率与试验获得的实测值计算而来的28 d降解率(图2)相近,曲线拟合后,驯养接种物对上述6种化学品的最终降解率分别为78%、82%、14%、4.9%、32%和28%;活性污泥对6种化学品的最终降解率分别为84%、84%、17%、5.4%、34%和30%。活性污泥对6种化学品的最终降解率略高于驯养1个月的接种物。
3 讨论(Discussion)
Biolog分析反映群落代谢活性,可评估微生物群落功能的多样性。接种物浓度对Biolog分析结果影响较大[13],因此,为保证结果的准确性与可比性,本研究在进行Biolog微孔板接种前,将各接种物的活菌细胞数统一调节至相近水平(即活菌数约1010个·L-1)。10个位点采集接种物在未驯养时(多点采集混合初期,即驯养0 d)及驯养7 d时碳源利用活性均高于污水处理厂曝气池采集的活性污泥,驯养0~7 d,驯养接种物代谢活性增强,驯养7 d时,微平板平均每孔颜色变化率(AWCD)及Shannon-Wiener指数(H’)及Shannon均匀度(E)达到最高,表明驯养7 d后接种物的代谢活性、微生物种类及数量都达到最佳状态,而驯养14 d后接种物代谢活性则反而出现下降,尤其驯养1个月后的接种物,活性下降尤为明显,与污水处理厂采集的污泥无明显差异。驯养14 d尤其1个月的驯养接种物其微生物多样性程度及各类微生物分布数量均弱于污水处理厂采集的活性污泥。

图2 2种不同接种物对6种化学品的固有生物降解曲线注:XY-1m为驯养1个月的接种物;SL为采集自生活污水处理厂的活性污泥;AO-1135、BAMCH、ASPMAA和BP-4表示3,5-二叔丁基-4-羟基苯丙酸异辛酯、1,4-双(氨基甲基)环己烷、N-[4-(磺酰胺)苯基]甲基丙烯酰胺和2-羟基-4-甲氧基二苯甲酮-5-磺酸。Fig. 2 Inherent biodegradation curves of 6 chemicals by using two different inoculumNote: XY is the domesticated inoculum (with 1-month domestication); SL is activated sludge (collected from domestic sewage treatment plant); AO-1135, BAMCH, ASPMAA and BP-4 stand for Antioxidant 1135, 1,4-cyclohexanediamine, N-[4-(aminosulfony1)phenyl]methacrylamid and 2-hydroxy-4-methoxybenzophenone-5-sulfonic acid.
PLFA分析反映活微生物群落结构多样性,结果表明,驯养0 d及7 d的接种物与驯养14 d、驯养1个月的接种物以及污水处理厂采集污泥的脂肪酸类型上存在一定差异,尤其驯养7 d的接种物,与其他类型的接种物存在较为明显的差异,该结果与Biolog结果较为一致。综上,可推测按照MITI方法驯养7 d的接种物可能具有较高的微生物活性及群落多样性,而驯养7 d的接种物受接种物生长速度的限制,总量非常有限,难于满足降解试验的要求,考虑研究成本及实际可操作性,未对驯养7 d的接种物进行进一步研究。
基于上述结果,结合OECD 302C方法接种物至少驯养1个月(不超过3个月)的要求,进一步研究了驯养1个月的接种物与污水处理厂采集活性污泥对6种降解性各异物质的生物降解情况。通常认为化学品的生物降解性或持久性是化学品自身的内在属性,而在化学品持久性的实验室方法评估层面,不能简单将结果概括为化学品的固有属性,尤其对于不具快速生物降解性而又未显示出持久性迹象的化学品,结果往往受接种物细胞密度、微生物群落多样性、化学品与微生物的比例等因素影响[14]而存在较大变化。因此,本研究在固定的接种物浓度与化学品暴露浓度下,进行6种化学品的固有生物降解性研究。结果表明,活性污泥对苯甲酸钠、二甘醇、AO-1135、BAMCH、ASPMAA和BP-4等6种化学品的降解延滞期普遍长于驯养污泥,而对6种化学品的最终降解率则普遍略高于驯养1个月的污泥,但最终降解率上的微弱差异并未构成固有生物降解性结果判定层面的差异。本实验室的另一项关于驯养污泥及污水处理厂采集的活性污泥在模拟生物降解中的比较研究[15]也有类似发现,即驯养污泥对聚乙二醇400及BP-4这2种化学品有较短的延滞期,但2种接种物在最终的生物降解能力上无本质差异。
综上,多位点采集、驯养1个月的接种物(OECD 302C方法)与污水处理厂新鲜采集的活性污泥相比,未表现出更优的微生物多样性、代谢活性及固有生物降解能力。鉴于驯养14 d起,驯养接种物活性及多样性随驯养周期延长而下降,驯养1个月后的接种物已完全不具有多点采样混合当天(即驯养0 d)接种物的群落特征,故认为OECD 302C方法驯养的接种物难以代表实际环境中多来源接种物对化学品的降解能力,10点采集、驯养至少1个月的接种物用于固有生物降解研究的处置方法未见合理性及必要性。相对OECD 302C方法中的驯养污泥而言,新鲜采集自污水处理厂曝气池的活性污泥则是真实环境来源的接种物。已有研究表明,出水稳定、运行良好的污水处理厂的活性污泥的菌群结构具有相似性[16]。因此,笔者认为,使用新鲜采集自运行良好的污水处理厂的活性污泥代替驯养污泥进行OECD 302C固有生物降解性评估同样可能获取稳定、可重复的降解结果,并且因其源自真实环境,与环境相关性更强,可能更有效地预测化学品在环境中的生物降解情况。
后续研究将尝试在OECD 302C体系中,增加活性污泥浓度、降低受试化学品浓度[17]以及延长暴露时间等,以便实现对化学品的环境持久性的进一步预测。同时,针对学者提出实验室条件下开展302B、302C等固有生物降解研究中,矿质培养基难以模拟实际环境中多种碳源共存时的共代谢情况[18],尝试实验室条件多种碳源添加对降解结果的影响研究。此外,近年来提出采用“可能性”方法(“probability approach”或“Probabio”)判定化学品持久性的新思路,即通过实际环境接种物,以不同的接种浓度、受试浓度进行一系列降解性研究,通过最大可能数(MPN)来评估化学品的持久性[19]。上述研究将把生物降解试验最终引入微量化及高通量的层面,而以OECD 302C这一相对成熟、适用范围广且易于实现自动化操作的体系为基础,采用活性污泥作为接种物开展MPN研究,极大降低了操作成本,缩短了研究周期,在相对更大且易操作的体系中尝试方法的改进并开发研究更敏感的新终点,是快速获取并积累数据、实现与高通量研究数据间的比较并最终实现有效的微体积、高通量化学品持久性判别筛选方法的研发、评估、验证及改进的有效桥梁。
致谢:感谢上海市检测中心刘敏博士在文章修改中给予的帮助。

