石墨烯量子点负载姜黄素与人血清白蛋白作用研究
张秋兰, 朱 智, 洪 洋, 倪永年
(南昌大学化学学院,江西南昌 330031)
姜黄素(Cur)是酸性多酚类化合物,其主链含有芳香族基团和不饱和脂肪链,可用作酸碱指示剂和肉类食品着色剂,同时具有抗氧化、抗炎、降脂、消除自由基抗衰老、抗动脉粥样硬化及抑制肿瘤生长等药理作用[1]。但Cur存在靶标性不强,弱的血脑屏障通过能力和生物利用度低等缺点,目前临床上通过引入羧基、乙酰化、氢化等结构修饰增加Cur水溶性,但这种做法降低了药物的活性和药效[2,3]。
纳米药物载体具有靶向给药、高效负载和药物释放可控等优点,已成为生物医药和纳米技术的研究热点,在医学领域具有很好的应用潜力[4,5]。已有研究碳纳米材料与人血清白蛋白(HSA)的相互作用的报道[6]。前期研究发现氧化石墨烯的存在使喜树碱和牛血清白蛋白的结合率增大,利于喜树碱在体内的运输和分布[7]。石墨烯量子点(GQDs)作为一种碳纳米材料具备优良的细胞相容性和良好的负载作用。本文将Cur负载在GQDs上,充分结合GQDs低细胞毒性、高生物相容性和跨膜转运等能力,以及Cur抗炎、抗氧化和抗纤维化等优点,研究GQDs作为Cur的载体与HSA的作用,为GQDs作为药物载体研究提供有意义的信息。
1 实验部分
1.1 仪器与试剂
F4500荧光分光光度计(日本,日立),配1.0 cm荧光比色皿,扫描速度为1 200 nm/min,狭缝宽度EX=5 nm,EM=10 nm。MOS 450 CD光谱仪(法国,Bio-Logic公司)。ZC-10智能型超级恒温水槽(宁波天恒仪器厂)。Agilent 8453紫外-可见光光度计。所有实验(除温度实验)都在室温25 ℃下完成。
人血清白蛋白(HSA,北京索莱宝科技有限公司,纯度96%~99%):称取0.1994 g HSA,加入4 mL水溶解,得到7.5×10-4mol/L HSA溶液。姜黄素(Cur,成都艾科达化学试剂有限公司,纯度96.0%):称取0.0092 g Cur,依次加入5.0 mL乙醇和5.0 mL水得到2.5×10-3mol/L Cur溶液。石墨烯量子点(GQDs,南京先丰纳米材料科技有限公司,90%,<10 nm):吸取3 mL 1.282×10-2mol/L的GQDs溶液,加入水稀释成1.0×10-2mol/L的GQDs溶液备用。Tris-HCl缓冲溶液(pH=7.4):称取6.055 g三羟基甲基氨基甲烷(Tris,上海生工生物工程股份有限公司),溶于水后,再移入250 mL的容量瓶中定容,得到0.2 mol/L的Tris溶液,取62.5 mL于250 mL容量瓶中,再加入112.5 mL 0.1 mol/L的HCl,用水定容。实验用水为二次蒸馏水。
1.2 实验方法
1.2.1 紫外-可见吸收光谱在Tris-HCl缓冲溶液(pH=7.4)中,分别测Cur(1.67×10-6mol/L)和GQDS溶液(5.00×10-6mol/L)的紫外-可见吸收光谱;再测Cur和GQDS两者复合物的紫外-可见吸收光谱(cCur=1.67×10-6mol/L,cGQDs=5.00×10-6mol/L)。
1.2.2 荧光光谱在比色皿中加入3 mL pH=7.4的Tris-HCl缓冲溶液,根据以下实验加入适量的HSA、Cur和GQDs。因实验中加入的试剂体积远小于初始溶液的体积,体积稀释效应可忽略。激发波长为280 nm,发射波长为250~500 nm。
实验1:在温度298 K下,固定Cur的浓度(1.67×10-6mol/L),加入GQDs溶液(cGQDs=0~6.67×10-6mol/L,间隔3.33×10-7mol/L)。
实验2:固定HSA的浓度(2.50×10-6mol/L),加入Cur溶液(0~6.67×10-7mol/L,间隔8.33×10-8mol/L),分别在温度298 K、302 K和306 K下测其荧光光谱。
实验3:固定HSA和GQDs的浓度(2.50×10-6mol/L),加入Cur溶液(0~6.67×10-7mol/L,间隔8.33×10-8mol/L),分别在温度298 K、302 K和306 K下测其荧光光谱。
实验4:共振光散射(RLS)是通过同步扫描激发和发射光谱(Δλ=0 nm),于波长范围200~700 nm的荧光得到(cGQDs=5.00×10-6mol/L,cCur=1.67×10-6mol/L,cHSA=5.00×10-6mol/L)。
1.2.3 圆二色谱在pH=7.4的Tris-HCl缓冲溶液中,固定HSA的浓度(4.40×10-6mol/L),分三次加入GQDs溶液(cGQDs=0~12×10-6mol/L,间隔4.00×10-6mol/L);再分两次加入Cur溶液(cCur=4.00×10-6mol/L和8.00×10-6mol/L)。进行远紫外区(200~250 nm)的圆二色谱扫描,扫描速率1 nm/s,每点扫描时间为2.5 μs,狭缝宽为1 nm,298 K下重复扫描3次取平均值。
1.2.4 多维曲线分辨-交替最小二乘法(MCR-ALS)MCR-ALS是较好的数据矩阵解析方法,能为实验现象不明显或光谱重叠严重的作用体系提供各组分定性和定量信息[8]。一般来说,计算前可先用渐进因子分析(EFA)[9]确定体系的组分数,再用EFA得到的浓度初值作为初始的迭代矩阵,由交替最小二乘法(ALS)估算各组分的光谱矩阵,再计算出体系中各组分浓度矩阵并用于下一循环迭代,直到收敛。
2 结果与讨论
2.1 Cur与GQDs相互作用的紫外-可见吸收光谱
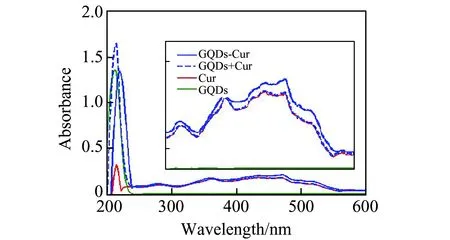
图1 GQDs和Cur、Cur与GQDs作用的紫外-可见(UV-Vis)吸收光谱Fig.1 UV-Vis absorption spectra of GQDs,Cur and Cur with GQDs
由图1可见,在30~600 nm波长内,Cur出现了几个相对较弱的吸收峰,而GQDs的吸收峰不明显,只在波长220 nm处有一肩峰。比较Cur和GQDs的吸收光谱加和线(蓝色虚线)与GQDs-Cur复合物吸收光谱(蓝色实线),两者相差较大,说明两者之间不只是简单的吸附作用,还可推断Cur可通过π-π堆积作用在GQDs的表面与之形成复合物[10]。由于Cur分子的芳香特性以及水溶性较差,它们之间的相互作用可能伴有疏水作用。
2.2 Cur与GQDs相互作用的荧光光谱
Cur自身荧光出现在453 nm处,加入GQDs后体系荧光增强(图2(a))。这种荧光增强作用很有可能是GQDs和Cur因π-π堆积作用形成Cur-GQDs复合物所致。为获得负载过程更多的信息,采用MCR-ALS对光谱数据进行解析。首先由渐进因子分析(EFA)确定体系的组分数为3,对应Cur、GQDs和Cur-GQDs复合物。由EFA还可得到浓度初值,进而采用MCR-ALS进行迭代计算,最后得到三种物质的相对浓度变化趋势曲线(图2(b))。随着GQDs的加入,Cur的相对浓度不断降低,而Cur-GQDs的浓度则不断增大,至[GQDs]∶[Cur]=3时,体系达到平衡。体系中GQDs的相对浓度逐渐增大,这说明体系中存在没有反应的GQDs。由MCR-ALS分析结果表明,Cur可与GQDs形成GQDs3-Cur复合物。
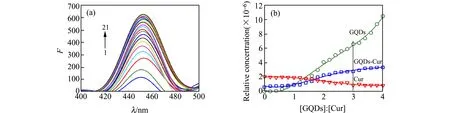
图2 (a)GQDs反应的荧光光谱;(b)MCR-ALS解析的浓度趋势图Fig.2 (a)The fluorescence spectra of the interaction of Cur with GQDs(the concentration of Cur was kept constant(1.67 × 10-6 mol/L) and amounts of GQDs(0.00 - 6.67 ×10-6 mol/L,interval concentration:3.33 × 10-7 mol/L) were added to the Cur solution;(b)The recovered concentration profiles by MCR-ALS
2.3 GQDs存在时Cur与HSA的相互作用
已有文献报道Cur与HSA的相互作用[11 - 14],本文着重于研究GQDs存在下对Cur与HSA作用的影响。HSA在342 nm处有荧光发射峰,如图3(a)所示,随着Cur的加入,HSA的荧光发射出现明显的猝灭现象,但峰位无明显的移动。这是因为Cur与HSA发生作用,导致HSA内源性荧光有规律的猝灭[15]。当体系中存在GQDs时,如图3(b)所示,Cur对HSA同样有荧光猝灭效果。从HSA的荧光猝灭变化趋势(图3(c))可以推断,随着Cur的加入,当体系中GQDs存在时,HSA荧光下降程度更大,说明GQDs存在下增强了Cur与HSA的结合。
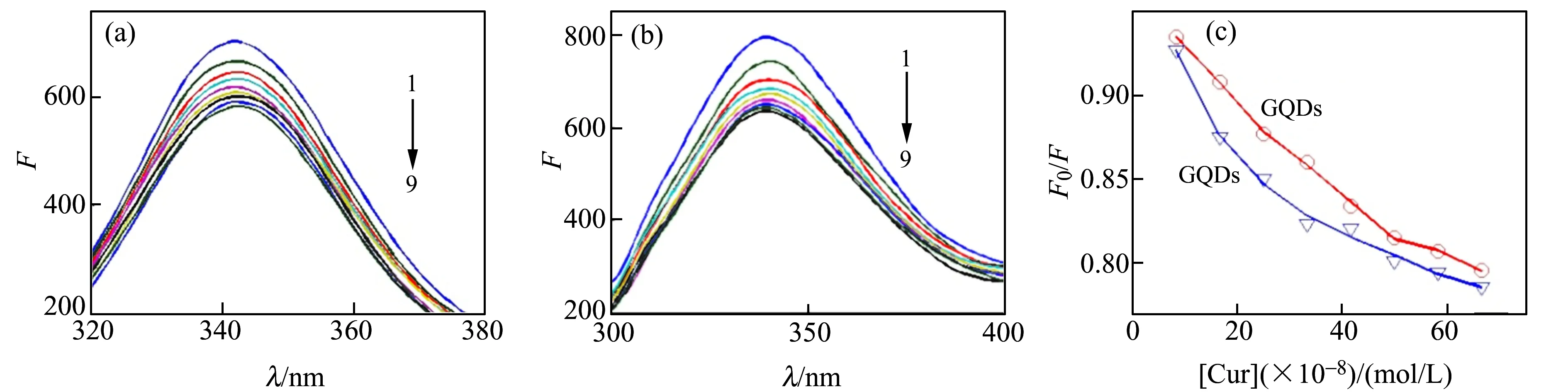
图3 (a、b)GQDS存在和不存在下Cur与HSA的相互作用荧光光谱;(c)HSA的荧光变化趋势Fig.3 (a and b) The fluorescence spectra of Cur interaction with HSA with and without GQDs;(c) The fluorescence variation tendency of HSA
2.4 Cur与HSA作用的结合常数和热力学参数
通过文献报道方程[16,17],得出GQDs不存在下和存在下,Cur与HSA作用的Stern-Volmer和双对数图(图4和图5),并计算出结合常数和热力学参数,见表1。GQDs不存在时,KSV随温度的变化的增大而减小,表明Cur与HSA两者之间的猝灭模式为静态猝灭。ΔH=-25.20 kJ/mol、ΔS=31.75 kJ/(mol·K),ΔH<0,ΔS0,Cur与HSA之间的作用力为疏水作用力和静电引力[17],这与已有文献报道一致。
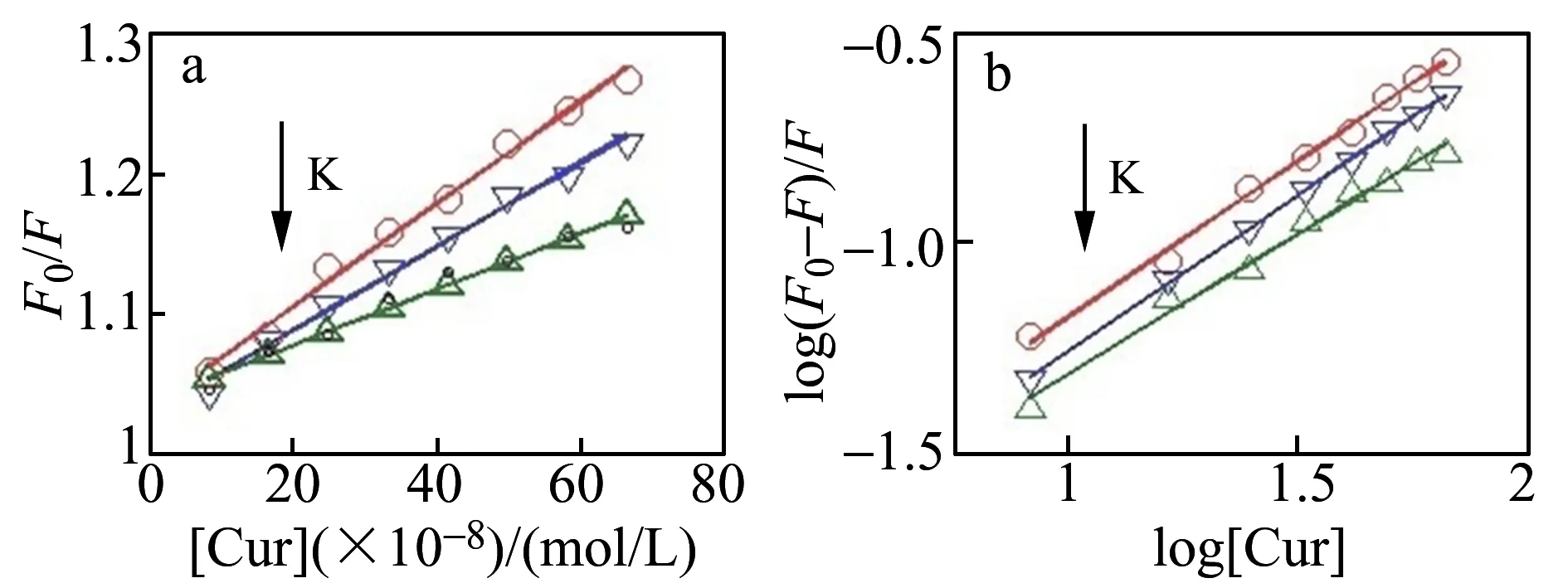
图4 Cur与HSA作用的Stern-Volmer图(4a)和双对数图(4b)Fig.4 Stern-Volmer(a) and log[(F0-F)/F] vs.log[Q](b) plots for the Cur-HSA system at 298,302 and 306 K
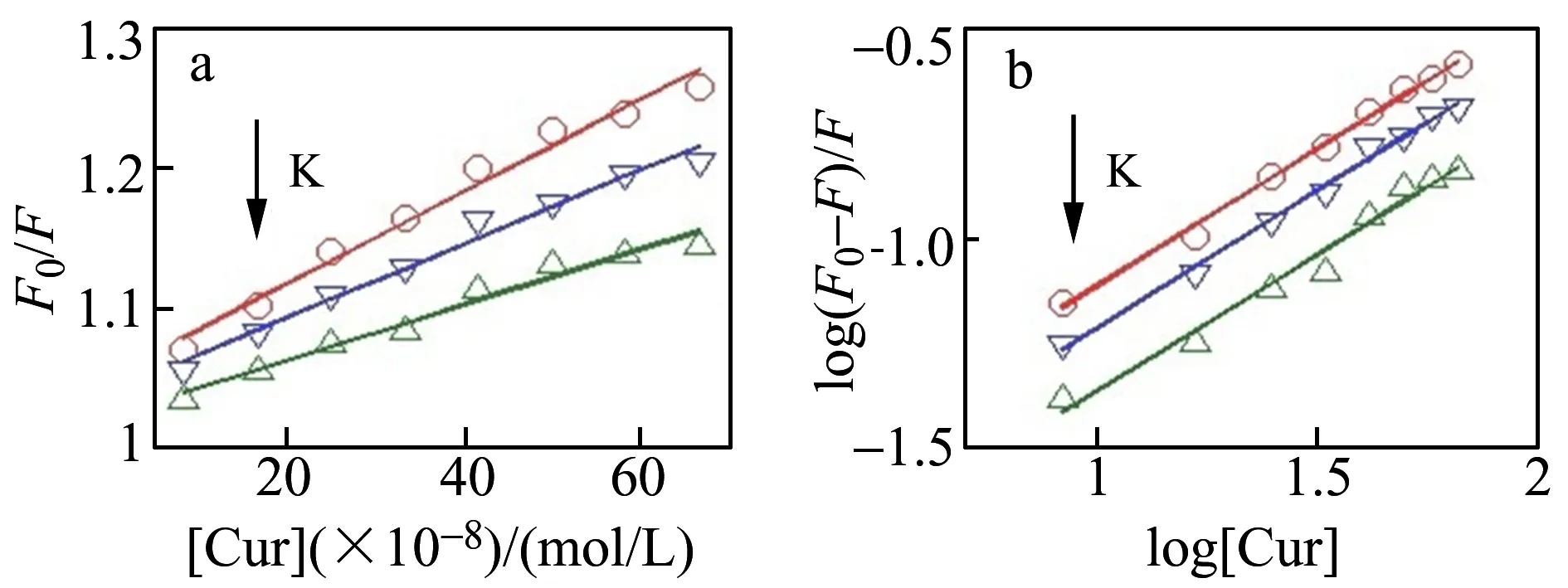
图5 GQDs存在下Cur与HSA作用的Stern-Volmer图(a)和双对数图(b)Fig.5 Stern-Volmer(a) and log[(F0-F)/F] vs.log[Q](b) plots for the Cur-HSA system with GQDs at 298,302 and 306 K
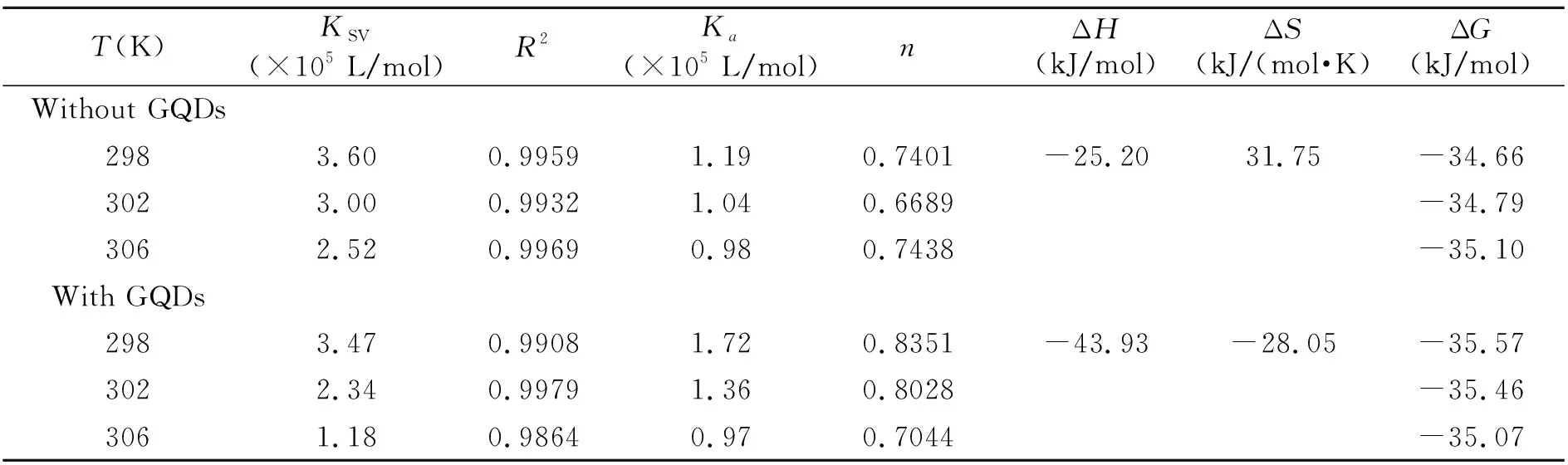
表1 在GQDs不存在和存在下Cur与HSA作用的结合常数和热力学参数
当体系中不存在GQDs时,Cur与HSA结合常数为1.19×105L/mol,而体系中存在GQDs的情况下,Cur与HSA结合常数增大至1.72×105L/mol,增加了44.5%,说明GQDs促进了Cur与HSA的结合作用。此时反应体系的ΔH=-43.95 kJ/mol,ΔS=-28.05 kJ/(mol·K),焓变与熵变均为负值,由此推断出在GQDs存在下,Cur与HSA的作用力主要来自于氢键[17]。这可能是因为Cur与GQDs结合形成复合物后水溶性增加,使Cur苯环上的酚羟基更容易与HSA结合。
2.5 Cur、HSA和GQDs三元体系的形成
釆用RLS对三元体系进行研究[18],确定这三种物质可能的结合情况。小分子与大分子形成复合物时,分子粒径增大会导致RLS信号的增强。如图6所示,Cur和HSA的信号较弱,GQDs的信号相对较强。而Cur加入到GQDs溶液中后,RLS信号增强明显,且当Cur,GQDs和HSA同时存在时,体系信号最强。从RLS实验现象可推断这三种物质间存在反应,并形成GQDs-Cur-HSA三元复合物[19]。
2.6 GQDs与Cur对HSA构象的影响
圆二色谱可以用来分析小分子对生物大分子结构产生的影响[20]。从图7可知,在加入GQDs(曲线线2、3、4)时,HSA在208 nm和222 nm处的特征峰几乎不变,说明GQDs对HSA构象改变很小,印证了GQDs低毒性的特点,可作为药物载体使用。而在体系中加入Cur后(线5、6),HSA在208 nm和222 nm处的峰强度减小,说明Cur改变了HSA构象[21]。
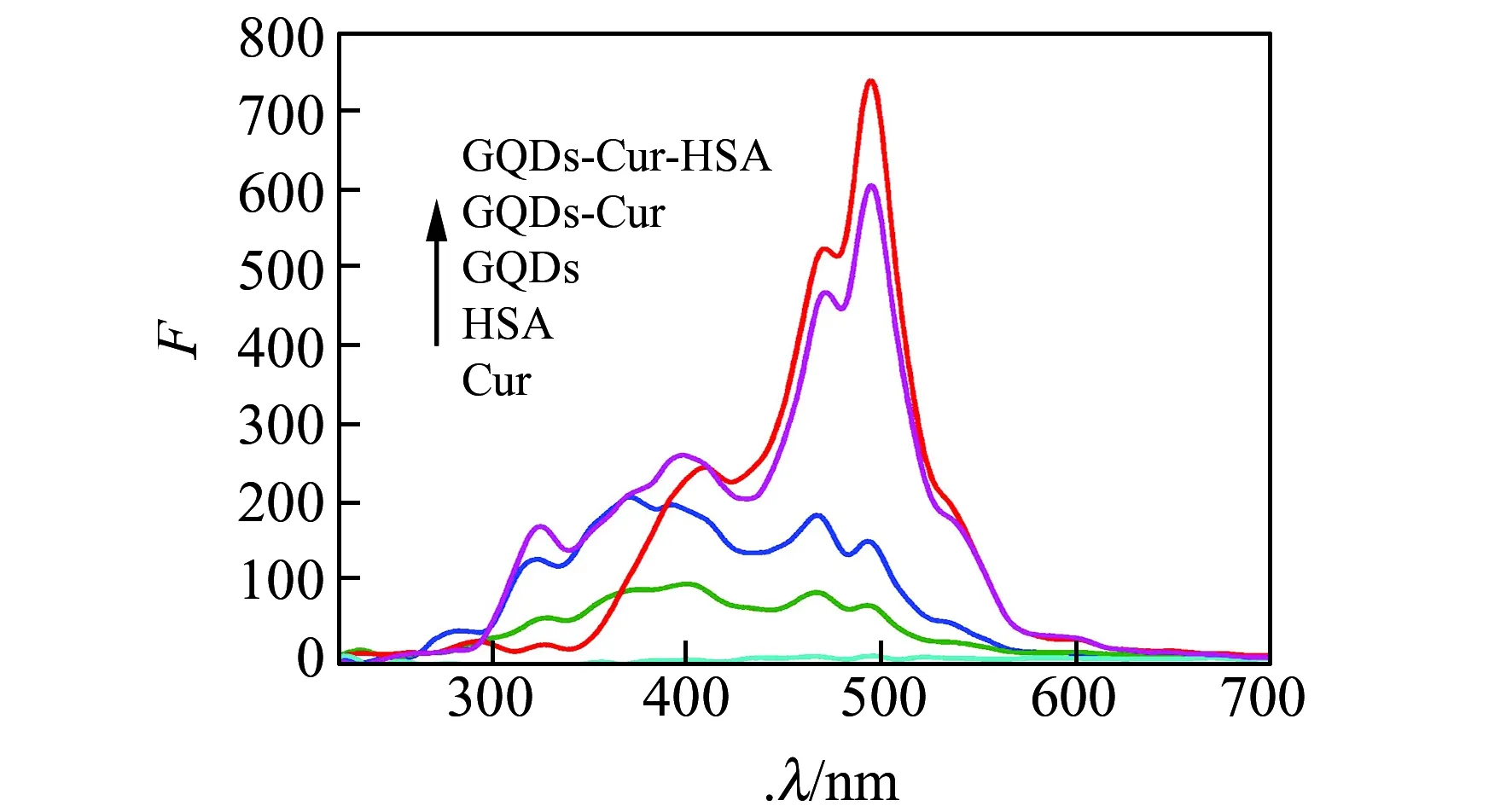
图6 GQDs-Cur-HSA的共振光散射光谱图Fig.6 Resonance light scattering spectra of GQDs-Cur-HSA
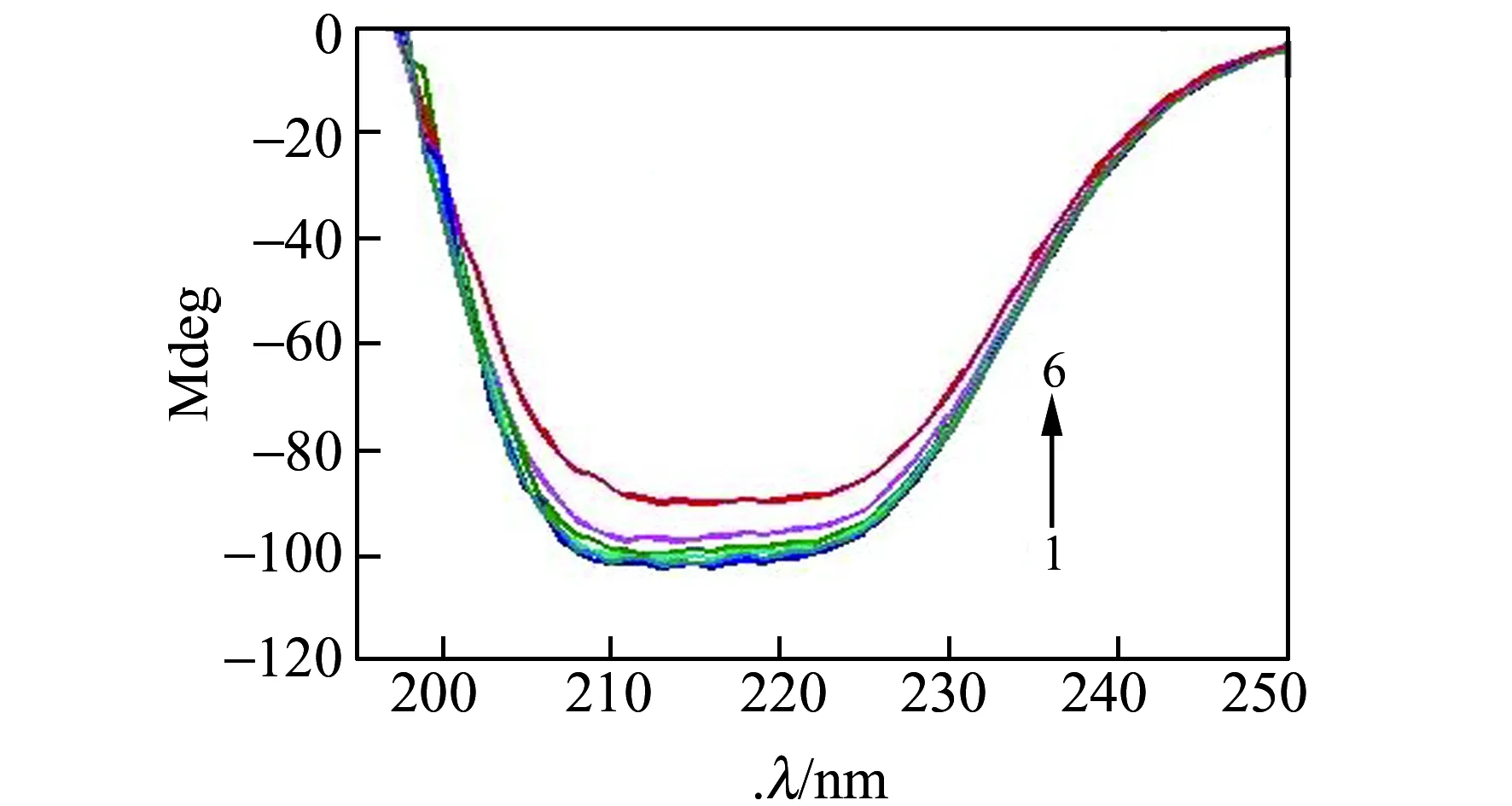
图7 GQDs负载Cur与HSA相互作用的圆二色谱图Fig.7 Circular dichroism spectra of GQDs-Cur-HSA
3 结论
本文采用光谱法,结合化学计量学方法研究GQDs负载Cur与HSA的相互作用。紫外-可见光谱可知Cur通过π-π堆积吸附在GQDs的表面形成复合物。运用MCR-ALS解析Cur-GQDs荧光光谱数据矩阵,从重叠严重的光谱中得到各组分的浓度变化信息,从而进一步认识Cur与GQDs在作用中达到平衡时各组分的动态变化过程,并确认GQDs-Cur复合物比为3。在GQD负载下,Cur与HSA的结合常数明显增大,说明GQDs促进了Cur与HSA的结合作用。RLS实验印证体系形成GQDs-Cur-HSA三元复合物。圆二色谱实验表明低毒性的GQDs可作为药物载体使用。该研究从分子水平研究GQDs负载药物小分子与生物大分子的作用机制,并为GQDs作为纳米药物载体研究提供了实验依据。

