玉米中5-甲基四氢叶酸提取方法的优化及高效液相色谱法定量分析
王博伦,顾丰颖,张 帆,刘 昊,杨婷婷,邵之晓,王 锋
(中国农业科学院农产品加工研究所,农业农村部农产品加工重点实验室,北京 100193)
叶酸是一类对人体健康至关重要的B族维生素,其缺乏是一个全球性的健康问题[1],会导致如巨幼细胞贫血[2],心血管疾病恶化[3]和某些类型癌症等疾病[4];胎儿缺乏会发生神经管缺陷等相关疾病[5]。叶酸由对氨基苯甲酸连接蝶呤组成,其中对氨基苯甲酸能够与一个或多个谷氨酸偶联,形成单谷氨酸叶酸或多谷氨酸叶酸[6]。天然叶酸以四氢叶酸及其衍生物的形式存在[7],如5-甲基四氢叶酸(5-methyl-tetrahydrofolate,5-MTHF)、5-甲酰四氢叶酸、10-甲酰四氢叶酸等。5-MTHF是食品中最主要的天然叶酸形态[8-10],在一些主要蔬菜中,5-MTHF含量超过叶酸总量的85%,而在某些水果中则接近100%[11-13];5-MTHF生物活性高,是唯一可直接作用于甲基化循环的叶酸形态,缺乏5-MTHF易诱发高同型半胱氨酸血症;我国已将5-MTHF作为食品营养强化剂列入食品添加剂的范围,对其添加量、摄入量和适宜人群等做了相应规定。
近年来,越来越多的研究人员通过营养强化育种提高谷物中叶酸含量,摄取叶酸强化食物已成为全球对抗叶酸缺乏症的策略之一[14-16]。鲜食玉米营养丰富香糯可口,消费人群旺盛,在我国种植面积逐年增加。本实验所用原材料京科糯928玉米是高叶酸强化玉米,叶酸含量为普通玉米5~10 倍,且5-MTHF含量占比高[17],可作为叶酸补充食品。受栽培条件、储运加工环境条件的影响,市场中强化叶酸玉米中的叶酸含量差异大,有必要开展玉米中5-MTHF及总叶酸含量的分析检测。
食物中总叶酸含量的测定常使用比色法、薄层层析法和微生物法,而高效液相色谱(high performance liquid chromatography,HPLC)和液相色谱-质谱更多运用在检测分析样品中不同形态叶酸的含量。目前食品中5-MTHF含量的HPLC分析法已应用于菠菜[18]、马铃薯[19]以及柑橘[20]等。为确保HPLC法检测样品中5-MTHF的精准度和低检出限,必须注重样品中被检物质的提取、富集、纯化和检测等环节,其中提取环节最为关键。食品中5-MTHF提取一般采用三酶提取法,即通过α-淀粉酶、蛋白酶水解样品中的淀粉和蛋白质,释放与其结合的5-MTHF,再利用叶酸轭合酶,将多谷氨酸叶酸水解为单谷氨酸叶酸,再予以测定。Aiso等[21]使用三酶法提取牛肉以及牛奶中5-MTHF,对各样品中蛋白酶、α-淀粉酶与叶酸轭合酶添加量进行优化,5-MTHF提取效果均提高50%以上;郭丽琼等[20]对柑橘中5-MTHF进行分析测定时,添加叶酸轭合酶后5-MTHF测定值提高了57%。对于某些淀粉和蛋白质含量占比低的样品,蛋白酶或淀粉酶的添加可能不会显著提高5-MTHF测定值,甚至对测定结果产生负面影响[22]。Iwatani等[23]研究结果表明,三酶共同处理蔬菜类样品后,5-MTHF测定值出现降低。上述研究表明,提取过程中3 种酶是否添加以及添加量的不同会导致检测结果的准确性,有必要针对不同样品开展相应的提取实验。
目前对玉米中5-MTHF与总叶酸分析方法的相关研究十分有限,玉米中淀粉含量占比高,在提取过程中易导致提取液黏稠,增大5-MTHF分析难度。本实验采用磷酸盐溶液提取玉米中5-MTHF及总叶酸,系统分析叶酸浸提液pH值、蛋白酶、α-淀粉酶、大鼠血清添加量、固相萃取(solid phase extraction,SPE)净化对提取玉米样品中叶酸的影响;实验还利用化学转化将玉米中其他形态叶酸转化为5-MTHF,以分析测定玉米中总叶酸含量,并分析HPLC方法的加标回收率、精密度和相关系数。为叶酸强化玉米中5-MTHF和总叶酸含量分析提供方法支持。
1 材料与方法
1.1 材料与试剂
京科糯928玉米由中国农业科学院生物技术研究所种植。
5-MTHF标准品(纯度>90%) 瑞士Schirck’s实验室;甲醇、乙腈、磷酸(均为色谱纯) 德国Merck公司;抗坏血酸、β-巯基乙醇(均为分析纯) 美国Sigma公司;磷酸二氢钠、磷酸氢二钠、乙酸钠、氯化钠(均为分析纯) 国药集团化学试剂有限公司。
蛋白酶(来自灰色链霉菌,≥3.5 U/mg,P5147)、α-淀粉酶(来自米曲霉,~30 U/mg,A6814) 美国Sigma公司;大鼠血清(含有叶酸轭合酶) 北京索莱宝科技有限公司。
1.2 仪器与设备
1260 II HPLC系统、荧光检测器、SAX固相萃取小柱(500 mg,3 mL) Agilent科技(中国)有限公司;HH-S6恒温水浴锅 巩义市予华仪器有限公司;CK2000球磨仪 北京托摩根生物科技有限公司;HT 16MM台式高速离心机 湖南赫西仪器装备有限公司;2X-2真空泵 南京真空泵厂;ME104E电子天平、FE20 pH计 瑞士Mettler Toledo公司;反相Aquasil C18色谱柱(4.6 mm×150 mm,3 μm) 美国Thermo Fisher公司。
1.3 方法
1.3.1 样品制备
玉米样品为京科糯928品种,在收获采摘后,脱粒混匀以减少玉米穗个例间差异;随后使用液氮速冻,储存于-80 ℃环境中。待使用样品时,取出置于球磨仪中1 000 r/min研磨90 s,制备玉米样品匀浆。
1.3.2 溶液配制
叶酸浸提液:使用磷酸二氢钠和磷酸氢二钠配制100 mmol/L pH 6.5磷酸钠缓冲溶液,在磷酸盐缓冲液中加入0.01 g/mL抗坏血酸和体积分数0.5%β-巯基乙醇溶液以配制为叶酸浸提液。
标准品储备液、工作液:分别精确称取5-MTHF标准品5.0 mg于50.0 mL棕色容量瓶中,用叶酸浸提液溶解并定容至刻度,即得100 μg/mL标准储备液。将标准储备液稀释至不同质量浓度以配制成标准工作液。
酶溶液:分别精准称取10 mg蛋白酶及100 mgα-淀粉酶溶于5 mL超纯水中,配制2 mg/mL的蛋白酶溶液和20 mg/mL的α-淀粉酶溶液。
SPE洗脱液:取5 g氯化钠、0.5 g抗坏血酸钠以及0.05 mLβ-巯基乙醇于50 mL容量瓶中,用0.1 mol/L乙酸钠溶液定容,配制为SPE洗脱液。
1.3.3 玉米籽粒中叶酸提取条件的设计
在De Brouwer等[24]的提取叶酸和5-MTHF的方法基础上进行优化。取1 g玉米匀浆与5 mL叶酸浸提液涡旋混合为叶酸提取液。样品充分混匀后,沸水浴处理5 min。在冰上冷却至室温后加入一定量的α-淀粉酶(12 U/mL),37 ℃水浴振荡器中温浴30 min。取出后添加一定量的蛋白酶(0.028 U/mL),37 ℃水浴,1 h后进行沸水浴5 min。冰上冷却后加入一定量的大鼠血清(14 μL/mL),37 ℃水浴4 h。水解完成后煮沸5 min,冷却至室温。4 ℃、14 000×g离心15 min,上清液过0.22 μm滤膜,为待净化提取液。
1.3.3.1 叶酸浸提液的pH值
pH值的变化会影响5-MTHF及其他形态叶酸的稳定性,也会影响α-淀粉酶、蛋白酶以及大鼠血清中叶酸轭合酶的酶活,因此考察pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5浸提液对5-MTHF和总叶酸提取的影响。
1.3.3.2α-淀粉酶、蛋白酶和大鼠血清的添加量
分别考察3 种酶添加量对叶酸提取效果的影响,设定α-淀粉酶添加量分别为0、6、12、18、24 U/mL;蛋白酶添加量为0、0.014、0.028、0.042、0.056 U/mL;大鼠血清添加量分别为0、6、12、14、18 μL/mL。每组实验重复3 次,取平均值。固定的单因素试验条件为α-淀粉酶添加量为12 U/mL,蛋白酶添加量为0.028 U/mL,大鼠血清添加量为14 μL/mL。
1.3.4 叶酸的形态转化
由于玉米中天然叶酸形态多样,主要形态为5-MTHF,为简化玉米中总叶酸含量的分析,将各种形态的叶酸全转化为5-MTHF以测定玉米样品中总叶酸含量,转化步骤参考Ndaw等[25]的方法(图1)。

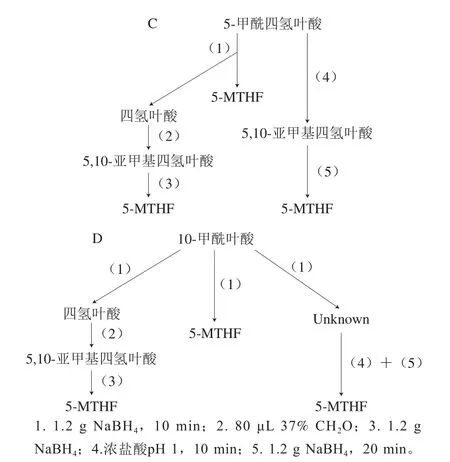
图1 不同形态叶酸转化为5-MTHF步骤Fig.1 Flow chart of conversion of folate into 5-MTHF
取5 mL待净化叶酸提取液,加入66 mmol/L pH 7.8 Tris缓冲液15 mL,再加入1 mL 2-辛醇以消泡;随后加入10 mL 120 g/L NaBH4溶液,混匀后静置10 min;用5 mol/L乙酸调节pH值至7.4。加入80 μL 37%甲醛溶液;振荡混匀后,1 min内小心加入10 mL 120 g/L NaBH4溶液。然后用37%浓盐酸调pH值小于1.0,溶液静置10 min后用5 mol/L NaOH溶液调pH 5,再次小心加入10 mL 120 g/L NaBH4溶液,溶液振荡均匀后静置20 min;用Tris缓冲液将溶液的体积定容到100 mL;溶液分层后将上层的2-辛醇去除。剩余溶液过0.45 μm滤膜,为叶酸形态转化后的待净化总叶酸提取液。
1.3.5 提取液的SPE净化
首先分别使用2×2.5 mL甲醇和2×2.5 mL超纯水以1~2 滴/s的流速活化固相萃取小柱。测定5-MTHF含量或总叶酸含量时,吸取2.5 mL待净化提取液,加到活化后的SPE小柱上,流出速率同样为1~2 滴/s,样品吸附完毕后,使用2.5 mL超纯水清洗小柱。随后使用3.2 mL SPE洗脱液缓慢(流速不超过1 滴/s)洗脱叶酸。收集目标物洗脱液,过0.22 μm滤膜,将净化样品液转移到HPLC进样瓶中,为HPLC待测液。
1.3.6 HPLC测定参数
HPLC条件:1260 II HPLC系统,反相Aquasil C18柱(4.6 mm×150 mm,3 μm)配备四元泵,自动取样器避光恒温4 ℃;荧光检测器设定条件为激发波长290 nm,发射波长360 nm。
梯度洗脱程序:流动相为33 mmol/L pH 2.3磷酸盐缓冲液和乙腈;流速0.4 mL/min;进样量20 μL;柱温30 ℃。流动相比例变化如表1所示。

表1 流动相梯度洗脱条件Table 1 Mobile phase gradient elution conditions
1.3.7 标准曲线绘制
用叶酸浸提液将5-MTHF标准储备液稀释分别为0.003、0.030、0.050、0.070、0.100、0.300、0.500、0.700、1.000 μg/mL,HPLC分析,根据5-MTHF质量浓度(X)和对应的峰面积(Y)确定方程式,得到标准曲线。
1.3.8 回收率、检出限和定量限计算
用已知量的5-MTHF标准物质品加入到玉米提取物中,按下式计算回收率:
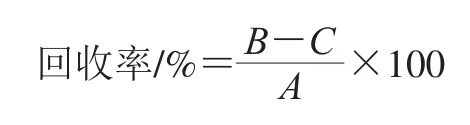
式中:A为在提取液中添加量的5-MTHF标准物质的峰面积;B为加标准品后的样品提取物峰面积;C为提取物峰面积。
通过信噪比为3和10分别计算检出限和定量限。
1.4 数据统计分析
每个样品均为3 个重复。使用t检验确定平均值之间的显著差异。
2 结果与分析
2.1 标准曲线、检出限及定量限
5-MTHF线性回归方程为Y=1 556.474X-0.002,R2>0.999 9;根据信噪比为3确定5-MTHF的检出限为0.001 μg/mL;信噪比为10确定定量限为0.003 μg/mL,可满足玉米中5-MTHF含量的测定。
2.2 玉米籽粒中叶酸提取条件的优化
2.2.1 提取液pH值对5-MTHF和总叶酸提取的影响
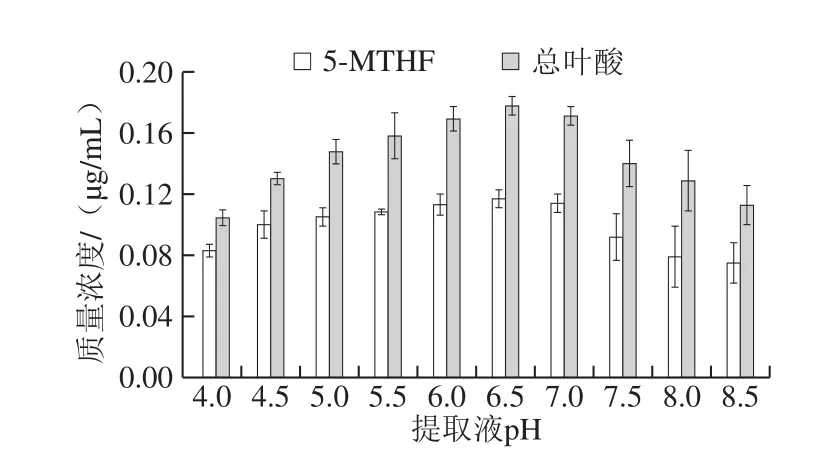
图2 提取液pH值对5-MTHF和总叶酸提取的影响Fig.2 Effect of extraction pH on the extraction efficiency of 5-MTHF and folate
如图2所示,在pH 4~8.5范围内,叶酸的提取结果差异显著,随着pH值的升高,叶酸提取液中的5-MTHF和总叶酸质量浓度表现为先上升后下降的趋势。pH 6.5时,叶酸提取液中5-MTHF和总叶酸的质量浓度最高,分别为0.117 μg/mL和0.177 μg/mL。酸性条件下,相对5-MTHF,总叶酸提取率受环境影响更大,测定值降低更为明显,pH 4.0时叶酸提取液中5-MTHF和总叶酸质量浓度分别比pH 6.5时降低了29.06%和41.19%。推测可能除5-MTHF外的其他形态叶酸对低pH值更为敏感(如四氢叶酸),因此在酸性条件提取下总叶酸的损失更大[22]。在pH值从7.0升高到8.5时,由于叶酸在碱性条件下不稳定,5-MTHF和总叶酸质量浓度值下降快速。pH值除了影响叶酸自身稳定性外,也影响酶活性[26],实验操作时反复调整pH值会延长提取时间,增大叶酸氧化的概率,因此在叶酸提取过程中应固定pH值。
2.2.2α-淀粉酶添加量对5-MTHF和总叶酸提取的影响
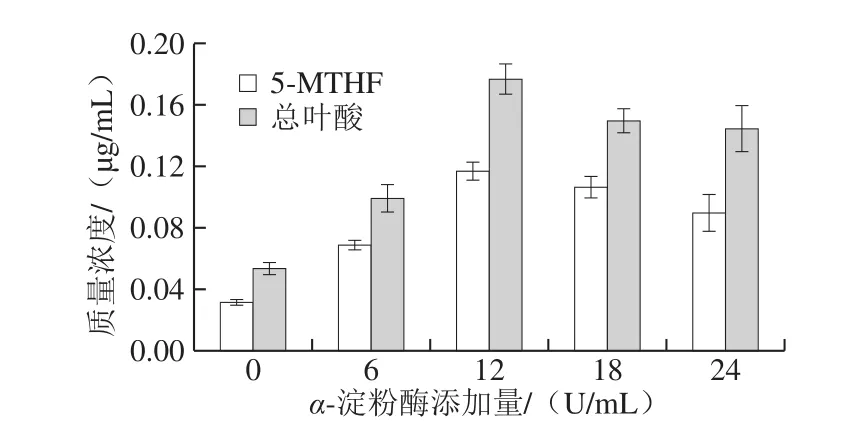
图3 α-淀粉酶添加量对5-MTHF和总叶酸提取的影响Fig.3 Effect of α-amylase concentration on the extraction efficiency of 5-MTHF and folate
从图3可以看出,α-淀粉酶添加量显著影响玉米中5-MTHF和总叶酸提取效果,增大α-淀粉酶的添加量,叶酸提取液中5-MTHF和总叶酸质量浓度升高随后出现略微下降。α-淀粉酶添加量为12 U/mL时,叶酸提取液中5-MTHF和总叶酸质量浓度最大,分别为0.115 μg/mL和0.179 μg/mL。样品中若未添加α-淀粉酶,5-MTHF和总叶酸质量浓度仅为0.032 μg/mL和0.054 μg/mL,添加量为6 U/mL时,提取液中5-MTHF和总叶酸质量浓度显著提高,但比最大值低40.68%和44.13%,推测可能玉米中淀粉会结合或包裹叶酸,影响5-MTHF与总叶酸的提取,同时沸水浴后提取液黏稠,α-淀粉酶液化不充分,不利于叶酸的提取。当α-淀粉酶添加量为18、24 U/mL,5-MTHF和总叶酸提取量出现了下降,猜测可能在蛋白酶用量不变情况下,随着淀粉酶添加量的增大,影响了后期蛋白酶的酶解效果,导致提取液中叶酸质量浓度降低。
2.2.3 蛋白酶添加量对5-MTHF和总叶酸提取的影响
如图4所示,蛋白酶添加量为0、0.014、0.028 U/mL时,叶酸提取率随之增高。在叶酸提取液中加入0.028 U/mL蛋白酶溶液后,5-MTHF和总叶酸质量浓度为0.118 μg/mL和0.176 μg/mL,相对于未添加蛋白酶,分别提高了54.53%和55.74%,推测分析玉米中的天然叶酸可能与蛋白结合,影响叶酸的提取效果。蛋白酶添加量大于0.028 U/mL后,叶酸提取效果差异不明显。因此,选用蛋白酶添加量为0.028 U/mL。
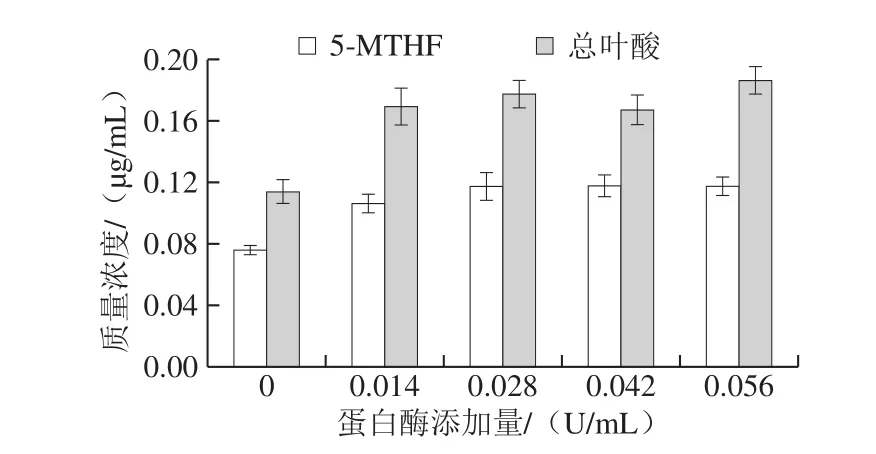
图4 蛋白酶添加量对5-MTHF和总叶酸提取的影响Fig.4 Effect of protease concentration on the extraction efficiency of 5-MTHF and folate
2.2.4 大鼠血清添加量对5-MTHF和总叶酸提取的影响
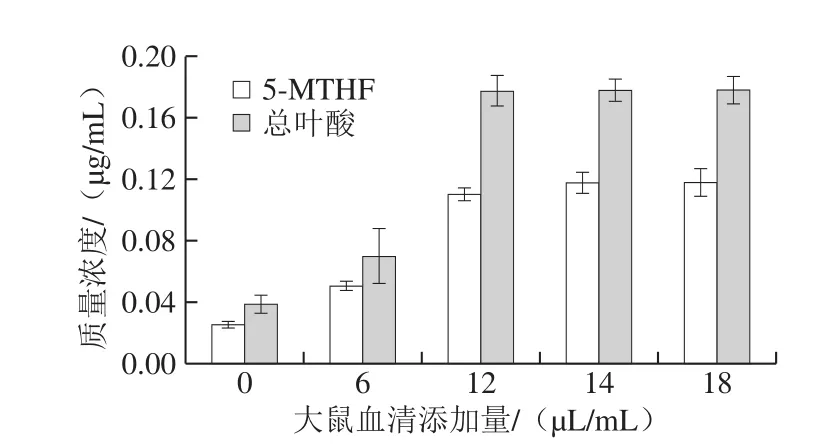
图5 大鼠血清添加量对5-MTHF和总叶酸提取的影响Fig.5 Effect of rat serum concentration on the extraction efficiency of 5-MTHF and folate
在提取液中加入大鼠血清,其所含的叶酸轭合酶将多谷氨酸叶酸水解为单谷氨酸叶酸。从图5可以看出,大鼠血清添加量在0、6、12、14 μL/mL时,随着大鼠血清添加量增加,提取液中5-MTHF和总叶酸质量浓度也相应提高。加入14 μL/mL大鼠血清时,5-MTHF和总叶酸质量浓度分别为0.115 μg/mL和0.176 μg/mL;未添加大鼠血清时,5-MTHF和总叶酸质量浓度仅为添加14 μL/mL大鼠血清的22.61%和22.16%,说明玉米样品中多谷氨酸叶酸占多数。考虑在大鼠血清添加量大于14 μL/mL后,叶酸提取效果之间差异不明显,实验确定大鼠血清的添加量为14 μL/mL。
当3 种酶均未添加时,叶酸提取液中5-MTHF和总叶酸测定值仅为0.011 μg/mL和0.015 μg/mL,低于未添加α-淀粉酶、蛋白酶或大鼠血清处理组,说明添加α-淀粉酶、蛋白酶以及大鼠血清可以提高叶酸的提取效果。
2.2.5 SPE净化收集洗脱液体积对5-MTHF和总叶酸提取的影响
在HPLC分析样品之前,纯化样品可提高叶酸检测准确度和回收率,降低检出限,减少提取液中内源成分干扰。固定叶酸结合蛋白亲和色谱[27-29]净化提取液时对5-甲酰四氢叶酸的亲和吸附力较低,会导致其损失[30-31],本实验使用强阴离子交换(SAX)SPE对提取液进行净化[32]。SPE洗脱液收集体积的量会影响提取的回收率。当截留体积过小时,叶酸收集不完全;当截留体积过大时,会导致洗脱液中叶酸浓度降低,影响测定准确性。因此需准确截取含有叶酸的洗脱液部分。本实验在洗脱过程中,每0.1 mL收集1 次洗脱液,然后依次测定,结果表明收集洗脱液时可丢弃首先流出的0.7 mL;中间段2.5 mL洗脱液中存在可检出目标物5-MTHF,回收率达到98.5%。采用以上洗脱收集方式,SPE对叶酸提取液净化效果显著。未使用SPE净化处理组中杂质多,5-MTHF目标峰与相邻杂质峰部分重合,无法准确定量5-MTHF(图6A),使用SPE净化后,5-MTHF相邻杂质峰消失,且5-MTHF峰形对称性良好,干扰物少,在16.87 min处出峰(图6B)。
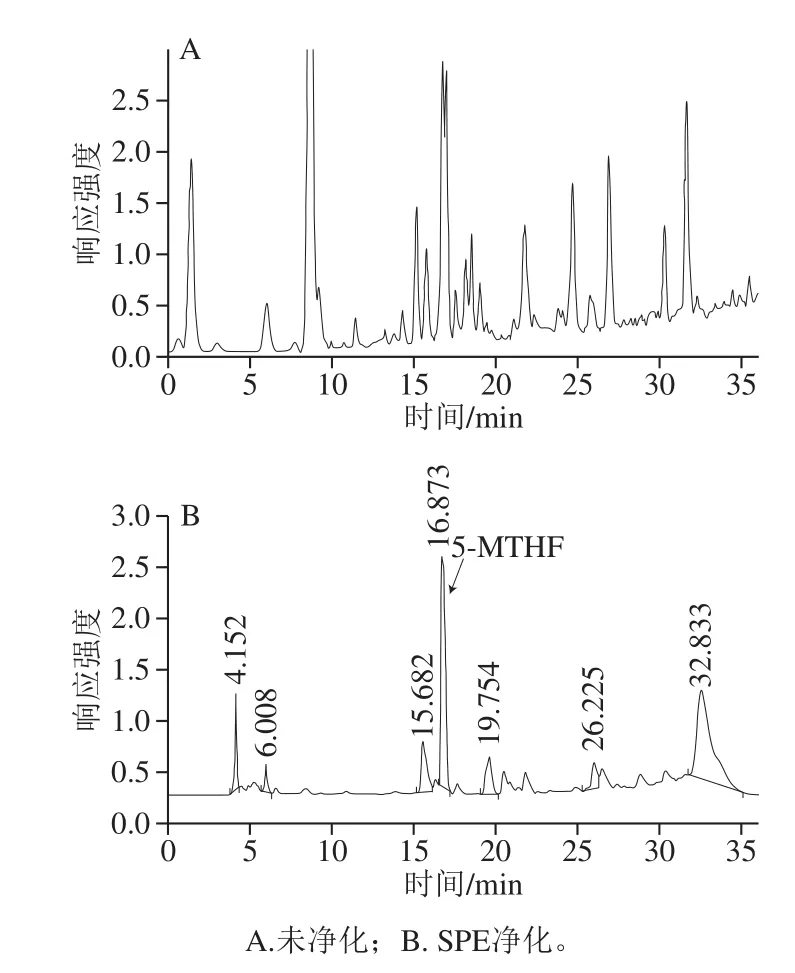
图6 叶酸提取液HPLC色谱图Fig.6 HPLC chromatograms of folate extract
2.3 玉米样品的验证
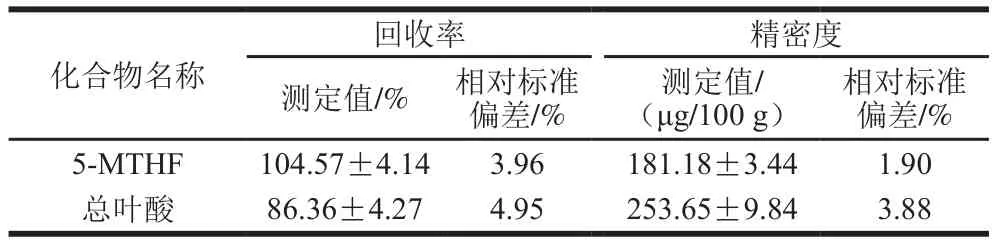
表25 -MTHF回收率及精密度Table 2Recovery and precision of 5-MTHF and total folate
对京科糯928玉米中叶酸含量进行分析,结果见表2,京科糯928玉米中总叶酸含量为253.65 μg/100 g,这与董会等[17]运用高效液相色谱-质谱对京科糯928玉米中叶酸含量的测定结果接近。本研究显示强化叶酸玉米最主要的叶酸形式为5-MTHF,占总叶酸含量的71.36%,这与相关研究中测定5-MTHF占总叶酸含量比例近似。因此本方法能够满足玉米中5-MTHF和总叶酸的检测。
3 结 论
本实验优化了鲜食糯玉米中5-MTHF和总叶酸的提取净化方式,建立有效的HPLC检测方法。在充分考虑玉米基质条件下,叶酸提取液pH值为6.5,α-淀粉酶、蛋白酶、大鼠血清的最佳添加量分别为12 U/mL、0.028 U/mL、14 μL/mL,SPE净化柱收集洗脱液2.5 mL时,提取叶酸效果最好,方法的线性范围在0.003~1.000 μg/mL之间,相关系数达0.999 9,检出限为0.001 μg/mL,定量限为0.003 μg/mL,精密度为1.90%,样品加标平均回收率为104.57%;测定叶酸强化玉米(京科糯928)中5-MTHF与总叶酸含量分别为181.18 μg/100 g与253.65 μg/100 g,提取优化后的HPLC检测方法适用于玉米中5-MTHF与总叶酸的测定,可为其他强化谷物中叶酸含量的测定提供参考。

