甘肃河西走廊葡萄酒产区本土酒酒球菌发酵耐受性分析
祝 霞,王璐璐,赵丹丹,王 诗,韩舜愈,杨学山
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
葡萄酒苹果酸-乳酸发酵(malolactic fermentation,MLF)主要由酒酒球菌(Oenococcus oeni)诱发和主导,可有效柔化葡萄酒酸度,增加微生物稳定性,修饰酒体风味,是酿造高品质干红和部分干白葡萄酒必不可少的工艺环节[1]。虽然在适宜的条件下MLF可以自然启动,但自然起酵酒样中微生物种类较多,导致MLF往往难以预测和控制,因此纯种发酵是控制MLF顺利进行的主要手段之一[2]。在葡萄酒酿造过程中多个发酵条件共同作用和影响O.oeni的生存和生长,优良O.oeni菌株通常能够在低pH值、高乙醇体积分数、高SO2质量浓度以及低发酵温度的葡萄酒环境中生存[3-4]。近年来,为改善商业化菌株大量推广应用导致的酒品标准化、同质化问题,关于本土优良O.oeni菌种的筛选、鉴定及其对酒质提升、呈现产区微生物风土的相关研究成为了行业关注的焦点[5]。已有学者对西班牙[6]、阿根廷[7]、葡萄牙[8]、意大利[9]等国葡萄酒产区自然启动MLF酒样中分离的本土O.oeni进行了发酵耐受性和酿造特性分析,获得了代表产区风土特征的优良菌株。张春晖[10]、卢新军[11]、薛雪[12]、乔慧等[13]分别对从山东烟台、河北昌黎、宁夏银川、内蒙古葡萄酒产区筛选得到的本土O.oeni进行发酵适应性研究,得到发酵特性优良的本土O.oeni菌株,应用于葡萄酒发酵后保证了所产葡萄酒的品质和地域风格。
甘肃河西走廊产区地域广阔、生态条件相对复杂,加之酿酒葡萄种植历史悠久[14],必然存在着适应产区风土的优良O.oeni菌株,具备酿造高品质葡萄酒的潜力。在实际生产中,由于受发酵成本、商业化菌株与酿酒葡萄品质适应性等因素限制,绝大多数葡萄酒生产企业选择不进行或采用进口商品发酵剂完成MLF,导致所酿葡萄酒缺乏产区风格和特色。本研究以甘肃河西走廊产区生产企业自然启动MLF的酒样中分离鉴定的7 株本土O.oeni为供试菌株,利用单因素结合不完全正交试验分析评价不同发酵条件下各菌株的耐受性,以期筛选出酿造适应性优良的菌株,为进一步探究菌株的发酵特性以提升甘肃河西走廊产区葡萄酒品质提供技术支持。
1 材料与方法
1.1 材料与试剂
供试菌株:O.oeni菌株MG-1、MG-7、MG-10、QL-9、QL-11、GF-2、ZX-1,均从甘肃河西走廊葡萄酒产区生产企业自然启动MLF葡萄酒中分离、鉴定,-80 ℃甘油管保存。
蛋白胨、酵母浸粉、硫酸镁、硫酸锰、氢氧化钠、无水葡萄糖、盐酸、酒石酸、无水乙醇、偏重亚硫酸钠天津市光复精细化工研究所。
1.2 仪器与设备
LRH生化培养箱 上海一恒科学仪器有限公司;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;LDZX立式压力蒸汽灭菌锅 上海申安医疗器械厂;UV-6100紫外-可见分光光度计 上海元析仪器有限公司;BCD642WDVMU1立式冰箱 青岛海尔股份有限公司;pHS-3C精密pH计 上海雷磁场仪器厂;AL104电子天平 梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 酸性番茄(acid tomato juice,ATB)培养基的配制
ATB培养基配方[15]:葡萄糖10 g/L,蛋白胨10 g/L,酵母浸粉5 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,盐酸半胱氨酸0.5 g/L,番茄汁25%(V/V)。液体培养基使用1 mol/L NaOH溶液调pH值至4.8,固体培养基调pH值至5.0,并向其中加20 g/L琼脂,121 ℃灭菌20 min。其中葡萄糖于115 ℃灭菌15 min,在超净工作台内按比例混合。
1.3.2 菌株活化
配制ATB液体培养基,121 ℃湿热灭菌20 min后,置于无菌超净工作台中冷却。取冷冻保存的O.oeni菌株,置室温2 h后,从斜面培养基上挑取2 环接种至配制好的液体培养基中,于28 ℃培养箱中扩大培养。
1.3.3 菌株耐受性单因素试验
1.3.3.1 pH值
将活化扩培处于对数生长期的供试菌株以107CFU/mL接种量,分别接种于pH值为3.0、3.2、3.5、3.8、4.0的ATB液体培养基中(HCl或NaOH溶液调节pH值),28 ℃静置培养,用分光光度计测定其OD600nm值。
1.3.3.2 乙醇体积分数
将处于对数生长期的供试菌株以107CFU/mL接种量,分别接种于乙醇体积分数为6%、8%、10%、12%、14%的ATB液体培养基中(用无水乙醇调节乙醇含量),28 ℃静置培养,用分光光度计测定其OD600nm值。
1.3.3.3 SO2质量浓度
将处于对数生长期的供试菌株以107CFU/mL的接种量,分别接种于SO2质量浓度(以偏重亚硫酸钠计)为20、40、60、80、100 mg/L的ATB液体培养基中,28 ℃静置培养,用分光光度计测其OD600nm值。
1.3.3.4 发酵温度
将处于对数生长期的鉴定菌株以107CFU/mL的接种量接种于ATB液体培养基,分别置于16、18、20、22、25 ℃条件下静置培养,用分光光度计测定其OD600nm值。
1.3.4 耐受性复合因素试验
根据单因素试验结果,结合甘肃河西走廊产区葡萄酒MLF的生产实际,对供试菌株在不同水平下进行pH值(3.2、3.5)、乙醇体积分数(10%、12%、14%)、SO2质量浓度(20、40 mg/L)的复合因素酿造耐受性分析[12]。
1.4 数据处理与分析
对供试样本所得数据采用Microsoft Office Excel 2010,Origin 2018进行基本处理和作图,IBM SPSS Statistics 19.0软件进行Duncan多重比较以及差异显著性分析。
2 结果与分析
2.1 供试O.oeni单因素耐受性分析
2.1.1 菌株对pH值的耐受性
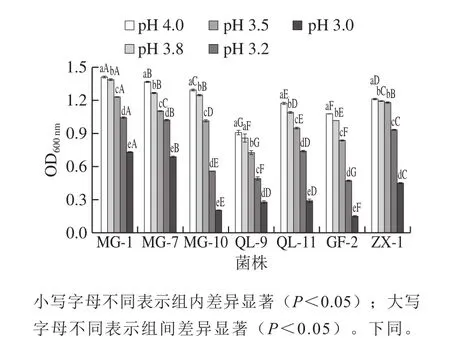
图1 pH值对O.oeni生长的影响Fig.1 Effect of pH value on the growth of O.oeni
pH值是影响O.oeni生长最主要的生境因素之一[8]。由图1可知,pH值对不同菌株的影响趋势具有相似性,随着pH值的逐渐降低,菌株的生长量均不断减少。对同一菌株而言,其对不同水平pH值的耐受性不同。其中O.oeni菌株MG-1、MG-7、MG-10、QL-11和GF-2均在不同的pH值梯度下表现出显著差异(P<0.05)。菌株MG-10和GF-2受pH值影响最大,在pH 4.0和pH 3.0时2 株菌的菌液OD600nm值分别为1.295和0.205(MG-10),1.080和0.149(GF-2),其生长量分别降低了约84%和86%。
在同一pH值的胁迫压力下,不同O.oeni菌株的耐受性存在差异。当pH值为4.0时,所有菌株生长量之间存在显著差异(P<0.05),且MG-1的生长量最大,OD600nm值约为1.4,MG-7次之;在pH值为3.8时,菌株MG-7和MG-10的生长量无显著差异(P<0.05),所有菌株生长良好,OD600nm均在0.8以上;当pH<3.5时,所有菌株的生长均受到抑制,其中在pH 3.2条件下,MG-10、QL-9和GF-2受到的抑制作用最强,而MG-1表现最为突出(OD600nm=1.045),且与其他各菌株间存在显著差异(P<0.05);当pH值为3.0时,各菌株受pH值的抑制作用最强,且除QL-9和QL-11之间无显著差异外,其他各菌株间都具有显著差异(P<0.05)。总体分析,菌株MG-1、MG-7和ZX-1在pH值小于3.5时耐受性良好。
2.1.2 菌株对乙醇的耐受性
发酵过程中产生的乙醇对O.oeni具有抑制作用,且抑制程度取决于乙醇体积分数及发酵菌株的抗胁迫能力[15-16]。由图2可知,乙醇体积分数与菌株生长量呈负相关关系,随着乙醇体积分数的不断升高,菌株生长量呈明显下降趋势。同一菌株对不同体积分数乙醇的抗性存在差异。在6%的乙醇体积分数下,各菌株生长量最大,表明较低的乙醇体积分数可以刺激O.oeni的生长;而在12%和14%的高乙醇体积分数下,菌株生长明显受到抑制,且各菌株之间的耐受性存在显著差异(P<0.05)。
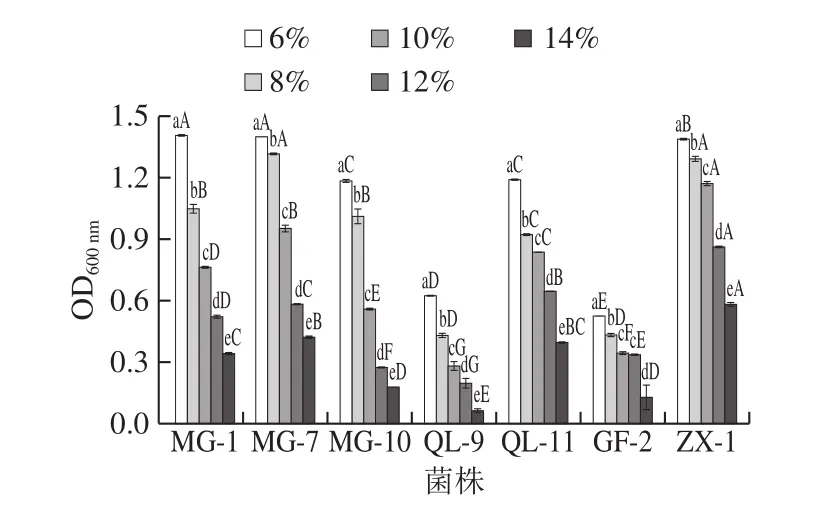
图2 乙醇体积分数对O.oeni生长的影响Fig.2 Effect of alcohol content on the growth of O.oeni
不同菌株对不同乙醇体积分数的抗性也表现出较大的差异。在6%和8%的低乙醇体积分数下,菌株MG-1、MG-7、MG-10、QL-11和ZX-1表现出较强的乙醇耐受性,而QL-9和GF-2耐受能力较弱。其中ZX-1能够在14%的乙醇体积分数下维持增殖,OD600nm值可达到0.582,与其他供试菌株相比具有显著差异(P<0.05),表明ZX-1对高浓度乙醇的抗性更强。
2.1.3 菌株对SO2的耐受性
SO2通常作为抗氧化剂添加到葡萄酒中,能够同时抑制野生酵母和杂菌的生长,从而降低葡萄酒发酵过程中腐败的风险[17]。然而,一定质量浓度的SO2对O.oeni的正常生长和增殖具有明显的抑制作用。由图3可知,在20 mg/L和40 mg/L的SO2质量浓度下,各菌株均生长良好(OD600nm>0.6),表明菌株对较低质量浓度的SO2具有较强的耐受性。随着SO2质量浓度的增加,菌株受到的抑制作用不断增强,当SO2质量浓度达到80 mg/L及以上时,几乎能够对所有菌株的正常生长产生强烈抑制作用。不同O.oeni菌株对SO2的抗性不同。由图3可知,所有菌株均能够在60 mg/L的SO2质量浓度下维持生长,其中以菌株QL-11、QL-9和ZX-1表现较佳,尤其是菌株QL-11,其在不同SO2质量浓度下与其他菌株都具有显著差异(P<0.05),并能够在80 mg/L的高SO2质量浓度下增殖,具有较强的SO2耐受性。
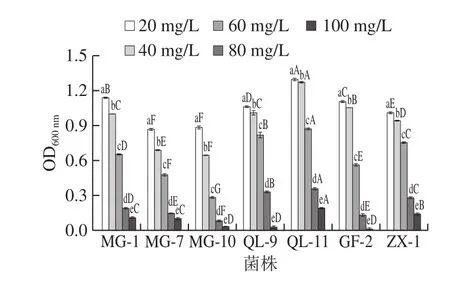
图3 SO2质量浓度对O.oeni生长的影响Fig.3 Effect of SO2 concentration on the growth of O.oeni
2.1.4 菌株对发酵温度的耐受性
发酵温度是影响O.oeni生长的关键因素之一,不适宜的温度对菌株正常生长具有明显的抑制作用[18]。由图4可知,随着发酵温度的不断降低,菌株生长量也随之减少。菌株MG-7、QL-11、GF-2和ZX-1分别在25、22 ℃和20 ℃时的生长量具有显著差异(P<0.05),且25 ℃菌株生长量最高;而对菌株MG-1、MG-10及QL-9影响较小。而在18 ℃和16 ℃条件下,所有菌株生长量开始显著下降,其中MG-10、QL-9及GF-2菌株的生长量较小。比较不同菌株在各发酵温度下的生长量可知,菌株ZX-1对较低的发酵温度耐受能力最强,其次为MG-7和QL-11。与各菌株对pH值、乙醇和SO2质量浓度的耐受性相比较,发酵温度对供试菌株的影响差异相对小。
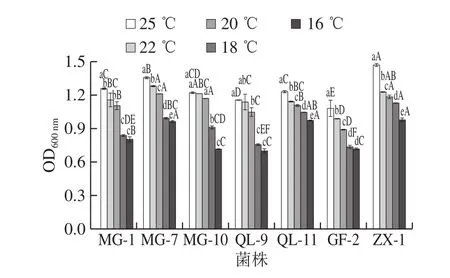
图4 发酵温度对O.oeni生长的影响Fig.4 Effect of fermentation temperature on the growth of O.oeni
由耐受性单因素试验结果可知,菌株GF-2在pH 3.0的条件下,其生长受到强烈抑制,OD600nm值仅为0.149;菌株MG-10、QL-9和GF-2对乙醇较为敏感,尤其QL-9和GF-2在低乙醇体积分数(6%)下,其OD600nm值仅为0.623和0.526,显著低于其他菌株生长量(P<0.05),而在高乙醇体积分数(14%)下,MG-10(OD600nm=0.179)、QL-9(OD600nm=0.063)和GF-2(OD600nm=0.128)几乎不能生长增殖;菌株MG-10对SO2抗性较弱,在SO2质量浓度为60 mg/L的条件下菌株生长受到明显抑制,生长量(OD600nm=0.281)显著低于其他菌株(P<0.05);在16 ℃的低温下,菌株MG-10(OD600nm=0.715)、QL-9(OD600nm=0.699)和GF-2(OD600nm=0.716)生长量之间无显著差异(P>0.05),且均显著低于其他菌株生长量(P<0.05)。因此,选择对pH值、乙醇、SO2质量浓度和发酵温度耐受性较好的菌株MG-1、MG-7、QL-11和ZX-1,进行酿酒因素复合耐受性评价。
2.2 菌株复合因素耐受性分析
MLF能否顺利进行取决于O.oeni菌株对葡萄酒整体生境的耐受性。在葡萄酒酿造过程中,多个发酵可能协同抑制O.oeni生长,会导致MLF的延滞或终止,使发酵过程难以启动或完成[12]。因此,考察复合因素条件下O.oeni的耐受性,对有效控制MLF更具有参考价值。
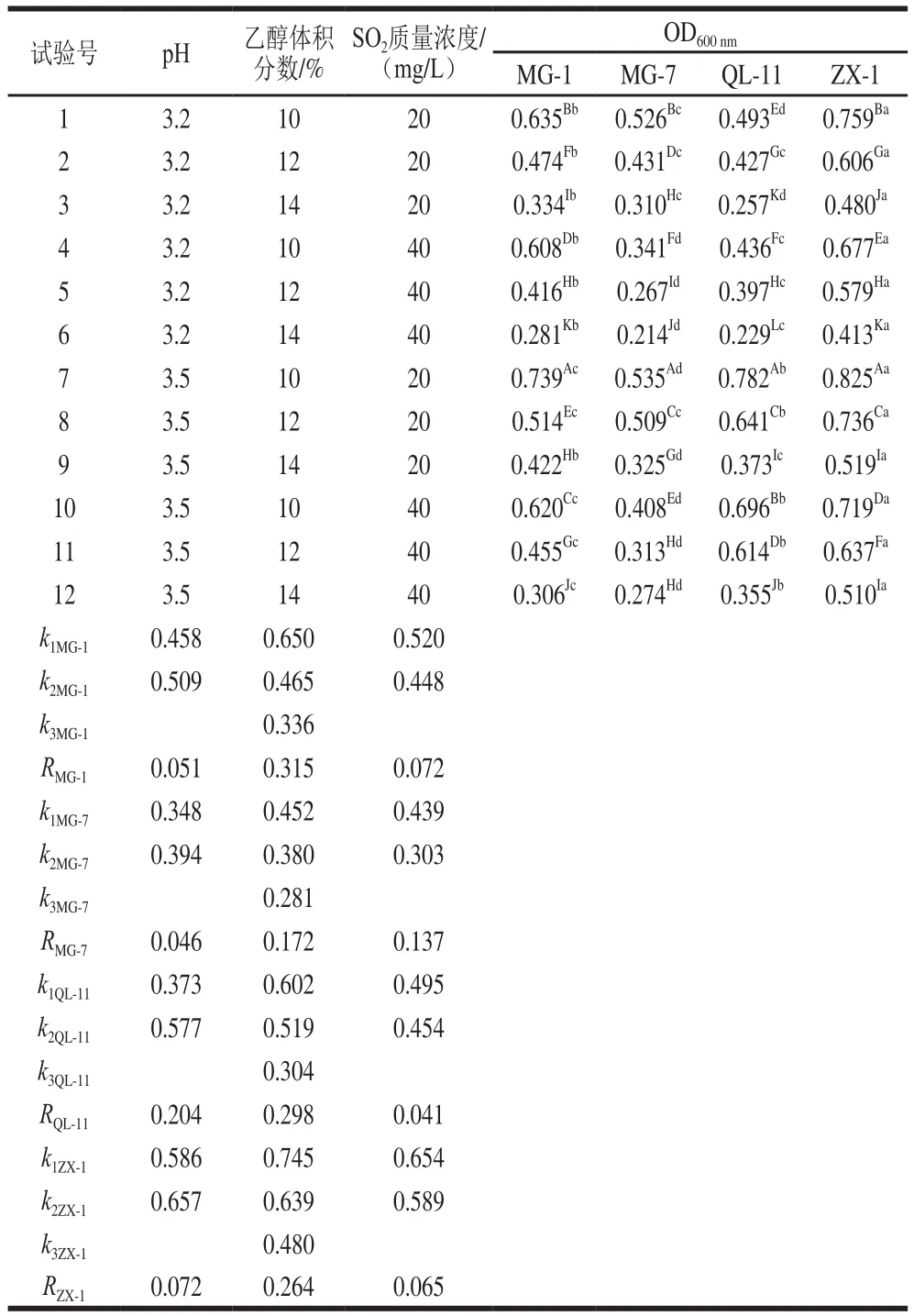
表1 菌株耐受性正交试验设计与结果Table 1 Orthogonal array design with experimental results
单因素耐受性结果表明,菌株MG-1、MG-7、QL-11和ZX-1在不同发酵温度下(16~25 ℃)都可以生长增殖,但在18 ℃条件下,所有菌株生长量开始明显下降。而在实际生产中,较高的MLF温度会导致挥发酸含量增加,降低葡萄酒的感官品质[19-20]。因此选择在20 ℃的条件下考察复合因素耐受性。表1结果表明,与单因素结果相比,在复合因素作用下4 株菌的生长量均有降低。在相同的处理条件下,不同菌株的生长量存在显著差异(P<0.05)。在1~12 组的处理条件下,对复合因素抗性最好的菌株均为ZX-1,其次是MG-1(第1~6组和第9组)和QL-11(第7、8、10、11、12组)。随着复合因素胁迫程度的不断增加,同一菌株的生长量具有显著差异性(P<0.05),其中菌株MG-1的第5组和第9组差异性不显著,MG-7的第5组和第12组、第3组和第11组之间无显著差异,ZX-1的第12组和第9组无显著差异(P>0.05)。
对12 组处理进行综合比较,可以看出第7组处理(pH 3.5,乙醇体积分数10%,SO2质量浓度20 mg/L)对菌株生长的抑制程度最小,而第6组处理(pH 3.2,乙醇体积分数14%,SO2质量浓度40 mg/L)对其生长的抑制作用最大。同时,在最强胁迫处理条件下(第6组),菌株ZX-1的生长量最高,其OD600nm值为0.413,其次是MG-1(OD600nm=0.281),相对于其他菌株而言这2 株菌对胁迫强度最大的复合因素的抗性更好;菌株MG-7的耐受性最弱(OD600nm=0.214),与菌株ZX-1的生长量相比降低了约32%。
对12 组不完全正交试验结果进行直观分析(表1)可知,影响菌株MG-1和MG-7生长量的主次因素依次为乙醇体积分数>SO2质量浓度>pH值;影响菌株QL-11和ZX-1生长量的主次因素依次为乙醇体积分数>pH值>SO2质量浓度。
通过复合因素耐受性结果可知,MG-1、MG-7、QL-11、ZX-1对复合胁迫生境的耐受性存在差异,但它们在pH 3.2、乙醇体积分数14%以及SO2质量浓度40 mg/L的培养条件下均可生长增殖,具有良好的发酵耐受性。
3 讨 论
本实验考察4 个发酵因素(pH值、乙醇、SO2质量浓度和发酵温度)对不同供试菌株的耐受性。其中,在pH值为3.8~4.0的条件下,所有菌株均生长良好;而在3.0~3.5的条件下,菌株生长均受到一定抑制,且pH值越低抑制作用越强。这与Gockowiak等[15]的研究结果一致。Betteridge等[21]也指出,在pH值低于3.5的情况下,O.oeni的生长将会受到抑制。Lonvaud-Funel[22]指出,在pH值高于3.5时,菌株更易存活和生长,而在pH值低于3.0的环境中,几乎很少有菌株能够正常生长。然而,这些结果并不是绝对的,因为在葡萄酒复杂多变的环境中各种因素之间会产生相互作用,最终影响O.oeni的生存能力[23]。
乙醇耐受性因菌株而异,O.oeni菌株通常能够在含有10%乙醇的培养基中生长[15]。实验证实乙醇对O.oeni生长的影响较大,尤其在乙醇体积分数达到14%时,所有菌株生长量迅速下降,仅菌株ZX-1的OD600nm值可达到0.6左右,表现出良好的耐受性。而在低乙醇体积分数(6%和8%)条件下,所有菌株都具良好的抗性,最低OD600nm保持在0.9以上。这可能是因为乙醇作为细菌细胞膜的干扰因素,能够破坏细胞膜的完整性,改变细胞膜通透性,从而影响细菌的正常生长,而乙醇体积分数越高对其细胞膜的影响越大[24]。细菌的细胞壁、质膜和代谢途径是参与其生理变化的主要场所,其目的是确保对乙醇胁迫反应的适应性。了解乙醇对微生物细胞作用的机制,将有助于采取一定措施提高微生物对乙醇的耐受性[25]。
SO2是常用于葡萄酒酿造和其他食品生产中的重要抑菌剂[26]。O.oeni对SO2较为敏感,但不同菌株之间的抗性存在差异。本实验结果显示,SO2质量浓度在60 mg/L以下时,菌株均能生长,但在80 mg/L的条件下,菌株生长受到严重抑制,尤其在100 mg/L时,几乎没有菌株能够生长,与Maturano等[27]的研究结果一致。同时,也有研究表明,即使在高质量浓度SO2条件下没有观察到菌株的生长,但细菌在含有结合态SO2的培养基中仍然具有代谢活性,表明结合态SO2是抑菌而并不能杀菌[28]。此外,根据Wang Shaoyang等[29]的研究结果,在乳酸细菌中,O.oeni是对SO2最敏感的菌株之一。
与其他影响因素相比,温度对O.oeni影响最小。本实验中发酵温度为25 ℃时,所有菌株生长量最高,而16 ℃时生长量虽有所降低,但OD600nm也均在0.8以上,表明所有O.oeni菌株对温度都具有良好的抗性。葡萄酒中O.oeni菌株最佳生长温度在20~25 ℃之间,而在15 ℃或更低的温度下,细菌生长的可能性很小[30]。在干红葡萄酒酿造过程中较高的发酵温度会导致葡萄皮中花色苷和单宁的浸出,其中花色苷对O.oeni具有积极的作用,而单宁对O.oeni具有抑制作用,在葡萄酒MLF过程中,一般建议在18~20 ℃条件下进行,以避免发酵缓慢或延滞,对葡萄酒的品质带来不良影响[31]。
4 结 论
对甘肃河西走廊葡萄酒产区分离鉴定的7 株本土O.oeni菌株进行了发酵耐受性分析。结果表明,同一菌株对pH值、乙醇、SO2质量浓度、发酵温度等酿造条件的耐受性不同,且菌株之间存在显著差异(P<0.05)。酿造单因素结合复合因素耐受性分析证实,菌株ZX-1耐受性最佳,其次为菌株MG-1、MG-7和QL-11。发酵温度20 ℃、pH 3.5、乙醇体积分数10%和SO2质量浓度20 mg/L为4 株菌的理想生长条件;而在pH值3.2、乙醇体积分数14%及SO2质量浓度40 mg/L的最大胁迫条件下,4 株菌均可生长增殖,且ZX-1株的生长量最大。乙醇是影响菌株生长的最主要酿造因素,此外菌株QL-11和ZX-1对SO2质量浓度的耐受性高于pH值,而菌株MG-1和MG-7对pH值的耐受性高于SO2质量浓度。综合分析,菌株ZX-1、MG-1、MG-7和QL-11在葡萄酒酿造生境条件下均能够生长繁殖,具备产业化应用的潜力。

