基于C14-HSL探讨阪崎肠杆菌中信号分子与其生长机制关系
闫晓彤,罗小娟,潘洁茹,叶海梅,林 侃,李长城,方 婷,
(1.福建农林大学食品科学学院,福建 福州 350002;2.福州市疾病控制预防中心,福建 福州 350004)
阪崎克罗诺肠杆菌(Cronobacter sakazakii)作为一种新兴的致病菌是在动物与人肠道中寄生的一种无芽孢、兼性厌氧、有鞭毛的杆状革兰氏阴性菌[1]。C.sakazakii来源广泛,在多种食品中均有分离检出,包括婴儿食品[2]、生鲜食品[3]、加工食品[4]、草本植物[5]等。同时,C.sakazakii也是一种具有严重危害性的食源性致病菌,可能导致败血症、脑膜炎和坏死性肠炎等[6-7],导致可能危及生命的慢性后遗症[8],主要发生在早产儿和免疫功能低下的婴儿中。但是尽管新生儿感染的问题很突出,C.sakazakii感染也会发生在成年人群中,尤其是患有严重潜在疾病或恶性肿瘤的人群[9]。
许多菌细胞在生长繁殖过程中能够合成一种具有扩散性的小分子化学物质并渗透到细胞外,随细菌密度的不断增大,小分子化学物质的浓度达到临界阈值,此时细菌通过一种称为群体感应(quorum sensing,QS)[10-11]的调控机制感应小分子化学物质,并启动一系列靶基因的表达,从而实现交流过程。细菌分泌毒力因子、产生抗菌素或生物被膜等行为在细菌的生存过程中起着至关重要的作用[12-14],这些行为都与QS现象密切相关。QS是一种依赖于密度的机制,在繁殖过程中产生的小分子化学物质称为自体诱导物(autoinducer,AI)[15-16]。N-酰基高丝氨酸内酯(N-acyl-homoserine lactones,N-acyl-HSL,也写作AHLs)是革兰氏阴性菌QS中最常见的AI[17],但通常情况下细菌所产生的N-acyl-HSL物质含量极低,对该物质的检测存在一定困难,UPLC-MS/MS技术就是一种检测AHLs类AI的一种有效手段[18],高效液相色谱-串联质谱法是检测液体AHLs信号分子最快速并可靠的方法[19]。目前,已有研究通过信号分子探讨AHLs与其生物被膜形成的关系[20],根据菌QS信号分子的产生探讨其对食品腐败的影响[21]。据报道,细菌产生的信号分子等物质与遗传、环境因素一起参与了细菌生物膜的形成[22],而细菌的生物膜对于抗菌药物和宿主防御体系具有天然的抵抗力[23],如紫外线、渗透压力、高温、抗生素、吞噬细胞和噬菌体等[24]。因此,本研究通过对不同时间段C.sakazakii所合成的C14-HSL信号分子实际检测结果,结合预测微生物模型,追踪C.sakazakii生长周期中AI的生长动态,为进一步阐述该菌的生长机制提供新的思路。预测微生物学属于应用食品科学领域,该学科应用数学模型预测食品在加工、运输、分配以及贮藏过程中经历复杂的物理、化学以及生物变化后微生物的生长与存活情况[25]。预测模型可以用来评估食品加工的风险,通过预测致病菌与腐败菌的行为从而实施控制措施以保证食品的安全性。作为一个新兴领域,预测微生物学已成为预测食品保质期、质量控制以及风险评估的有用工具[26]。目前已开发出多种用于描述细菌生长的不同类别的预测微生物模型,IPMP(Integrated Pathogen Modeling Program)多应用于病原菌的生长模型,是美国农业部开发的预测细菌生长的模型软件,使用者输入酸碱度、温度、水分活度等影响细菌生长的因素以及初始菌数,即可获得细菌生长曲线以及生长的重要条件和生长数据。
本研究选用C.sakazakiiCICC21550菌株为研究对象,通过测定C.sakazakii生长过程中产生的C14-HSL信号分子浓度的变化,将IPMP 2013程序引入C.sakazakii的QS研究中,结合宏观生长预测模型,探究C.sakazakii的生长机制。
1 材料与方法
1.1 材料与试剂
菌株C.sakazakiiCICC21550购于中国工业微生物菌种保藏管理中心,保存于液氮罐中。Agrobacterium tumefaciensNTL4(pZLR4)是人工诱导的突变菌株,含有pZLR4质粒,在培养过程中需添加50 μg/mL的庆大霉素,但在检测实验中不添加。该菌主要用来初步验证实验菌株是否能够合成长酰基侧链的AHLs。A.tumefaciensNTL4 (pAoF64/95trac)自身能够产生AHLs类信号分子,诱导靶基因表达,产生β-半乳糖苷酶,所以检测过程中该菌应用于传感菌A.tumefaciensNTL4(pZLR4)的阳性对照。这2 株根癌农杆菌均由Stephen K.Farrand教授(美国伊利诺伊大学)馈赠。
C.sakazakii的活化与生长实验使用Luria-Bertani(LB)肉汤,每升含酵母膏粉5 g、氯化钠5 g、蛋白胨10 g、葡萄糖1 g、最终pH 7.0±0.2;C.sakazakii单菌落保存于结晶紫中性红胆盐葡萄糖琼脂(violet red bile glucose agar,VRBGA)中,每升含氯化钠5.0 g、3号胆盐1.5 g、葡萄糖10.0 g、蛋白胨7.0 g、中性红0.03 g、酵母提取物3.0 g、结晶紫0.002 g、琼脂12 g、最终pH 7.4±0.2 福州市伯乐林生物科技有限公司;1‰的蛋白胨培养基(peptone water,PW) 北京双旋微生物培养基制品厂。各培养基在使用之前均使用高压蒸汽灭菌锅于121 ℃灭菌20 min,冷却至室温后使用。
C14-HSL、X-Gal、庆大霉素 美国Sigma公司;乙酸乙酯、氯化氢等均为分析纯。
1.2 仪器与设备
Aquity超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)联用仪 美国Waters公司;SP-2300A2光吸收型全波长酶标仪 上海闪谱生物有限公司;LDZX-75KBS立式压力蒸汽灭菌锅 上海申安医疗机械厂;SW-CJ-2D微生物用超净工作台 苏州净化设备有限公司;DHP-500W电热鼓风干燥箱 上海一恒科学仪器有限公司;THZ-C台式恒温振荡器 江苏太仓实验设备厂;H-1850R高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;SHP-250低温生化培养箱 上海精宏实验设备有限公司;QL-866涡旋振荡器 海门市其林贝仪器制造有限公司。
1.3 方法
1.3.1 菌悬液的制备
将菌株C.sakazakiiCICC21550从保种管中取出,划线于VRBGA上进行隔夜活化。将活化后的单菌落利用无菌接种环转移至10 mL的新鲜LB肉汤中,于37 ℃振荡培养(130 r/min)过夜,使其恢复生长。之后,菌悬液在4 ℃条件下利用离心机使菌细胞与培养液分离,其中转速为5 000 r/min,时间10 min。用10 mL的PW重悬菌细胞洗去其表面毒素,再次重复上述离心过程,弃去上清液。重复洗菌步骤1 次后,用10 mL的1‰ PW重悬菌细胞,混匀,用1‰ PW将菌液进行梯度稀释至102~103CFU/mL,备用。
1.3.2 生长实验与计数
将LB肉汤分装于各试管中(10 mL/管),于121 ℃条件下灭菌20 min,冷却至室温后使用。将0.1 mL前述所备好的C.sakazakiiCICC21550菌悬液分别接种至各试管中,于37 ℃的生化培养箱中培养,按一定时间间隔取样测定C.sakazakii菌数。每个条件下细菌的生长曲线至少需要10 个以上的取样点。在测定菌落数时,将样液利用已灭菌的1‰ PW进行适当的梯度稀释后涂布于VRBGA中,每个平板作2 个平行。将涂布好的平板37 ℃培养24 h后计数。实验至少重复2 次,每次实验采用不同批次的C.sakazakii菌悬液。
1.3.3C.sakazakiiAHLs信号分子的生物鉴定
实验前一天,使用无菌接种环分别挑取固体培养基中C.sakazakiiCICC21550、A.tumefaciensNTL4(pZLR4)、A.tumefaciensNTL4 (pAoF64/95trac)的单菌落至10 mL的LB肉汤中,于28 ℃的恒温振荡器中振荡培养18 h,转速130 r/min。取3 支试管分别编号1、2、3:
试管1:作为阳性对照,分别添加A.tumefaciensNTL4(pZLR4)菌液30 μL、X-Gal(50 mg/mL)的二甲基甲酰胺溶液20 μL、A.tumefaciensNTL4(pAoF64/95trac)菌液30 μL、LB肉汤3 mL;试管2:作为阴性对照,分别添加A.tumefaciensNTL4(pZLR4)菌液30 μL、X-Gal(50 mg/mL)的二甲基甲酰胺溶液20 μL、LB肉汤3 mL;试管3:作为实验组,分别添加A.tumefaciensNTL4(pZLR4)菌液30 μL、X-Gal(50 mg/mL)的二甲基甲酰胺溶液20 μL、C.sakazakiiCICC21550菌液30 μL、LB肉汤3 mL。所有实验均作2 次平行,各试管于28 ℃的恒温振荡器中振荡培养24 h,观察颜色变化。
1.3.4 不同生长阶段C.sakazakiiAHLs粗提液的制备
C.sakazakiiCICC21550菌株按一定时间间隔培养不同时间后,通过离心将菌细胞与培养液分离,4 ℃、10 000 r/min离心10 min,收集上清液。添加适量的NaCl于上清液中,摇匀,用400 mL乙酸乙酯萃取上清液,使AHLs信号分子充分溶解于乙酸乙酯中,分离两相并收集有机相。同样步骤继续萃取2 次,混合2 次萃取的有机相后添加适量的无水硫酸镁除去残留水相,抽滤分离,利用旋转蒸发仪于30 ℃的条件下蒸干溶剂,用甲醇溶解附着于旋蒸瓶内壁的AHLs信号分子粗提物,定容至5 mL,于-20 ℃下保存备用。
1.3.5 不同生长阶段C.sakazakiiAHLs活性的检测
利用β-半乳糖苷酶法检测不同生长阶段C.sakazakiiAHLs信号分子的活性。首先,使用无菌接种环挑取LB琼脂培养基中A.tumefaciensNTL4(pZLR4)单菌落至10 mL的LB肉汤中,于28 ℃过夜活化2 次后,将A.tumefaciensNTL4(pZLR4)菌液稀释至OD600nm为0.5备用。分装上述菌液至高压灭菌后的离心管中(10 mL),分别将不同生长阶段下C.sakazakiiAHLs粗提液100 μL添加至含A.tumefaciensNTL4(pZLR4)菌液的各离心管中,于28 ℃培养6~8 h至OD600nm为1.0。β-半乳糖苷酶活性根据Miller等[27]的方法进行检测。每个生长阶段下C.sakazakiiAHLs活性的检测均作3 次平行,结果以±s表示。
1.3.6 UPLC-MS/MS定量检测C.sakazakiiC14-HSL信号分子
色谱条件:BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温为35 ℃;分析时间7 min;进样体积为5 μL;流速为200 μL/min;流动相:A为甲醇,B为5 mmol/L含有0.1%甲酸的乙酸铵溶液。梯度洗脱条件如表1所示。
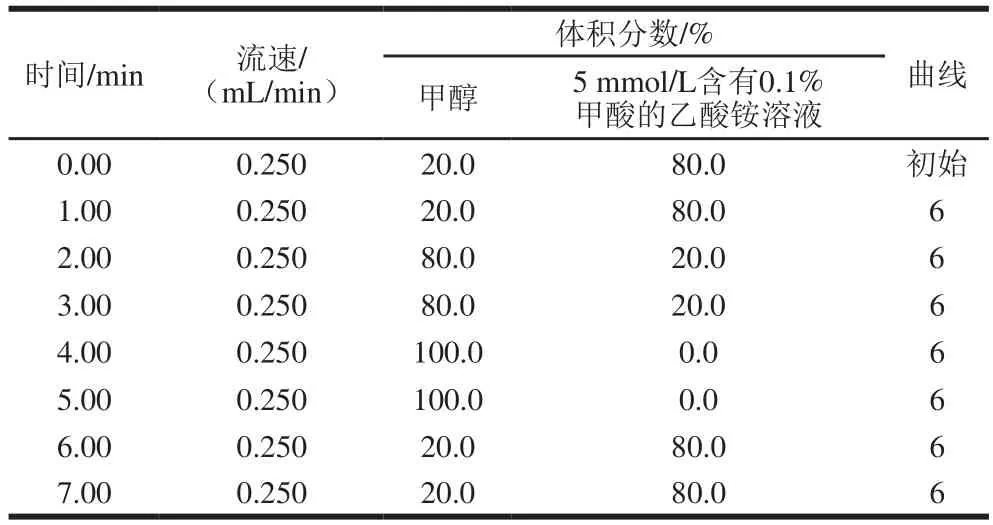
表1 梯度洗脱条件Table 1 Gradient elution conditions
质谱条件:采用电喷雾离子源,多反应离子监测;应用正离子扫描模式;离子源温度为150 ℃;毛细管电压为3.0 kV;载气为氮气,其流速为800 L/min;应用氩气为碰撞气,流速为0.2 mL/min。
1.3.7 数据拟合与模型建立
软件IPMP 2013是一种界面友好型的综合数据分析工具,由美国农业部东部地区研究中心开发而得。该软件操作简单,不需用户掌握复杂的编程知识,图1为IPMP 2013软件的工作界面,分析数据时只需将实验数据输入并选择相应模型即可获得数据拟合曲线以及数据分析报告。
本实验采用Baranyi模型、Huang模型以及Gompertz模型分别拟合37 ℃C.sakazakiiCICC21550在LB液体培养基中的生长数据以及同温度不同时间条件下C14-HSL信号分子的浓度数据,建立37 ℃条件下C.sakazakiiCICC21550生长的一级动力学模型及C14-HSL信号分子的拟合模型。此外,结合C.sakazakiiCICC21550生长的一级动力学模型及模型拟合参数,进一步从微观角度(C14-HSL信号分子的拟合模型)探究C.sakazakii的生长机制。
图1 IPMP 2013的图形用户界面Fig.1 Graphical user interface of IPMP 2013
2 结果与分析
2.1 A.tumefaciens NTL4(pZLR4)检测AHLs信号分子
在提取C.sakazakiiAHLs信号分子之前,利用A.tumefaciensNTL4(pZLR4)生物传感菌再次验证C.sakazakiiCICC21550能够产生AHLs类AI。如图2所示,在底物X-Gal的存在下,C.sakazakiiCICC21550能使生物传感菌A.tumefaciensNTL4(pZLR4)产生蓝绿色反应。该颜色的产生表明C.sakazakiiCICC21550能够合成AHLs类AI。

图2 A.tumefaciens NTL4(pZLR4)对AHLs信号分子的生物鉴定Fig.2 Bioassays with A.tumefaciens NTL4 (pZLR4) for detection of AHLs signal molecules
2.2 不同生长阶段C.sakazakii AHLs活性的变化
A.tumefaciensNTL4(pZLR4)含pZLR4质粒,在外源酰基长链AHLs存在时诱导产生β-半乳糖苷酶,水解X-Gal产生蓝绿色。当外源N-酰基高丝氨酸内酯信号分子的浓度越大,A.tumefaciensNTL4(pZLR4)所表达的β-半乳糖苷酶的活性越强,因此,通过检测反应体系中β-半乳糖苷酶的活性变化在一定程度上可间接反映N-酰基高丝氨酸内酯信号分子的含量多少。如图3所示,C.sakazakiiCICC21550生长期间AHLs的活性检测表明,不同培养时间下C.sakazakiiCICC21550所合成的AHLs的活性存在差异。此外,AHLs的活性随细菌细胞密度的增大而增大,具有密度依赖性,当细菌细胞生长达最大值(18 h)时,C.sakazakiiCICC21550所合成的AHLs的活性达最大,随后细菌细胞的生长繁殖处于稳定期甚至衰亡期,C.sakazakii所合成的AHLs的活性逐渐下降。
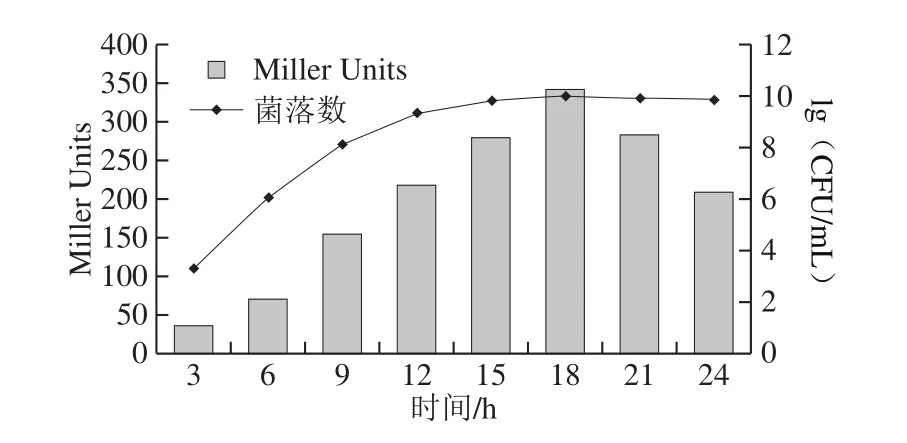
图3 C.sakazakii CICC21550生长期间AHLs活性与菌落数的关系Fig.3 Relationship between AHL activities and bacterial counts during the growth of C.sakazakii CICC21550
2.3 37 ℃条件LB液体培养基中C.sakazakii的生长拟合曲线
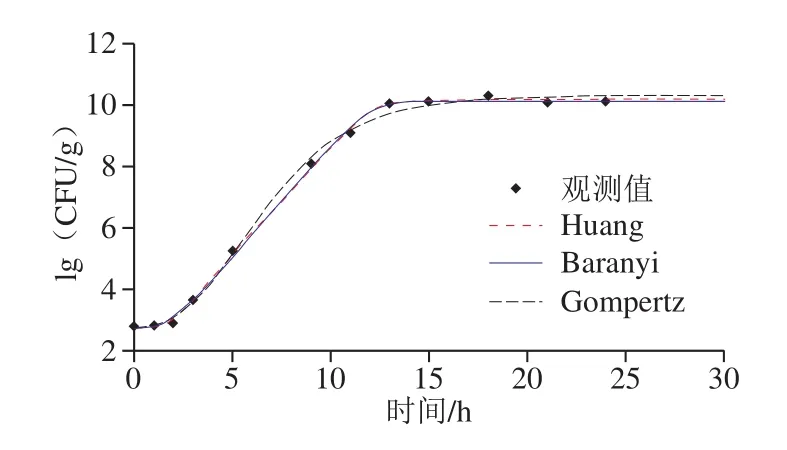
图4 37 ℃条件下LB中C.sakazakii生长的一级拟合曲线Fig.4 Growth curves fitted to different primary models of C.sakazakii in LB medium at 37 ℃
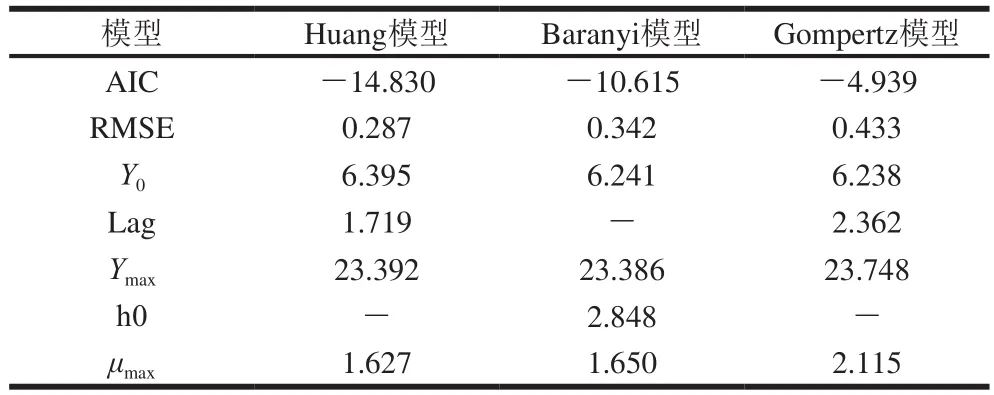
表2 37 ℃条件下LB中C.sakazakii的一级模型拟合参数Table 2 Parameters of different primary models for C.sakazakii growth in LB medium at 37 ℃
Huang模型、Baranyi模型以及Gompertz模型的拟合参数AIC以及RMSE数值越小表示数据在模型中的拟合度越高。结合模型拟合曲线(图4)可发现,Huang模型及Baranyi模型具有较高的拟合度。此外,根据拟合参数(表2),Huang模型的AIC以及RMSE数值均小于Baranyi模型与Gompertz模型。由此可见,Huang模型是37 ℃条件下C.sakazakiiCICC21550在LB培养基中生长的最佳拟合模型。
2.4 37 ℃条件下C.sakazakii的生长过程中C14-HSL浓度变化的拟合曲线
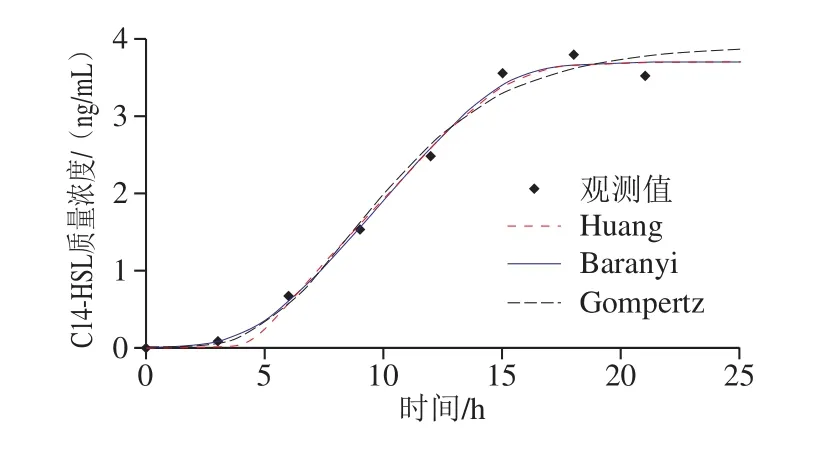
图5 37 ℃条件下C.sakazakiiC14-HSL的一级模型拟合曲线Fig 5 Curves of C14-HSL secreted by C.sakazakii at 37 ℃ againstbacterial growth time fitted to different primary models
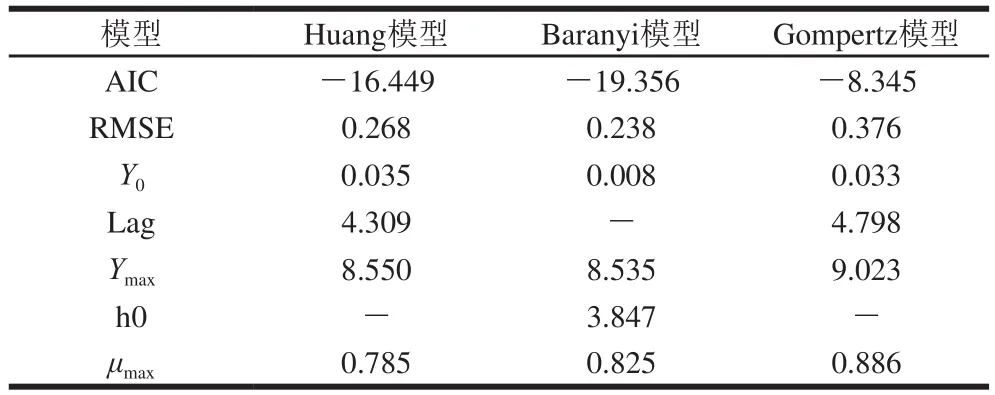
表3 37 ℃条件下C.sakazakiiC14-HSL的一级模型拟合参数Table 3Parameters of different primary models for C14-HSL secreted by C.sakazakii at 37 ℃
为进一步从微观角度探究C.sakazakii的生长机制,根据UPLC-MS/MS定量检测AHLs的方法,检测不同培养时间条件下C.sakazakiiCICC21550所合成的C14-HSL信号分子的浓度,应用Baranyi模型、Huang模型以及Gompertz模型拟合C14-HSL浓度数据,拟合曲线如图5所示。C14-HSL信号分子的浓度随C.sakazakiiCICC21550的生长具有一定规律性,呈先上升后下降的趋势。根据模型拟合参数(表3),Baranyi模型、Huang模型以及Gompertz模型对C14-HSL均具有较好的拟合度,各拟合模型曲线具有明显的迟滞期。其中,Baranyi模型的RMSE和AIC的值分别为0.268和-16.449;Huang模型的RMSE和AIC的值分别为0.238和-19.356;Gompertz模型的RMSE和AIC的值分别为0.376和-8.345。当RMSE和AIC的值越小说明曲线的拟合性越好,所以由以上数据可知Baranyi模型可以很好的模拟37 ℃条件下C.sakazakii的生长过程中C14-HSL浓度变化的曲线。通过Baranyi模型拟合得到的C14-HSL信号分子的最大浓度Ymax的值为8.535,最大生成速率μmax的值为0.825。
可见,IPMP程序不仅适用于细菌生长的模型拟合,对于微观角度细菌QS的AI模型拟合同样适用。此外,结合37 ℃ LB液体培养基中C.sakazakii的生长拟合模型,对比表2与表3的拟合参数可以发现C14-HSL信号分子的产生与细菌的生长存在正相关,并且C14-HSL信号分子产生的迟滞期明显比C.sakazakiiCICC21550细菌生长的迟滞期长,可见细菌QS系统的启动要建立在细菌生长适应环境之后的基础上。刘国荣等[28]在分析菌体密度和细菌素合成的相关性时表明,当菌体细胞达到活菌数为7.31(lg(CFU/mL))时,细菌素才开始合成。发酵过程中,菌体密度与细菌素的合成呈现正相关性。朱军莉等[29]研究表明,大黄鱼在4 ℃贮藏初期表现出AI-2信号分子活性,随着贮藏时间的延长,细菌的增殖,AI-2信号分子强度也逐渐增加。李灿等[30]对凡纳滨对虾中优势腐败菌的QS信号分子测定表明,AHLs活性与菌体生长密度呈正相关,AI-2产生量在菌体生长对数期累积,在菌体生长24 h后活性迅速减弱。这些研究都进一步表明,调节细菌QS现象的信号分子与细菌的密度存在正相关关系,QS现象发生在细菌密度达到一定数值的基础之上,进一步验证,细菌QS系统的启动可能要建立在细菌生长适应环境之后的基础上。
3 结 论
本实验主要探究C.sakazakii生长过程中C14-HSL信号分子的合成规律,利用IPMP程序建立了阪崎肠杆菌数量、C14-HSL信号分子与时间的关系,追踪C.sakazakii生长周期中AI的生长动态,结合细菌生长的宏观模型,为进一步阐述该菌的生长机制提供新的思路。结果表明:1)C.sakazakiiCICC21550在对数生长初期就有检出C14-HSL信号分子,在细菌生长的稳定期达最大值,随后呈逐渐下降趋势,具有明显的密度依赖性。通过Baranyi模型拟合得到的C14-HSL信号分子的最大浓度Ymax的值为8.535,最大生成速率μmax的值为0.825。2)IPMP程序不仅适用于细菌生长的模型拟合,对于微观角度细菌QS的AI模型拟合同样适用。Baranyi模型、Huang模型以及Gompertz模型等一级模型对C14-HSL均具有较好的拟合度,各拟合模型曲线具有明显的迟滞期,且迟滞期明显比细菌生长的长。

