重组腺病毒p53 基因对口腔鳞癌患者外周淋巴细胞亚群的影响
刘三霞 王 超 邓子辉 王 刚 王 昊 胡 敏
多种肿瘤的体外移植瘤模型和临床研究均表明Ad-p53 的局部应用能有效抑制肿瘤的进展、阻止新生肿瘤的形成[1-6]。我们在既往研究中也评价了手术联合Ad-p53 局部注射治疗口腔鳞癌患者的安全性和有效性[7]。但机体对Ad-p53 局部应用产生的免疫反应还不是很清楚,而机体的抗肿瘤免疫反应对于肿瘤患者来说尤其重要,因此我们需要观察局部应用Ad-p53 后机体免疫功能的变化。
淋巴细胞亚群在细胞抗肿瘤免疫反应中起重要作用。外周血中淋巴细胞亚群比例的分布反映了机体抗肿瘤免疫状态。利用流式细胞仪分析外周血中淋巴细胞亚群在医学上应用广泛,其有助于多种疾病的诊断和治疗,如自身免疫性疾病、免疫缺陷、感染、恶性肿瘤和器官移植等[8]。因此我们对在我院接受手术和重组人腺病毒p53 注射液(rAdp53)联合治疗的12 位口腔癌患者治疗前后的外周血淋巴细胞亚群进行检测,并与正常人群、以及仅接受手术治疗的12 例口腔癌患者进行对比分析,以评估局部注射rAd-p53 对口腔癌患者抗肿瘤免疫功能的影响。
1.资料与方法
1.1 临床资料 共有36 例符合入选标准的口腔癌患者纳入临床研究,均为我院2012 年8 月至2015 年1 月住院并行手术治疗的口腔癌患者。病例入选标准如下[7]:外周血象、肝、肾功能和凝血功能基本正常;病理检查证实为口腔鳞状细胞癌;病灶手术可切除,年龄大于18 周岁。排除标准:有肿瘤远处转移;既往放疗或化疗史;近期内使用抗病毒药物者,长期服用免疫抑制药物或因其他原因引起的免疫功能缺陷者。
经充分告知后,患者自主选择是否行rAdp53局部注射治疗,并签署知情同意书。根据患者是否自愿接受rAdp53 治疗分为用药组(rAdp53 联合手术治疗组)和对照组(单纯手术治疗组)。用药组募集15 位患者,对照组21 例,但实验组和对照组均只有12 名患者完成治疗前及治疗后淋巴细胞亚群检测。两组患者基本信息、发病部位、临床分期及肿瘤分化程度等详细资料见表1,经非配对t 检验或卡平方检验,用药组和对照组在年龄、性别、临床分期和肿瘤分化方面均无统计学差异。

表1 口腔癌患者临床资料情况表
1.2 主要试剂及仪器 主要试剂有CD8-FITC/CD4-PE/ CD3-PC5 标记三色荧光素抗体及其同型阴性对照,CD3-FITC/ CD56-PE/ CD16-PC5标记三色荧光素抗体及其同型阴性对照,CD8-FITC、CD28-FITC、CD45RO-FITC、CD29-FITC、CD45RAPE、CD25-PE、HLA-DR-PE、CD19-ECD、CD8-ECD、CD3-PC5、CD4-PC7 标记单色荧光素抗体及FITC、PE、ECD、PC5、PC7 单色同型阴性对照抗体;Q-prep 自动溶血仪、流式细胞仪(Cytometer FC 500 MPL)均为美国Beckman Coulter 公司所产。
1.3 方法 用药组患者术中肿瘤扩大切除后于手术切缘多点注射重组人腺病毒p53 注射液1×1012VP/ 2cm2(用生理盐水稀释后使用),术后隔天给予rAd-p53 1×1012VP,共3 次。对照组患者仅行手术治疗。所有患者手术前1 天、手术后1 周均抽取2ml 外周血利用流式细胞仪进行淋巴细胞亚群表型分析检测。此外,为了验证口腔癌患者确实存在免疫功能紊乱,尤其是淋巴细胞亚群比例失衡,我们与解放军总医院肿瘤研究所流式检测中心合作,募集了77 位健康志愿者,对其外周淋巴细T cell)和辅助性T 细胞(CD3+CD4+T cell)比参考值明显降低(图1A,unparied t test,P<0.05)。然而,细胞毒性/ 抑制性T 细胞(CD3+CD8+T cell)和CD4+T/ CD8+T 比值仅轻度降低(图1A,unparied t test,P>0.05)。NK 细胞(CD3-CD16+CD56+)比例增加而NK 样T 细胞(CD3+CD16+CD56+)降低,两者的变化均无统计学意义(图12B,unparied t test,P>0.05)。胞亚群进行流式分析。这些志愿者被要求大于18周岁,性别不限,身体健康,无全身系统性疾病,无长期服药史及近期服药史。

表2 所有口腔癌患者及健康志愿者外周淋巴细胞亚群比例(M±SEM)
1.4 统计学处理 采用SPSS13.0 软件统计分析,利用非配对t 检验(the mean±standard error,M±SEM)对治疗前口腔癌患者与健康志愿者之间以及治疗前两组间各细胞亚群比例进行组间差异性分析;采用自身配对t 检验比较两组患者治疗前后各细胞亚群比例变化规律及有无显著性差异,P<0.05 为差异有统计学意义。
2.结果
2.1 口腔癌患者外周淋巴细胞免疫功能状态纳入研究的36 位口腔癌患者治疗前均行外周血淋巴细胞亚群检测,口腔癌患者的NK 细胞和T 淋巴细胞亚群比例以及从健康志愿者中统计得到的参考值均在表2 中列出(M±SEM)。并以柱状图的形式对口腔癌患者与健康志愿者的各淋巴细胞亚群进行了比较,如图1。在此研究中,总T 细胞(CD3+

图1 口腔癌患者与健康志愿者的各淋巴细胞亚群比例柱状比较图
根据淋巴细胞表面活化分子HLA-DR 和CD28分子的表达,检测了外周血中活化淋巴细胞的比例。在口腔癌患者中,活化总T 细胞(CD3+HLADR+)较参考值明显增高,同时静止总T 细胞(CD3+HLA-DR-)比例较参考值明显降低,两者与参考值的差异均有统计学意义(图1C,unparied t test,P<0.01)。共刺激分子CD28 的表达比例以及细胞毒 性T 细 胞(cytotoxic T lymphocytes,CTLs,CD8+CD28+)比例较参考值明显降低(unparied t test,P<0.0001),而抑制性T 细胞(suppressor T lymphocytes,Ts,CD8+CD28-)则出现轻度增加(图1D,unparied t test,P>0.05)。
2.2 rAdp53 诱导的外周细胞免疫反应 为了观察或评价rAdp53 对患者外周淋巴细胞的影响,我们比较了用药组和对照组之间各淋巴细胞亚群的比例。检测值以M±SEM 的形式在表2 中列出,统计学分析得到的P 值见表3。图2 为实验组和对照组患者淋巴细胞亚群比例分布的散点图。检测结果如下:治疗前实验组和对照组各淋巴细胞亚群比例均无明显差异(unpaired t test,P>0.05)。治疗后对照组总T 细胞(CD3+T) 和CD8+T 比例均降低,而CD4+辅助性T 细胞比例和CD4/ CD8 比值增加;用药组患者治疗后总T 细胞比例变化与对照组相同,均较治疗前降低,而CD4+辅助性T 细胞和CD4/ CD8 比值下降,CD8+T 细胞无变化。NK 细胞在用药组中比例轻度增高而在对照组中轻度降低;NKT 细胞变化趋势同NK 细胞。经统计学分析,这些变化均无显著性差异(图2A,B,paried t test,P>0.05)。
实验组患者治疗后活化总T 细胞和细胞毒性T 细胞较治疗前均增加,而静止性总T 细胞和抑制性T 细胞较治疗前降低。相反,对照组的活化总T 细胞和细胞毒性T 细胞治疗后比例均低于治疗前(图2C,D),同时抑制性T 细胞比例也较治疗前增加。尽管这些变化中,仅实验组静止性T 细胞比例降低与治疗前相比具有显著性差异(Ts,P<0.05),但其他细胞亚群的增加-降低趋势是很明显的。
3.讨论
肿瘤细胞和免疫系统之间的相互作用非常复杂,在恶性肿瘤患者中往往存在机体免疫平衡失调,尤其是在机体抗肿瘤免疫反应中起重要调控作用的T 淋巴细胞亚群出现平衡失调。癌症患者包括头颈癌已被公认为存在免疫功能紊乱[9-10],也有证据表明口腔癌患者外周血淋巴细胞和肿瘤浸润淋巴细胞存在着免疫缺陷[11]。外周细胞免疫功能缺陷影响头颈癌患者预后,如外周血中CD8+T 细胞[12]、NKT 细胞[13]比例降低被认为与预后差相关。NK细胞比例降低被认为可能导致了头颈癌患者免疫逃逸的结果[14]。因此在头颈癌患者外周血中检测机体自身肿瘤特异性T 细胞反应和抗肿瘤治疗或者免疫治疗诱导的肿瘤特异性反应是必要的。在我们的研究中,口腔癌患者总T 细胞和CD4+T 细胞比例较健康人群明显降低,共刺激信号分子CD28 的表达比例、细胞毒性T 细胞比例明显降低而抑制性T 细胞比例增高。此外,活化总T 细胞明显增加而静止总T 细胞明显降低。这些淋巴细胞亚群比例的变化(与健康人群比较)具有显著性差异,这种淋巴细胞亚群比例分布异常表明口腔癌患者确实存在免疫功能缺陷。
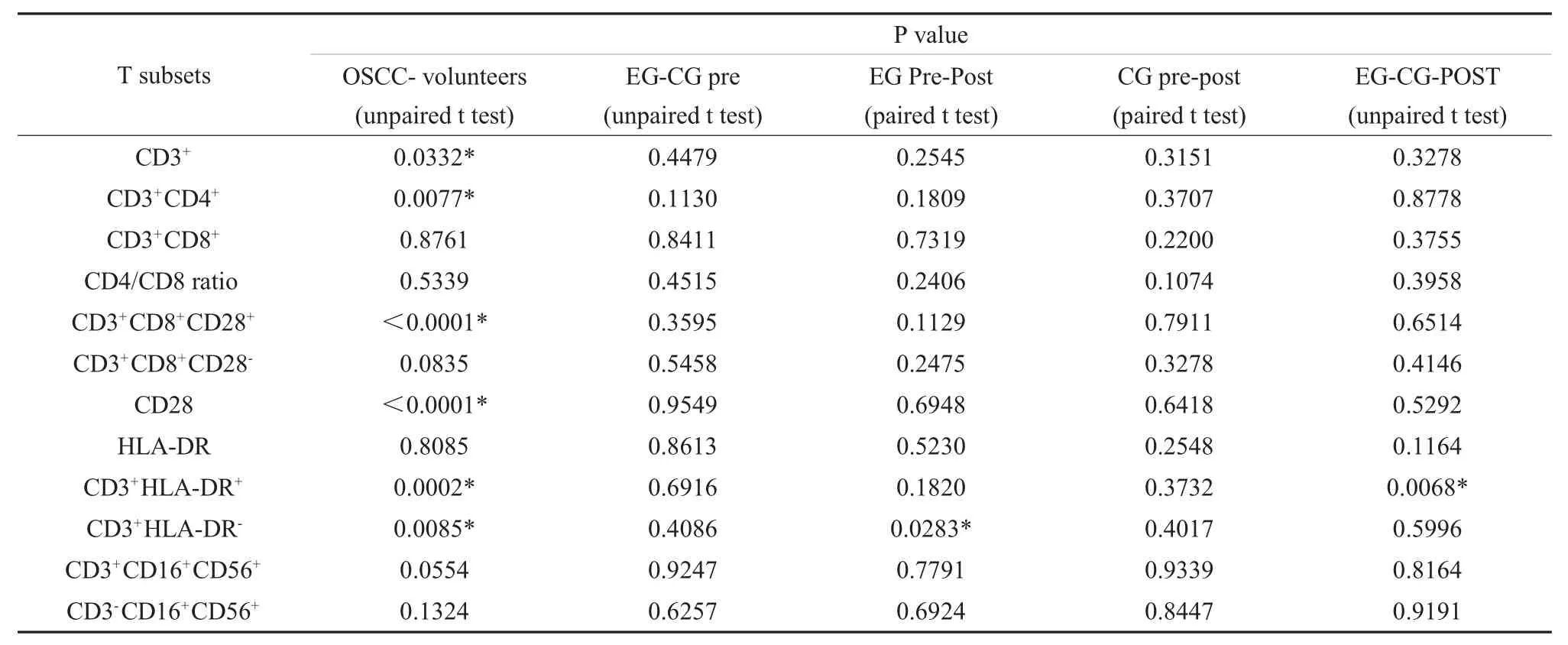
表3 不同组间外周淋巴细胞亚群T 检验P 值表
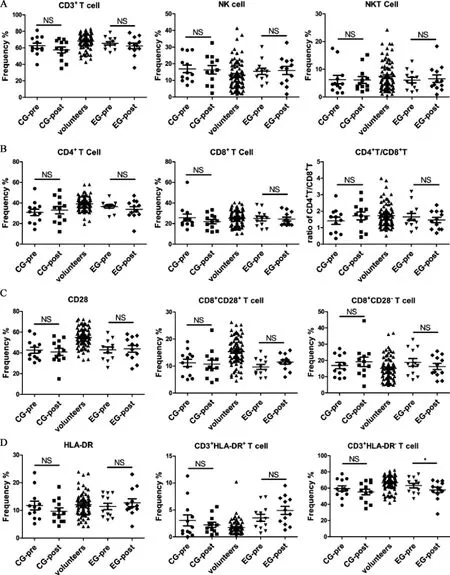
图2 用药组和非用药组患者淋巴细胞亚群比例分布的散点图
手术治疗或联合放化疗是口腔癌治疗的主要方法。放化疗对骨髓具有明显抑制作用,而之前的研究发现癌症患者手术后淋巴细胞的免疫功能可不同程度的恢复[15-16]。这可能与瘤体去除后,肿瘤产生的免疫抑制因子减少或消失有关;或者手术能诱导创伤应激反应从而增强抗肿瘤免疫功能。然而,也有一些研究表明由于残留的微小病灶存在、手术创伤的刺激以及放化疗的副作用,使癌症患者的免疫抑制状态在治疗后会持续很长时间[15]。Bottcher[17]等发现外周血中T 细胞和NK 细胞的比例分布与患者接受到的治疗方式相关,尤其易受手术联合放化疗治疗方法的影响。在本研究中,对照组患者手术前后各淋巴细胞亚群比例无明显变化,表明对照组患者在接受手术治疗后免疫抑制状态仍然存在。因此,在进行手术或放化疗的同时,适时采取相应的辅助措施,增强肿瘤患者的免疫功能,可能能更好的抑制肿瘤的复发和转移。
大量的研究表明重组腺病毒携带的wtp53 基因抗肿瘤疗效主要与wtp53 基因抑制细胞周期、诱导细胞凋亡作用相关。但也有些研究认为p53 与免疫系统之间的密切关系在有效抑制甚至消灭肿瘤细胞的过程中起重要作用[18]。比如,p53 蛋白能作为肿瘤相关抗原刺激免疫反应。此外,p53 还能作为转录因子,直接激活免疫细胞某些基因的表达,在这些细胞的增殖和功能方面发挥重要的调节作用。野生型p53 功能的缺乏通过干扰炎性调节因子的表达来影响固有免疫反应[19]。外源性wtp53 转导进入肿瘤细胞后能作为肿瘤特异性抗原激活NK细胞[20]和T 细胞[21]。通过复制缺陷型腺病毒转染进入肿瘤细胞的wtp53 在肿瘤细胞内过表达,导致p53 蛋白在细胞质内积聚。一部分坏死的肿瘤细胞释放的P53 蛋白被抗原提呈细胞加工提呈给T 细胞。P53 特异性T 细胞被活化并诱导抗肿瘤免疫反应[18]。还有些文献报道野生型和突变型p53 蛋白特异性多肽能在正常鼠或荷瘤鼠体内诱导MHC-II限制性CD4+T 细胞活化[22-23]。在我们的研究中,用药组患者HLA-DR 分子的表达和活化总T 细胞的比例在治疗后较治疗前明显增加而静止总T细胞明显降低。相反,对照组患者治疗前后无明显变化。
有文献报道,当注射Ad-p53 后,肿瘤细胞内过量表达外源性野生型p53 蛋白,能被细胞内NKG2D 分子提呈到细胞表面,作为肿瘤抗原,刺激机体产生肿瘤特异性的CTL 细胞[24]。这与本研究中用药组患者治疗后细胞毒性T 细胞比例较治疗前上调,而抑制性T 细胞比例降低相符合。变化幅度虽未达到统计学意义,但这种增加-降低的趋势很明显。变化无显著性差异可能与纳入研究的口腔癌患者数目少有关。Hoffmann[25]与Tsukishiro 等[26]发现头颈癌患者外周循环中CD8+T 细胞尤其是细胞毒性T 细胞对凋亡非常敏感,甚至是凋亡的首选靶细胞。这可能是用药组细胞毒性T 细胞的增加幅度未达到统计学差异的另一重要原因。
NK 细胞主要在外周血中循环。然而,在某些病理条件下如病毒或细菌感染,NK 细胞能选择性的聚集在感染的组织部位[27]。腺病毒载体是目前用于基因转染最有效的载体之一,它具有免疫原性,能诱导炎性反应,这种炎性反应曾被认为是腺病毒作为载体的副作用。然而,腺病毒载体诱导的炎性反应能激活抗肿瘤免疫效应细胞如巨噬细胞和NK细胞,从而在短时间内增强抗肿瘤反应。而且,一些研究表明NK 细胞能表达一些趋化因子受体,对一些趋化因子产生反应[28]。p53 可以转录上调Ⅳ型跨膜趋化因子Fractalkine 的表达,表达Fractalkine 的癌细胞可与表达Fractalkine 受体的NK 细胞紧密结合,从而被NK 细胞杀灭。一项关于Ad-p53 治疗卵巢癌的研究表明NK 细胞在Ad-p53 产生的旁观效应中起重要作用[20]。在本研究中,用药组NK 细胞比例轻度增加,而对照组轻度降低。NK 细胞比例在两组中的不同变化趋势可能与是否接受rAdp53 治疗有关。我们推测本研究中有限的患者数目是导致NK 细胞比例在两组中的变化均未达到统计学差异的原因。
综上所述,我们在此研究中检测并分析了口腔癌患者的细胞免疫功能状态以及比较了接受rAdp53治疗患者淋巴细胞亚群比例的变化,我们发现口腔癌患者确实存在抗肿瘤免疫功能缺陷,手术在短时间内并不能有效改善患者的抗肿瘤免疫功能。而作为辅助治疗手段,在围手术期局部应用rAd-p53能在一定程度上增强患者的抗肿瘤免疫能力。由于本研究中患者的随访期还较短,rAd-p53 对口腔癌患者产生的外周淋巴细胞亚群的变化能维持多长时间及其与患者预后的关系尚不能进行分析,但从用药后免疫功能改善这方面推测,口腔癌患者可能从手术联合rAd-p53 局部应用治疗中获益。

