纤维素高效降解真菌的筛选及其降解森林地表可燃物的效果*
孙思琦 瓮岳太 邸雪颖 刘志华 杨 光
(东北林业大学林学院 森林生态系统可持续经营教育部重点实验室 哈尔滨 150040)
森林地表可燃物的自然分解过程缓慢,导致林内物质积累,气候干燥时造成森林火灾风险(Nakayamaetal., 2001),使森林防火难度增大。纤维素是森林可燃物的主要组分,在很大程度上控制着森林可燃物的分解过程(Steffenetal., 2007; Yueetal., 2016)。温带森林地表可燃物的分解主要受真菌活动影响(Watlingetal., 1998; Hattenschwileretal., 2005)。真菌可通过自身分泌的酶将其他微生物不能分解的纤维素等高分子化合物分解为简单的小分子化合物,因而能加速森林地表可燃物分解过程(Kjølleretal., 1982; Djarwantoetal., 2009)。筛选并应用纤维素高效降解真菌,使其分解地表可燃物中不易分解的纤维素组分,减少森林可燃物载量,可达到降低森林火险等级的目的。然而,能完全降解森林地表可燃物等含纤维素类物质的高活性菌株十分缺乏,且具有高纤维素酶活性的菌株对枯枝落叶的分解能力不一定强(Kwonetal., 1996)。因此,为了采取生物防火措施在一定程度上降低森林可燃物载量,分离筛选能有效降解地表可燃物中纤维素的菌种十分必要。
Djarwanto等(2009)在印度尼西亚南苏门答腊岛的相思树(Acaciamangium)人工林内,采集真菌的子实体和有菌丝附着的地表可燃物,从中分离筛选出6株真菌,然后以相思树木屑为分解基质进行了基于木质素和综纤维素质量分数的降解试验,根据试验结果筛选出层菌纲(Hymenoycetes)非褶菌目(Polyporales)Polyporussp.为降解相思树木屑中木质素和综纤维素的最有效菌种; Boberg等(2011)从针叶林地表可燃物中分离得到9株真菌,测试了其降解欧洲赤松(Pinussylvestris)针叶的能力,其中盘菌纲(Discomycetes)柔膜菌目(Helotiales)的Chalaralongipes及其他3个菌株、担子菌纲(Basidiomycetes)的锁瑚菌属(Clavulina)/肉片齿菌属(Sistotrema)可降解纤维素,松针散斑壳(Lophodermiumpinastri)[斑痣盘菌目(Rhytismatales)]极易分解纤维素,并可造成木质素的大量损失。
帽儿山地区地处中温带,温度湿度较低,森林地表可燃物的分解受到很大制约。本研究筛选帽儿山地区阔叶与针叶人工林地表可燃物中的纤维素高效降解真菌,进行了可燃物样品降解试验并分析其降解效果,可为制定森林可燃物合理管理策略提供科学依据,并为应用生物降解方法降低森林地表可燃物载量提供新技术。
1 材料与方法
1.1 试验材料
1.1.1 样品 室内降解可燃物样品采自帽儿山实验林场尖砬沟森林培育实验站的兴安落叶松(Larixgemelinii)、胡桃楸(Juglansmandshurica)、水曲柳(Fraxinusmandshurica)、红皮云杉(Piceakoraiensis)林内的未分解层(L层,Litter)、半分解层(F层,Fermentative layer)和全分解层(H层,Humus horizon)(Cookeetal., 1984)。野外降解可燃物样品为采自胡桃楸、兴安落叶松以及胡桃楸×兴安落叶松混交林内的凋落叶。
1.1.2 培养基 孟加拉红培养基(购自北京索莱宝科技有限公司)、羧甲基纤维素钠(CMC-Na)琼脂培养基(黄秀梨,1999)、马铃薯葡萄糖琼脂(PDA)培养基和麦芽浸粉液体培养基: 麦芽浸粉20 g,吐温800.5 g。
1.2 试验方法
1.2.1 纤维素降解菌的分离与筛选 将各层样品分别置于盛有无菌水的三角瓶内,于200 r·min-1的摇床上振荡20 min混匀,将母液按10、20、30倍稀释成系列浓度梯度,用移液枪吸取0.2 mL涂布到孟加拉红培养基平板上,每个浓度梯度设3个重复,置于28 ℃恒温培养箱中倒置培养7天。之后分别挑取各菌落边缘的菌丝至PDA培养基平板上,反复接种进行分离纯化,直至获得纯菌株。
采用刚果红染色法在CMC-Na培养基上筛选纤维素降解菌(Dingetal., 1999)。将已纯化的菌株呈品字形接种于CMC-Na培养基上,每个菌株做3个重复,于28 ℃恒温培养箱中倒置培养。待菌种在平板上长出可见菌落后,向培养基中加入0.2%的刚果红试剂2 mL进行染色,轻轻摇动,使试剂铺满整个平板,放置15 min后,将刚果红试剂倒去。再加入0.5%的NaCl溶液2 mL进行脱色,轻轻摇动,使NaCl溶液铺满培养基表面,放置15 min,再将NaCl溶液倒去。若菌落周围出现透明水解圈则该菌株可产生纤维素酶,水解圈越大则产生的纤维素酶活性越强,用游标卡尺测量水解圈与菌落直径大小,用以下公式计算各菌株的纤维素分解指数,通过比较得到高活性纤维素酶菌株:
1.2.2 纤维素降解菌的鉴定 将按上述步骤筛选出的高活性纤维素酶菌株接种到PDA培养基上,于28 ℃恒温培养数天,直至获得大量成熟孢子。首先,挑取有孢子的菌块于盖玻片上,放在载玻片上进行镜检,根据产孢结构、孢子形状特征进行形态学鉴定; 其次,对其ITS序列进行DNA测序,通过将测序得到的ITS序列与GeneBank数据库中已知真菌ITS序列进行比较,从而获得种属信息,利用MEGA 5.1软件构建系统发育树。
1.2.3 地表可燃物室内降解试验 将1.1.1中于兴安落叶松与胡桃楸林内未分解层收集的针叶可燃物裁成2 cm大小片段,阔叶可燃物裁成1 cm×1cm碎块,65 ℃条件下烘干至恒重。放入装有10 mL已灭菌的麦芽浸汁液体培养基的50 mL三角瓶内,每瓶放0.8 g可燃物作为分解基质,该分解基质分为3种类型,即针叶分解基质(每瓶0.8 g针叶可燃物)、阔叶分解基质(每瓶0.8 g阔叶可燃物)和针阔叶混合分解基质(每瓶0.4 g针叶可燃物和0.4 g阔叶可燃物)。
在无菌操作台内打开纯培养的高活性纤维素酶菌株平板,用已灭菌的打孔器(外径6 mm)在菌丝生长旺盛区域制取菌饼20个,将菌饼接入装有100 mL灭菌水的三角瓶,于28 ℃、160 r·min-1下恒温振荡培养7天,于4 000 r·min-1下离心10 min,上清液即为高活性纤维素酶菌株的菌悬液。将不同菌株的菌悬液分别接入装有3类分解基质的三角瓶,每瓶接种量均为300 μL,置于人工培养箱内(温度25 ℃、湿度80%、无光照)。于装有3类分解基质的三角瓶中加入300 μL灭菌水作为对照处理,其他培养条件同前。降解试验持续80天,每隔20天取样1次,共取样4次,每次每种处理每种基质取样3瓶,共288瓶。
用镊子将经降解后的可燃物小心取出,置于灭菌后的培养皿中,往培养皿中加入无菌水,多次漂洗可燃物,并用镊子将菌丝与调落物分离。处理后的可燃物样品放入65 ℃烘箱中烘干至恒质量,粉碎,过40目筛备用。
1.2.4 野外降解样地设置 在帽儿山实验林场的胡桃楸、兴安落叶松以及胡桃楸×兴安落叶松混交林内,各设置3个20 m×20 m的标准地,每个标准地内随机设置9个1 m×1m的小样方,作为降解试验点。
1.2.5 地表可燃物野外降解试验 准确称取采回的凋落叶10 g,装进大小为15 cm×10 cm、孔径90目的尼龙凋落物袋中,3种林型各装540袋,共1 620袋,并用记号笔在凋落物袋上标记林型与样品号,称重并记录每袋样品初始质量。在设置好的每个小样方内各放置对应林型的18袋可燃物,另将不作任何处理的对照凋落物袋按林型随机放置在不同小样方内。
选取经1.2.3筛选出的2株纤维素高效降解真菌A4[紧密帚枝霉(Sarocladiumstrictum)]与A2[肉色隔孢伏革菌(Peniophoraintranata)]作为野外降解试验供试菌种。在无菌操作台内打开纯培养的供试菌株平板,用已灭菌的打孔器(外径6 mm)在菌丝生长旺盛区域制取菌饼,将40个菌饼接入装有400 mL添加了吐温80的麦芽浸粉培养基(Leeetal., 2015)的1 000 mL三角瓶中,于28 ℃、180 r·min-1下恒温振荡培养5天,用灭菌的8层纱布过滤,得到2种供试菌种的菌悬液,设置低、中、高3种剂量分别为50、200和400 mL。混合菌剂为2种菌悬液等体积混合,剂量同上。为方便描述,菌株A2、菌株A4以及2菌株混合制得菌剂分别记为菌剂A、菌剂B、菌剂C。将制备好的3种降解剂分别装瓶备用。3种不同剂型(菌剂A、菌剂B、菌剂C)、3种剂量(低、中、高)将不同菌剂对应喷洒到设置好的9个小样方内装有可燃物的凋落物袋上,喷洒需尽量均匀,使袋内可燃物均能接触到菌剂。3种林型的每块标准地均作相同处理。
于喷洒后每月分别采集经菌剂处理和未作处理(对照)的凋落物袋,带回实验室,于80 ℃烘箱中烘干至恒质量,称质量后将可燃物粉碎,过40目筛备用。
1.2.6 综纤维素(纤维素与半纤维素)含量测定 采用纤维测定仪,根据Van Soest(1963)的方法,测定综纤维素质量分数。精确称取1 g(记为m)样品,放入装有灰化后的硅藻土的坩埚(40~100 μm)中。用中性洗涤剂(3%十二烷基硫酸钠溶液)在消煮管中加热消煮60 min。经消煮后,残渣由半纤维素、纤维素、木质素和硅酸盐组成,干燥后称质量记为A。样品再用酸性洗涤剂(2%十六烷基三甲基溴化铵溶液)消煮60 min,剩余物为纤维素、木质素和硅酸盐。样品在室温下用12 mol·L-1硫酸消解,剩余物干燥后称质量记为B,为木质素和硅酸盐。随后于550 ℃马弗炉中灰化2 h。冷却至室温后,剩余物称质量记为C,即硅酸盐的质量。
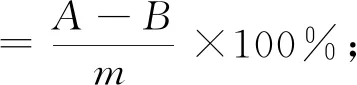
(1)
综纤维素降解率=(C0-Ct)/C0×100%。
(2)
式中:C0为初始综纤维素质量分数;Ct为降解后综纤维素质量分数。
1.2.7 扫描电镜观察 借助扫描电镜,观察地表可燃物不同降解阶段的真菌生长情况。随机选取经高活性纤维素酶菌株培养后的可燃物叶片,自然干燥后用解剖刀片取小块,并切开叶片露出纵切面,将其粘在扫描电镜样品盘上。采用离子溅射仪对样品表层进行喷金处理,利用日本电子JSM-7500F扫描电镜对叶片样品进行观察和分析。
1.2.8 数据处理 采用Microsoft Excel 2016和Origin 2018软件对数据进行计算与作图; 利用单因素方差分析Student-Newman-Keuls(SNK)多重比较法分析阔叶、针叶及混交基质经不同菌株处理后综纤维素质量分数以及综纤维素降解率的差异显著性。
2 结果与分析
2.1 纤维素降解菌的分离与筛选
孟加拉红培养基中含有氯霉素,对细菌生长具有抑制作用。根据不同的菌落形态,用孟加拉红培养基分离出约15个菌株。其中,来自云杉人工林4株、水曲柳6株、兴安落叶松2株以及胡桃楸3株,分别记为A1、A2、A3、A4、B1、B2、B3、B4、B5、B6、C1、C2、D1、D2和D3。
15株真菌均在CMC-Na培养基上培养,经染色和脱色后,菌落周围水解圈的大小因菌种而异。8个菌株的水解圈比较明显(图1),分别为A2、A3、A4、B2、B4、B6、D2和D3。表1列出了菌落直径与水解圈直径的测量结果,水解圈直径在5.24~13.43 mm之间。水解圈显示了这些真菌产生的纤维素酶的活性并且表明真菌本身能够降解纤维素。8个菌株的纤维素分解指数在1.89~3.19之间。其中,菌株B2的纤维素分解指数显著高于其他供试菌株(P<0.05),说明菌株B2产酶潜力最大。以上8个分离株用于进一步的筛选。
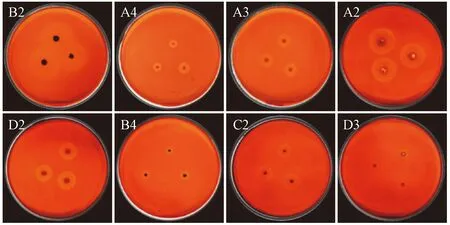
图1 真菌菌落和水解圈在CMC-Na培养基上的生长情况
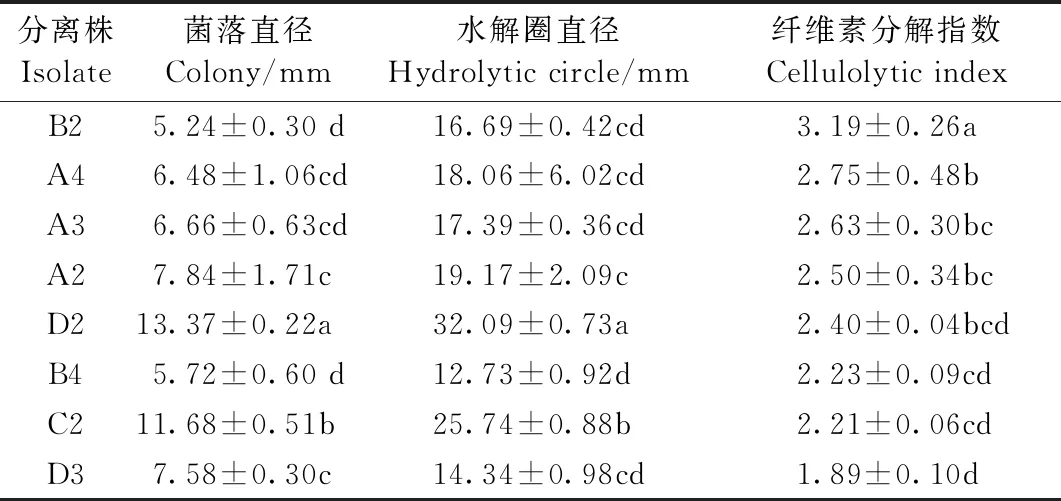
表1 菌落和水解圈直径测量结果①
2.2 纤维素降解菌的鉴定
将8株菌的ITS序列与Genbank中的模式菌株及亲缘关系较近的菌株进行序列比对,用非加权组平均法(UPGMA法)构建系统发育树(图2),结合形态学特征将B2、A4、A3、A2、D2、B4、C2、D3分别鉴定为枝细枝孢、紧密帚枝霉、Pleosporales sp.、肉色隔孢伏革菌、Fungal sp.、臭曲霉、Dothideomycetes sp.和灰黄青霉。
2.3 地表可燃物室内降解
由图3可知,在整个室内降解试验期间,分解基质中综纤维素质量分数随天数增加呈下降趋势。阔叶基质初始综纤维素质量分数为30.4%。降解试验持续20天后,综纤维素质量分数根据菌种的不同下降到28.0%~29.5%,与对照相比下降了0~4.6%,差异不显著(图3)。降解试验持续80天后,综纤维素质量分数下降到18.2~22.4%。经菌种A4、A2、B4、D2、C2与D3菌液处理后的阔叶基质综纤维素质量分数均显著低于对照(P<0.05)。从整体上看,菌株A4降解综纤维素的能力最强(80天后与对照相比下降25.7%),其次是菌株A2(与对照相比下降24.4%),而菌株A3的降解能力最弱(与对照相比仅下降8.6%)。然而,上文提到菌株B2的纤维素分解指数为最高(表1),经SNK检验却与对照无显著差异。这说明纤维素酶活性最强的菌株分解地表可燃物中天然纤维素的能力不一定最强。此外,在降解过程中,综纤维素质量分数出现一定波动,这表明水溶性化合物的分解导致自身浓度降低,使纤维素相对浓度有所增加。
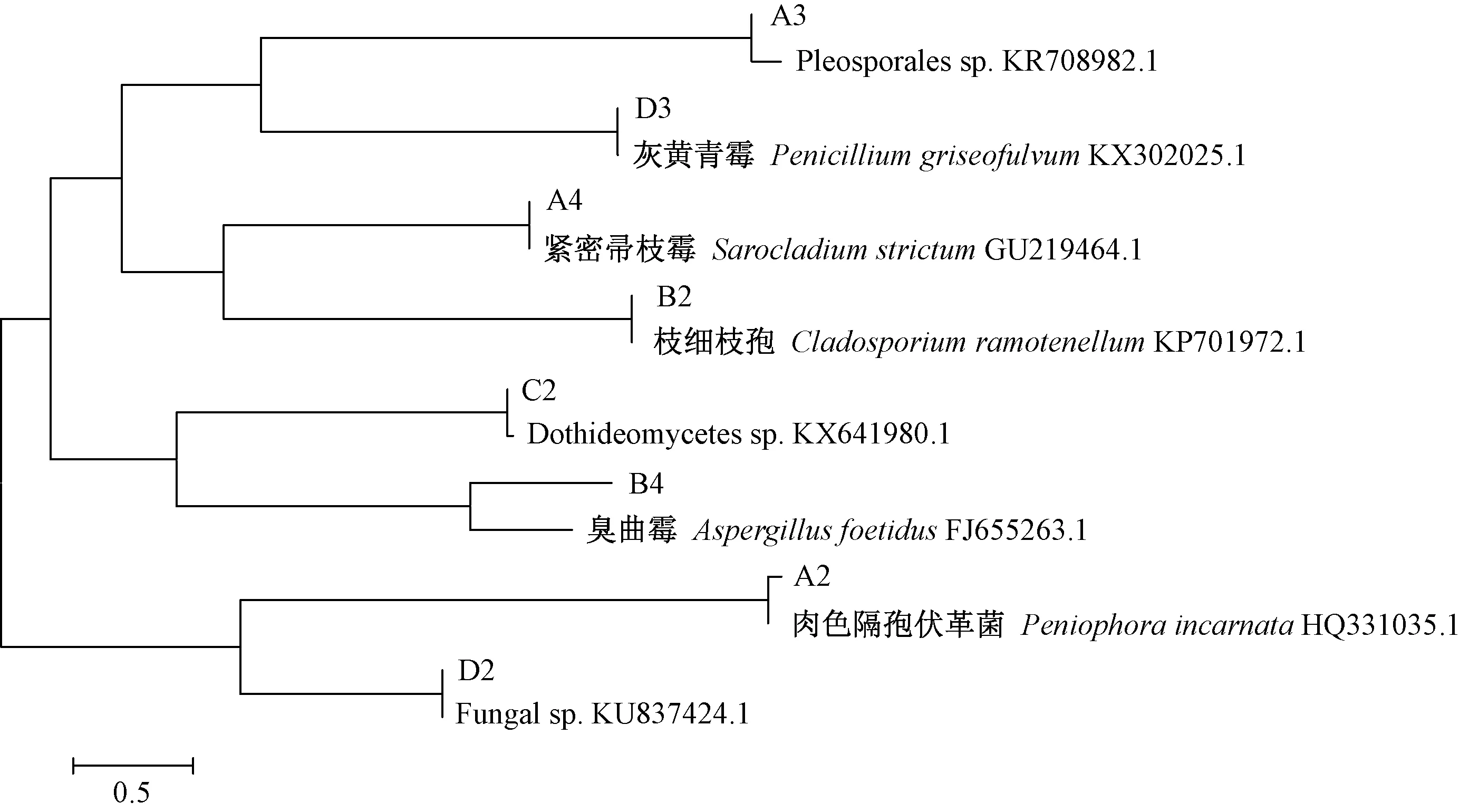
图2 纤维素降解菌的rDNA-ITS序列系统发育树
针叶基质和针阔混交基质的初始综纤维素质量分数分别为37.0%和33.4%。20天后,在8菌株的培养下,2种基质综纤维素质量分数下降到25.9%~29.5%和26.1%~29.0%,与对照相比均无显著差异(图3)。在此期间,菌株A3对针叶可燃物、菌株A2对针阔混交可燃物中综纤维素的分解能力最强,菌株D3和B4最弱。80天后,针叶基质与混交基质综纤维素质量分数分别下降到21.8%~26.3%和19.9%~25.6%。除B2外,经其他菌种处理后的针叶基质综纤维素质量分数均与对照有显著差异(P<0.05)。A4为对2种可燃物综纤维素降解效果最好的菌株(与对照相比分别下降30.3%和27.1%)。这说明在其他菌种对纤维素的降解率增幅减小时,A4的降解能力突显。对于综纤维素的降解,担子菌为最有效的降解者,因为许多担子菌生长在富含纤维素的枯木或落叶上,利用一组通常由内切葡聚糖酶、纤维二糖水解酶和β-葡萄糖苷酶组成的水解酶系降解纤维素(Baldrianetal., 2008)。以上结果表明,从云杉人工林中筛选出的菌株A4对3种基质的降解效果均较好,适于林地可燃物降解。

图3 降解试验不同阶段不同菌株培养后阔叶、针叶及混交基质综纤维素质量分数变化
2.4 超微结构观察
菌株A4与其他菌株相比表现出更强的降解综纤维素的能力。借助扫描电镜观察其菌丝附着在叶片表面并侵入叶片组织的生长情况。降解试验持续20天后,叶片表面菌丝数量较少且形态简单(图4a),可见由气生菌丝产生的瓶梗,叶片表面可见经其释放出的分生孢子(图4d),形似一串串葡萄状; 降解持续80天后,菌丝布满整个叶片,形成稠密的网状(图4b),菌丝侧端有指状分枝沿叶片表面延伸,菌丝体发达,较粗,有大量孢子附着(图4e); 对照组叶片表面无任何菌丝附着(图4c与4f)。
经降解20天后,叶片纵切面未见明显菌丝和孢子(图5a与5d); 降解80天后,在叶片纵切面细胞组织间,有少量菌丝开始侵入及少量孢子附着(图5e),与对照组洁净的叶片纵切面对比鲜明(图5f)。菌株A4是1株高效综纤维素降解菌,具有侵入叶片组织和降解叶片中综纤维素的能力。
2.5 地表可燃物野外降解如图6可知,野外降解持续6个月后,经小剂量A、B和C菌剂处理后的胡桃楸基质综纤维素降解率均高于对照,分别达15.15%、13.96%和17.85%,分别比对照高11.75%、10.56%和14.45%,无显著差异; 经中剂量3种不同处理后,综纤维素降解率分别为19.58%、18.90%和19.97%,比对照高15.05%、14.37%和15.44%,且差异显著(P<0.05); 经大剂量A、B和C菌剂降解6个月后,阔叶基质中综纤维素降解率分别增大到18.91%、19.01%和25.87%,较对照高15.51%、15.61%和22.47%,其中经菌剂C培养后的基质综纤维素降解率达对照组的7.6倍,差异显著(P<0.05)。
至降解试验结束,经小剂量的3种菌剂处理后的落叶松基质综纤维素降解率为12.84%~14.71%,与对照组差值为7.82%~9.69%,降解程度整体小于胡桃楸基质; 中剂量菌剂处理后针叶基质综纤维素降解率为15.78%~18.37%,与对照组差值为10.76%~13.35%; 大剂量菌剂处理后的针叶基质综纤维素降解率为19.14%~21.68%,比对照组高14.12%~16.66%,降解效果较阔叶基质差。
降解试验结束时,混交可燃物基质经小剂量3种菌剂处理后综纤维素降解率从大到小顺序为菌剂C、菌剂B、菌剂A,分别比对照高13.24%、12.37%和11.77%; 混交基质经中剂量A、B、C菌剂降解6个月后,其综纤维素降解率均显著高于对照,分别比对照高15.05%(P<0.05)、14.37%(P<0.05)和15.44%(P<0.05); 经大剂量菌剂处理后,基质综纤维素降解率为菌剂C(22.16%)>菌剂B(20.32%)>菌剂A(19.51%)。

图4 经A4菌液培养后胡桃楸叶片表面菌株生长电镜观察
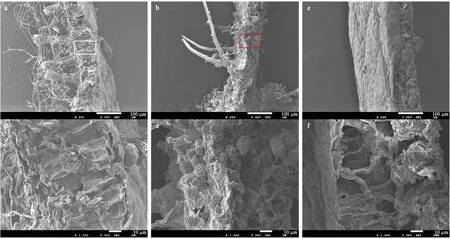
图5 经A4菌液培养后的胡桃楸叶片纵切面菌株生长电镜观察
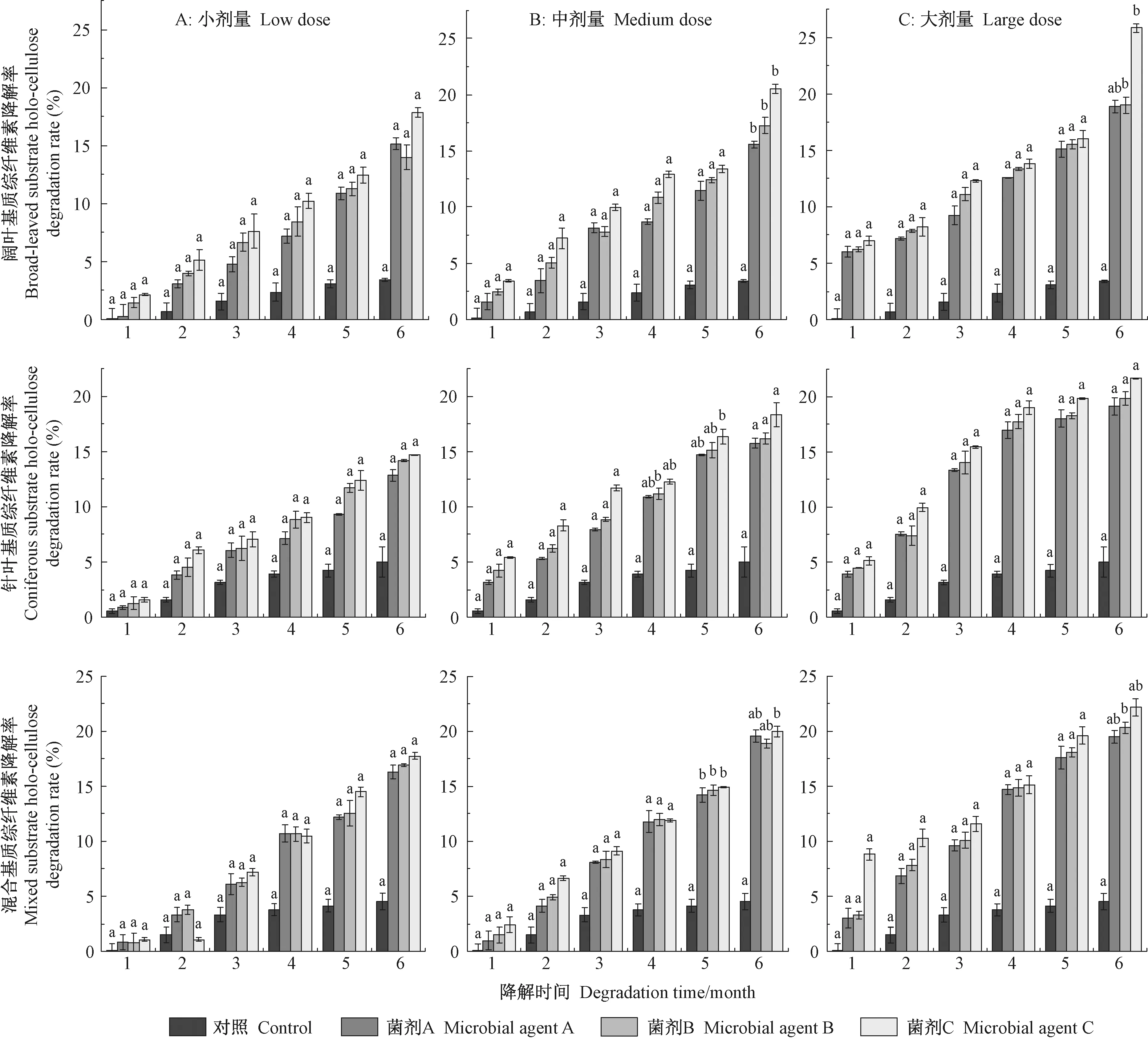
图6 不同菌剂处理后阔叶、针叶及混交基质综纤维素降解率变化
3 讨论
纤维素是森林地表可燃物的主要组分,其降解在森林可燃物分解过程中至关重要。帽儿山地区由于地处中温带,地表可燃物的分解受到很大程度的制约,其堆积造成森林火灾隐患。加快森林地表可燃物的分解是降低森林火险等级的重要途径之一(国家林业局森林防火办公室, 2003)。纤维素降解菌能通过自身酶系统的作用逐步将地表可燃物中复杂的纤维素大分子分解为简单的葡萄糖小分子,从而降解可燃物。本研究筛选出8株高活性纤维素酶菌株,对可燃物基质均发生不同程度的降解,但降解能力强弱与纤维素分解指数大小并不顺序相符,分解指数最大的菌种的降解能力并非最强。推测不同菌株达到最大酶活力所需的时间不同,菌株在CMC-Na培养基上产生的水解圈大小与其产生的纤维素降解酶活力之间的相关性不是很强,说明采用此方法只能为定性判断菌株是否具有降解纤维素的能力提供参考。本研究中,A4为降解地表可燃物中纤维素能力最强的菌株,但是单一菌株无法产生完整的纤维素降解酶系。若提高纤维素降解效果,还需多种酶之间的协同作用。另外,由于室内降解试验条件的可控性强,所得结果有一定局限性,野外环境影响因素较多,由室内试验筛选出的菌株是否在野外仍有较强降解能力,还需进一步验证。因此,本研究在室内试验基础上进行了野外降解试验,选用由室内试验筛选出的高效降解菌制成单一菌剂,同时用2株纤维素降解菌构建成混合菌剂,分别对地表可燃物样品进行喷洒。结果表明,单一菌剂与混合菌剂均对野外地表可燃物有降解效果,且后者降解效果优于前者,充分体现了2株菌在综纤维素降解过程中的协同作用。后续研究可混合培养多个纤维素降解菌株,摸索其最佳产酶条件,构建纤维素降解复合菌系,还可加入对纤维素降解菌不具拮抗作用的木质素降解菌,协同降解森林地表可燃物。
4 结论
本研究共分离出15株真菌并从中筛选出了8株高活性纤维素酶菌株。室内降解试验表明,菌株A4(紧密帚枝霉)为本研究筛选出的纤维素高效降解真菌,菌株A2(肉色隔孢伏革菌)次之。野外降解试验表明,施加菌剂的3种基质综纤维素降解效果均优于对照组,对于施加同种剂型的可燃物,不同剂量使可燃物基质综纤维素降解率排序为大剂量>中剂量>小剂量>对照; 3种可燃物基质综纤维素呈现出相同的降解规律,综纤维素降解率表现为菌剂C(A4+A2) >菌剂B(A4)>菌剂A(A2)>对照,即混合菌剂降解效果优于由菌株A4及A2制得的单一菌剂。综上所述,菌株A4在自然条件下对地表可燃物中综纤维素也表现出较强降解能力,且与其他纤维素降解菌种构建的混合菌剂对可燃物中综纤维素降解效果更佳,可在后续试验中探讨最佳产酶条件,进一步提高复合菌系的降解能力。

