1例引起突发性耳聋的猪链球菌的鉴定及分子流行病学分析*
郑礼杰,李欣霖,张 文,陈建国,谈忠鸣,许金凤
(1.江苏大学附属人民医院,江苏镇江 212002;2.江苏大学医学院,江苏镇江 212013;3.江苏省疾病预防控制中心,江苏南京 210009;4.镇江市疾病预防控制中心,江苏镇江 212000)
猪链球菌是一种兼性厌氧的革兰染色阳性细菌,寄生在猪、牛、驴等哺乳动物、鸟类以及人类中,可导致脑膜炎、败血症、心内膜炎、肺炎、关节炎等疾病,是一种重要的人畜共患病原菌[1-3]。近二十年,由猪链球菌引起的人类感染显著增加,被认为是新出现的动物传染性疾病[4]。2002-2013年全球共有34个国家1 642例猪链球菌病的报道,90.2%发生在亚洲,8.5%发生在欧洲[5],西方国家病例主要与职业接触有关,而相当一部分亚洲病例则与食用生猪制品有关[6]。根据荚膜多糖(CPS)抗原性的不同,猪链球菌被分为35种血清型(1-34型以及1/2型)[5]。目前,对猪致病性较强的常见血清型有1型、2型、1/2型、7型和9型等[7]。根据7个管家基因(aroA、cpn60、dpr、gki、muts、recA、thrA)核苷酸序列的不同,应用多位点序列分型(MLST)技术将猪链球菌分为不同的序列类型(STs)[8],目前已知的STs已有700多种。毒力相关基因纤溶酶释放相关蛋白编码基因(mrp)、溶血素基因(sly)、细胞外蛋白因子编码基因(epf)、荚膜多糖编码基因(cps)等在猪链球菌致病过程中发挥重要作用[9-10]。本研究对分离自江苏大学附属人民医院(后简称“本院”)的1例突发性耳聋患者血液和脑脊液中的猪链球菌进行病原学鉴定和药敏试验,并进行分子流行病学分析,现报道如下。
1 资料与方法
1.1病例介绍 患者,男,59岁,因“突发性耳聋”入院就诊。入院时头部胀痛、头晕、听力下降、言语不清、双下肢乏力,伴有恶心、呕吐。辅助检查:白细胞5.7×109/L,中性粒细胞计数5.3×109/L,中性粒细胞占比93%,血小板20×109/L ;C-反应蛋白116.50 mmol/L。予以阿昔洛韦抗病毒、用泼尼龙琥珀酸钠抑制免疫炎症等治疗。入院第2天,患者出现高热,体温最高39.1 ℃,伴有畏寒、寒战,四肢及腹部紫癜,抽取外周血及脑脊液送微生物室培养,同时抗菌药物改为头孢呋辛钠联合环丙沙星。培养约5 h后,外周血和脑脊液培养瓶先后报阳,涂片提示革兰阳性链球菌,经VITEK-2 Compact微生物系统鉴定为猪链球菌,提示该患者为猪链球菌感染。转感染科治疗,据药敏试验结果调整抗菌药物,予以美罗培南抗感染治疗。患者出现听力障碍,请五官科会诊确定双耳全聋,予以鼓室内注射用泼尼龙琥珀酸钠治疗,效果欠佳。入院第19天,患者体温正常,头痛缓解、乏力减轻,感染治愈,但听力无法恢复。发病第46天,行右侧电子耳蜗植入术,患者恢复出院。
1.2主要仪器与试剂 Bact/ALERT 3D全自动血培养仪(法国生物梅里埃),VITEK-2 Compact全自动微生物鉴定及药敏分析系统(法国生物梅里埃),PCR扩增仪(Eppendorf 公司),电泳仪(Bio-Rad公司),凝胶成像及分析系统(GENE公司)。PCR试剂盒(大连宝生物公司),细菌DNA提取试剂盒(北京卓诚惠生生物科技股份有限公司),猪链球菌核酸检测试剂盒及猪链球菌分型核酸检测试剂盒(江苏硕世生物科技有限公司),16S rRNA基因引物、管家基因引物及毒力基因引物均由上海生物工程有限公司合成。
1.3细菌仪器表型鉴定及药敏试验 采集患者双臂静脉外周血各8~10 mL及脑脊液2 mL分别注入血培养瓶,置Bact/ALERT 3D全自动血培养仪中孵育。培养5 h后,培养瓶陆续报阳,抽取培养瓶内容物,涂片革兰染色,同时接种哥伦比亚血平板和麦康凯平板。根据细菌革兰染色结果选择合适的鉴定和药敏卡,放置VITEK-2 Compact微生物系统进行鉴定和药敏试验。抗菌药物敏感性试验判读按照美国临床和实验室标准化协会(CLSI)2018年版要求进行,质控菌株为无乳链球菌ATCC 13813和金黄色葡萄球菌ATCC 29213。
1.4猪链球菌靶基因检测 细菌DNA提取:按照试剂盒说明书提取目标DNA,置-20 ℃冰箱保存备用。参照文献[11-12]合成下列引物:16S rRNA基因前向引物:CCTACGGGNGGCWGCAG,反向引物:GACTACHVGGGTATCTAATCC,猪链球菌管家基因aroA、cpn60、dpr、gki、mutS、recA、thrA(表1),猪链球菌毒力基因cps、mrp、epf、sly(表2)。16S rRNA反应体系20 μL,包含上下游引物各1 μL、模板1 μL、预混液17 μL,反应条件为94 ℃预变性5 min, 94 ℃变性30 s、48 ℃退火30 s、72 ℃延伸30 s,共30个循环,最后72 ℃延伸7 min。管家基因和毒力基因反应体系各50 μl,包含上下游引物各1 μL、模板1 μL、预混液47 μL,反应条件95 ℃预变性4 min,95 ℃变性30 s、61 ℃退火30 s (毒力基因60 ℃)、72 ℃延伸60 s,共35个循环,最后72 ℃延伸5 min。PCR产物送上海生物工程有限公司测序。

表1 猪链球菌MLST分型引物列表
1.5MLST数据库比对 将扩增产物测序后得到的序列与MLST数据库中的序列进行比对分析,得到各管家基因的等位基因数。将得到的7个等位基因数上传至数据库查询具体的ST型别,并将ST型别结果上传至数据库。
1.6猪链球菌核酸和猪链球菌分型核酸检测 按照试剂盒说明书操作,进行实时荧光定量PCR。

表2 毒力基因特异引物PCR引物序列及退火温度
2 结 果
2.1细菌分离培养和染色镜检 报阳血标本接种后,经培养箱35 ℃孵育24 h,哥伦比亚血平板上长出灰白透明色,针尖样露珠大小,光滑湿润,边缘整齐有α溶血环的菌落(图1)。经革兰染色,镜下观察为成双排列或短链状的革兰阳性球菌,呈散在、成对或短链状分布(图2)。

图1 菌落生长形态

图2 菌株革兰染色镜检
2.2鉴定和药敏试验结果 VITEK-2 Compact系统鉴定为猪链球菌,鉴定率仅为50%。药敏试验结果:氨苄西林、环丙沙星、利奈唑胺、青霉素、万古霉素、美罗培南均敏感。
2.3猪链球菌16S rRNA基因检测结果 16S rRNA基因检测得到一条约450 bp的条带(图3),测序后得到的序列同美国国立生物技术信息中心(NCBI)数据进行比对,显示与猪链球菌(登录号:MH699317.1)的同源性为98.35%。
2.4猪链球菌MLST分型结果 7个管家基因电泳均得到清晰条带(图4),约500 bp,与目标条带一致。aroA、cpn60、dpr、gki、muts、recA、thrA等位基因数量分别为1、1、1、1、1、1、3,与MLST数据库中的序列进行比对分析,发现此次分离到的菌株为ST7型。
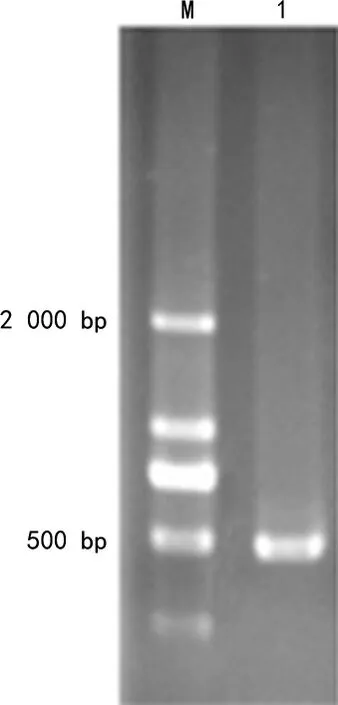
注:M为DNA Marker;1为16S rRNA。

注:M为DNA Marker;1为dpr;2为thrA;3为cpn60;4为recA;5为gki;6为aroA;7为mutS。
2.5猪链球菌核酸和分型核酸检测 实时荧光定量PCR鉴定此菌株为猪链球菌血清型2型(图5、图6)。
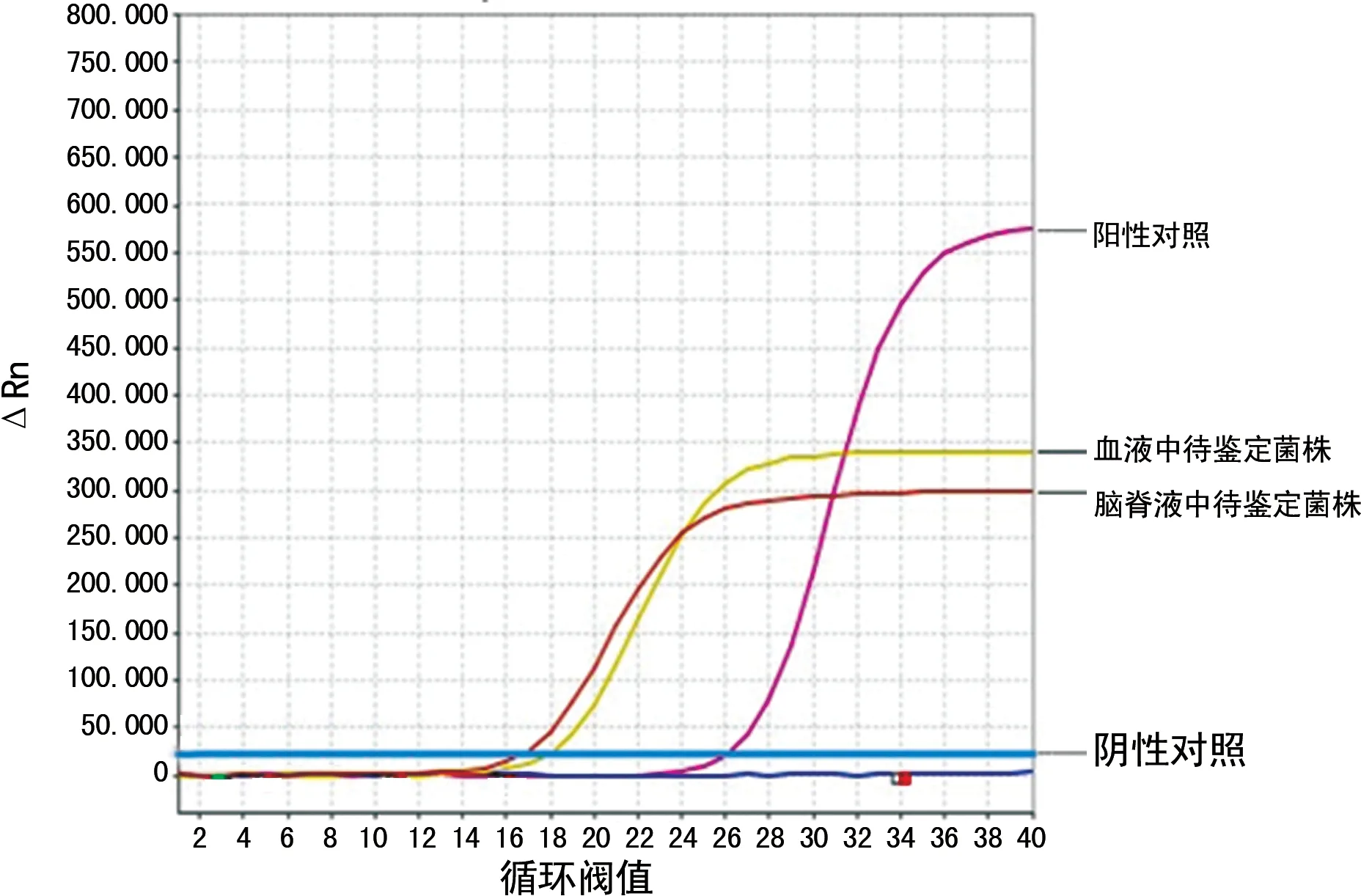
图5 实时荧光定量PCR结果为猪链球菌
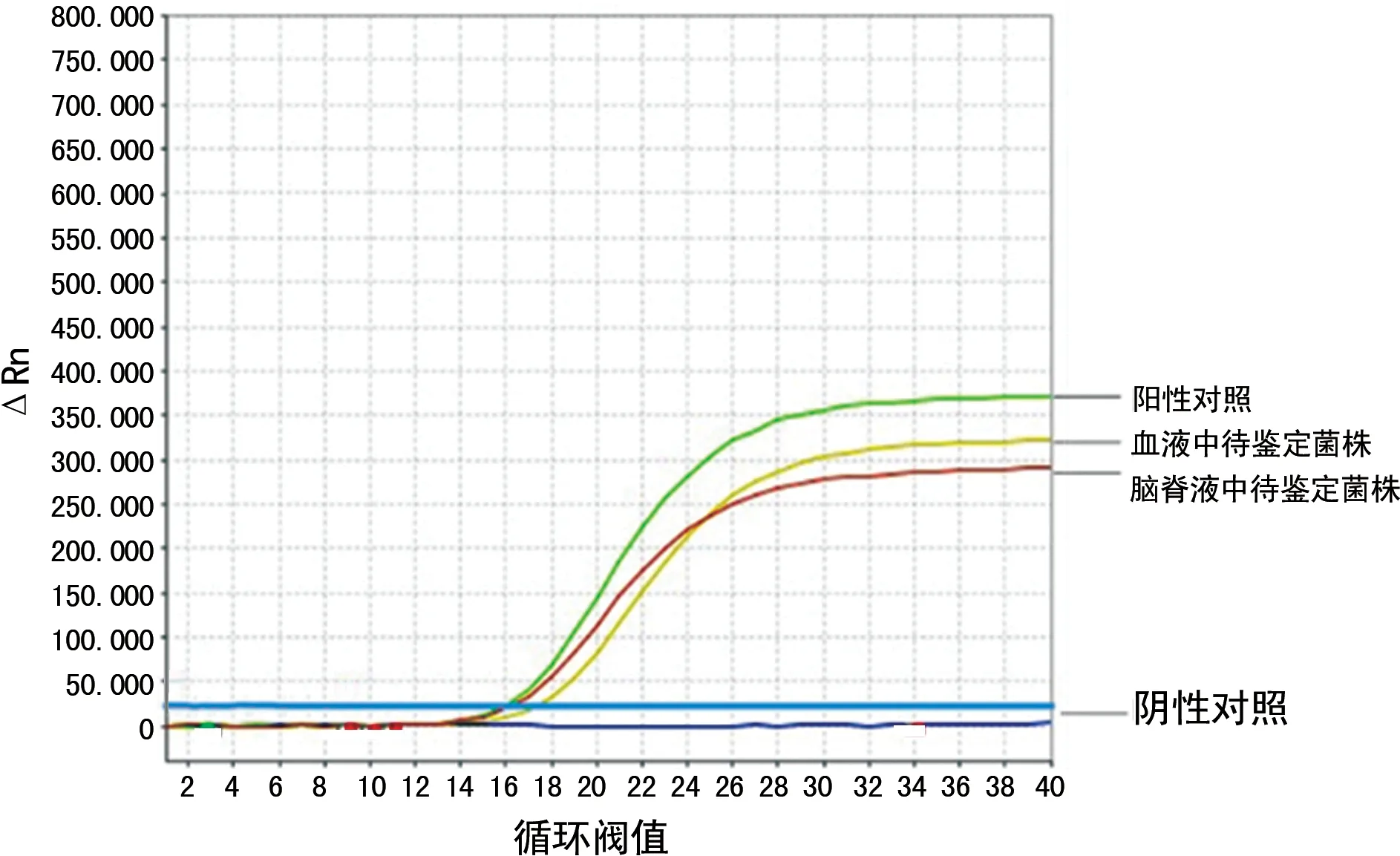
图6 实时荧光定量PCR结果为猪链球菌2型
2.6毒力基因检测结果 琼脂糖凝胶电泳结果显示,本菌株表现为sly+/cps+/epf+(图7)。

注:M为DNA Marker;1为mrp;2为sly;3为cps;4为epf;5为阴性对照。
3 讨 论
大多数猪链球菌在羊或牛血琼脂平板上呈α溶血,在马血平板上呈β溶血[6],镜下呈卵圆形或球形,大小1.0~1.5 μm,单个、成对或链状出现。临床可以通过细菌学、免疫学或者分子生物学的方法对猪链球菌进行鉴定,并需注意与肺炎链球菌、草绿色链球菌、D群链球菌、肠球菌等鉴别。本研究中,菌落形态和镜下特征与猪链球菌相符,但机器鉴定率仅为50%,这或许与细菌生化反应不充分或猪链球菌培养条件有关,后续16S rRNA结果与猪链球菌同源性为98.35%,确定该病原菌为猪链球菌。与VITEK-2 Compact的传统细菌鉴定方法相比,16S rRNA基因序列分析方法具有鉴定准确率高、灵敏度高的优点[13],适用于临床重要且难以鉴定的菌株。
猪链球菌在猪中有较高的流行性,在人类不常见,但一旦感染病情往往很严重。人群普遍易感,主要通过开放性伤口传播,如人皮肤或黏膜的创口接触病死猪的血液和(或)体液、加工处理病猪肉引起发病,或因吃了未煮熟的病猪肉或内脏而感染。人感染猪链球菌后主要的临床综合征为脑膜炎[5],其次是败血症、关节炎、心内膜炎和眼内炎[14-15],严重病例发展为不可逆的中毒性休克,病死率可达62.7%[6]。脑膜炎最常见的后遗症是听力丧失和(或)前庭功能障碍,报道的耳聋发生率在欧洲和亚洲分别为50%和73%[16]。本病例患者以“突发性耳聋”入院,入院第2天出现高热、头痛头晕、恶心呕吐并伴有肢体乏力,四肢及腹部紫癜,血液和脑脊液中分离出猪链球菌,符合脑膜炎合并败血症的临床表现[6],按照药敏试验结果,患者经积极治疗,病情好转,但仍致不可逆的双耳全聋,不得不行电子耳蜗植入。该患者虽然没有直接接触病死猪,但在发病前3 d从农贸市场购得猪肺在家自行加工煮食,入院检查时发现患者手指指甲处有“倒刺”,推测猪链球菌从此伤口进入人体并大量繁殖引起血源性感染和脑膜炎。
据统计,2002-2013年全球报道的1 642例人感染猪链球菌的病例中,最常见的血清型为2型,占74.7%,其次为14型;猪链球菌分型导致的中毒性休克称为链球菌中毒性休克样综合征[5]。基础研究也证实,猪链球菌2型可通过中性粒细胞逃避自然免疫监视和消灭[17]。近年来我国报道的临床病例也以猪链球菌2型和9型为主[18],特别是江淮地区优势血清型为2型[19]。在猪链球菌的分型中,实时荧光定量PCR在敏感性、特异性和重复性方面具有显著的优势[20],本研究采用实时荧光定量PCR分别进行猪链球菌核酸、猪链球菌2型核酸检测,确定为血清型2型,符合我国流行情况。
迄今为止,世界范围内报道的STs已经有700多种。在欧洲,人和猪的感染病例中最常见的ST型为ST1,而亚洲和阿根廷主要为ST7[5]。2002-2013年,中国大陆猪感染病例中最常见的是猪链球菌2型ST7型[5]。2006-2016年,中国大陆地区散发的76例临床病例分离出的猪链球菌中,主要流行的是ST1型和ST7型[21]。将本菌株管家基因信息上传至MLST数据库进行比对,结果为ST7型。可见MLST技术的发展和普及使得不同STs的全球分布数据可以共享和比较,对本地区细菌流行病学也有更好的认识和促进作用。
猪链球菌的一种胆固醇依赖性细胞溶血素,被认为是一种重要的毒力因子,具有细胞毒性、黏附、侵袭、胞内存活等作用,在感染和宿主免疫应答中发挥重要作用[8]。cps可编码荚膜多糖,在细菌侵袭、抵抗吞噬作用、脑膜炎的形成中发挥重要作用[10]。 随着研究进展,不同的荚膜多糖合成基因位点陆续被确认[22]。sly、epf、mrp是目前常用的与STs相关的毒力标记,主要跟猪链球菌2型菌株相关[5]。因此,本研究选取cps-2、sly、epf、mrp进行毒力基因检测,结果除mrp外均为阳性,表明此分离株为sly+/cps+/epf+强毒株。

