黄花蒿新品种“研青一号”研究△
丁丹丹,马婷玉,陈士林,冷梁,黄盛群,谢刚,向丽*
1.中国中医科学院 中药研究所/北京市中药鉴定与安全性检测评估重点实验室,北京 100700;2.广西仙草堂制药有限责任公司,广西 柳州 545400
青蒿素是治疗间日疟、恶性疟和抗氯喹疟疾的首选药物[1],近几年全球青蒿素年用量在180 t左右[2],虽然早有研究可通过人工合成的方法合成青蒿素[3-4],但由于成本和效率等问题难以大规模生产[5],目前主要依靠从黄花蒿植物中提取的方法。除了我国少部分地区外,全球大部分区域的黄花蒿中青蒿素含量都在0.2%以下,不具有提取价值[6-7]。相关研究[8-10]发现,黄花蒿在我国海南、湖南、广西等地适宜生长;重庆、四川等地和低海拔地区黄花蒿抗疟效果较好;海南省降水充沛、光热量足,与黄花蒿高温喜湿的生物学特性一致[8],野生资源青蒿素含量较高。目前,黄花蒿主要依靠人工栽培,但是不同产地、不同品种黄花蒿中青蒿素含量存在显著差异,生产栽培技术不够规范导致栽培的黄花蒿质量良莠不齐。青蒿酸、双氢青蒿酸、青蒿乙素均是青蒿素生物合成的前体物质[11-12]。课题组经过多年混合选育,获得青蒿素含量高达2.11%的新品种“研青一号”(YQ1),并对青蒿素及其前体物质进行了含量测定,基于重测序筛选其Indel分子标记,采用药用植物全球产地生态适宜性信息系统(GMPGIS)预测了其适宜种植范围,并总结了规范化栽培技术体系,为降低原料成本、获得高品质青蒿素原料提供保障。
1 材料与方法
1.1 “研青一号”植株形态特征
试验材料包括YQ1以及来自海南栽培种(HQ1)、湖南的栽培种(HUN)以及海南的2个野生种(HN1、HN3)。在采收期(8月中上旬)测量其株高、冠幅、地上茎粗、分枝数、分枝角度、叶片面积及单株干叶质量。叶片面积使用Image J软件对黄花蒿植株一级分枝上叶片进行面积计算,每个品种测量30株。
在种子成熟期,对每个品种随机抽取30粒用于形态观察。首先将种子置于平底玻璃片(5 cm×10 cm)上,在TOUPCAM显微镜4倍视野下观察,使用Toup View软件量取30粒种子的最长、最宽数据并记录;选用体式显微镜拍照观察并描述其形态与差异,见图1。选择百粒法测定黄花蒿种子千粒质量。每个批次随机抽测100粒种子,使用十万分之一天平称定质量,进行6个重复。按公式(1)(2)对不同品种黄花蒿种子的发芽率、发芽势进行测定,将100粒黄花蒿种子均匀洒在实验滤纸上,使之保持湿润,每批样品3次重复。发芽条件:温度20 ℃,相对湿度40%,20%光照8 h。胚根与种子等长或稍长,2片子叶展开者视为正常发芽并统计。连续3 d不发芽视为发芽结束。
发芽率=发芽种子总数/供试种子总数×100%
(1)
发芽势=前5 d发芽种子总数/供试种子总数×100%
(2)
1.2 青蒿素类化合物含量测定
在黄花蒿采收期,对5个品种进行青蒿素、青蒿乙素、青蒿酸和双氢青蒿酸含量测定,每个品种测定30个单株。
采用超高效液相色谱-串联质谱检测法(UPLC-QQQ-MS)进行青蒿素类化合物含量测定。青蒿素(批号:CFS201801,纯度≥99%)、双氢青蒿酸(批号CFS201801,纯度≥98%)、青蒿酸(批号:CFS201702,纯度≥99%)、青蒿乙素(批号:CFN98807,纯度≥98.0%)均购于武汉天植生物技术有限公司;甲醇、乙腈为色谱纯 (美国Fisher公司);乙酸(分析纯,北京化工厂);甲酸、甲酸铵(色谱纯,上海阿拉丁生化科技股份有限公司);娃哈哈纯净水(杭州娃哈哈集团有限公司)。Eclipse Plus C18(2.1 mm×50 mm,1.8 μm)色谱柱,美国Agilent UPLC-MS系统[1290系列超高效液相色谱仪、6470 型三重四极杆质谱仪(安捷伦科技有限公司)];XS105型十万分之一电子分析天平(METTLER TOLEDO公司);舒美KQ-500DE型数控超声波清洗器(功率100 W,昆山市超声仪器有限公司);BS210S型万分之一电子分析天平(德国赛多利斯公司)。
取青蒿素、青蒿乙素、双氢青蒿酸、青蒿酸对照品适量,分别精密称定,加甲醇制成对照品溶液。取植物样品适量,粉碎,精密称取0.1 g,置于50 mL离心管中,加入甲醇10 mL。超声提取30 min,放冷后吸取适量溶液稀释1000倍,滤过,即得样品溶液。

注:A.HUN;B.HN1;C.HQ1;D.HN3;E.YQ1。图1 不同来源黄花蒿种子于体视显微镜下的形态
青蒿素、青蒿乙素流动相:0.1%甲酸10 mmol·L-1-甲酸铵水溶液(A)-乙腈(B);梯度洗脱(0~5 min,5%~100%B;5~7 min,100%B),后运行2 min。柱温:30 ℃,进样量:1 μL,流速:0.3 mL·min-1。离子源:电喷雾离子源(ESI),扫描方式:正离子模式,MRM模式进行检测。外标法计算浓度。青蒿素母离子:283.2,子离子:265.1、247.1,电压:135 V,能量:5;青蒿乙素母离子:249.1,子离子:189.1,能量:9,子离子:143.1,能量:24,电压:130 V。
青蒿酸、双氢青蒿酸流动相:0.05%乙酸水溶液(A)-甲醇(B);等度洗脱(0~3 min,85%B),后运行2 min。柱温:30 ℃,进样量:1 μL,流速:0.3 ml·min-1。离子源:电喷雾离子源(ESI),扫描方式:负离子模式,SIM模式进行检测。青蒿酸母离子:233.2,电压:140 V;双氢青蒿酸母离子:235.2,电压:140 V。
以峰面积积分值为纵坐标(Y),对照品进样浓度(ng·mL-1)为横坐标(X),绘制标准曲线,青蒿素:Y=729.95X+10 575,r=0.999 9;青蒿乙素:Y=2 327.8X+421.24,r=1;青蒿酸:Y=16 362X+23.033,r=0.999 6;双氢青蒿酸:Y=4 907.8X-7 124.6,r=0.999 8。线性关系良好,精密度、重复性、稳定性试验合格。
1.3 基于重测序的InDel分子标记筛选
1.3.1InDel标记的鉴定及引物设计 使用Burrows-Wheeler Alignmet(BWA)将15个品系比对到基因组上(每个品系2~3个重复,共34个重测序样本),然后使用GATK流程在比对后的重测序样本中注释出每个品系特异的缺失突变(InDel)。选择YQ1品系的3个重复样本RS4、RS17以及RS30的特异缺失突变,取InDel 位点两翼各500 bp碱基长度,共1000 bp片段长度使用Primer 5.0进行引物设计。上游设计在1~500 bp,下游设计在500~1000 bp,筛选YQ1特征性的缺失突变位点。
1.3.2PCR扩增和电泳 材料来自于7份常规栽培及野生黄花蒿种质资源,包括YQ1、HQ1、HN1、HN3、HUN、GZ(贵州)、XZ(西藏林芝米林县),2018年种植于北京怀柔实验基地。采取幼苗期叶片,采用基因组DNA提取试剂盒(TIANGEN Hi-DNAsecure Plant Kit DP350)。PCR 反应体系为25 μL,其中DNA 模板(15 ng·μL-1) 2 μL,2×TaqMix酶(2.5 U·μL-1) 8.5 μL,上游引物(10 μmol·L-1) 1·μL,下游引物(10 μmol·L-1) 1 μL,ddH2O 12.5 μL。PCR 反应程序:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min;4 ℃保存。6%聚丙烯酰胺凝胶电泳,电压120 V,电泳时间20 min。显色后照相保存。
1.4 “研青一号”全球产地适宜性分析
运用GMPGIS系统对“研青一号”全球适宜生产区域进行预测。根据“研青一号”多点多年试验结果,将海南省、重庆市、四川省、广西省、湖南省等132个试验点经纬度导入GMPGIS系统,生成shape文件,在基础地理信息数据库、气候因子数据库等相关数据库的支持下,进行“研青一号”的生态因子值分析及全球产地适宜性分析。
2 结果与分析
2.1 选育过程
2013年通过收集比较全国黄花蒿野生及栽培种质资源523份,发现来自广西融安县的1份种质资源青蒿素含量较高,>2.0%,同时采用高光照射和组织培养方法,对该品系的植株紧凑、矮化的株系进行保留、扩繁并单独留种。经过3年多技术混合选育,获得平均青蒿素含量达2.11%的新品种“研青一号”,并于2017、2018年在四川省宜宾市、重庆市酉阳县、海南省海口市、广西省融安县、湖南省祁阳县、北京市怀柔县、江苏省无锡市进行了多点试验。
2.2 植株形态特征
“研青一号”植株整体表型较为一致,主要呈圆塔形生长,平均株高为(124.0±25.5) cm,较其他种质资源黄花蒿矮,生育期240~250 d;其株型紧凑,平均冠幅为(93.4±14.0) cm。叶色正绿色,叶片普遍稍大,平均叶片面积为(11.2±3.2) cm2。植株腺毛密度高,气味浓郁,平均单株叶片干质量为(211.9±48.1) g。种子表面圆润,有浅棕色沟纹,基部渐尖,长宽比为2.0±0.1,千粒质量(35.0±1.7) mg。“研青一号”在第3和第4天开始发芽,主要集中于第4天至第6天,第7天和第8天后发芽率开始降低,发芽率为(79.0±10.5)%。因此,“研青一号”植株呈圆塔型,矮小、紧凑、叶片较大,生育期长,能与其他品种进行明显区分(见表1)。
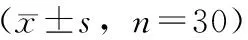
表1 “研青一号”植性状特征及青蒿素含量
2.3 青蒿素类化合物含量测定
由图2可知,与4个对照比较,YQ1青蒿素含量最高,平均为(2.11±0.38)%,最高达2.70%;同时双氢青蒿酸含量也最高,平均为(0.33±0.07)%,最高达0.53%;青蒿乙素和青蒿酸含量却是5个品种中最低的。对照品种内4种化合物含量变化趋势基本一致,青蒿素和双氢青蒿酸含量较高,青蒿酸和青蒿乙素含量较低,青蒿素含量比重最大。HN1青蒿乙素和青蒿酸含量最高,分别为(0.06±0.03)%和(0.02±0.01)%,最高为0.06%。
注:A.青蒿素;B.青蒿乙素;C.双氢青蒿酸;D.青蒿酸。图2 不同黄花蒿中青蒿素、青蒿乙素、青蒿酸、双氢青蒿酸含量测定结果
将植株性状与青蒿素类化合物含量进行相关性分析,青蒿素含量与双氢青蒿酸含量正相关,r=0.625 7。青蒿酸和青蒿乙素含量显著正相关,r=0.834 8。青蒿素、双氢青蒿酸含量与植株的叶面积呈正相关,与株高、冠幅、地上茎粗、分枝数、分枝角度负相关,但相关系数并不显著。植株主要性状与叶片产量相关性分析结果表明,植株产量与株高、冠幅、地上茎粗、分枝数、分枝角度、叶片数皆呈正相关,其中冠幅与产量的相关性最高,r=0.613 5。结合青蒿素含量及植株产量分析,人工培育新品种时可选择植株紧凑,冠幅适中,二级分支数多,叶面积较大的株系。
2.4 特异性、一致性、稳定性分析
特异性:“研青一号”与4个栽培和野生优良品系比较,特异性明显,植株呈圆塔型,植株紧凑、矮小,一级分支和二级分支夹角小,生育期长;青蒿素和双氢青蒿酸含量最高,平均值分别为(2.11±0.38)%和(0.33±0.07)%。
一致性:对“研青一号”主要性状指标变异系数进行分析,其植株形态、叶色、花色、种子颜色全部一致,株高、冠幅、叶面积、一级分支角度、二级分支角度、种子长宽比、种子千粒质量、青蒿素含量、双氢青蒿酸含量等指标的变异系数都符合一致性要求。
稳定性:“研青一号”于2017、2018年在四川省宜宾市、重庆市酉阳县、海南省海口市、广西省融安县、湖南省祁阳县、北京市怀柔县、江苏省无锡市进行了多点试验。除北京市怀柔县基地的样品青蒿素含量有降低外,其余基地植株性状表现较稳定,青蒿素含量均在2.0%以上,稳定性较好。
2.5 基于基因组重测序的 Indel分子标记筛选
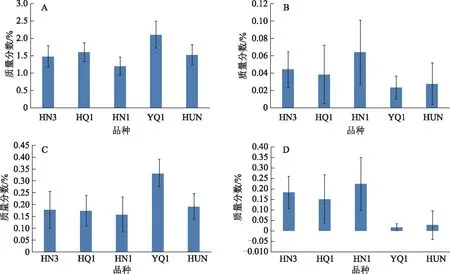
重测序及序列比对结果表明,黄花蒿每个品系的缺失突变数量为 76 971~114 174个。“研青一号”3个重复样品RS4、RS17以及RS30的特异缺失突变分别为91 288、96 812、99 827个。随机筛选出InDel标记45条,其中有16条序列的Indel片段>590 bp,对这16条序列进行引物设计,共设计引物32对。以7份黄花蒿材料基因组DNA为模板,用PCR方法检测32对引物有效性。其中AaIn101(AaIn101F:GACTATGTTTAGCGCGGAGC,AaIn101R:TGGCACTACTTTATCATATCAAATC)和AaIn110(AaIn110F1:GTTCTAGACTCGGGCCTTAGC,AaIn110R1:CTGGC-TGTGCCATGTTTCTG)可以在“研青一号”中出现特异条带,而在其他6份材料中无条带(见图3),可作为“研青一号”的特异分子标记,用于区分“研青一号”和其他产地黄花蒿种质。
注:A.AaIn110;B.AaIn101;1.YQ1;2.GZ;3.XZ;4.HUN;5.HQ1;6.HN1;7.HN3。图3 引物 AaIn101 和AaIn110对7份黄花蒿种质资源的扩增结果
2.6 “研青一号”全球产地适宜性分析
通过对“研青一号”基点的GMPGIS分析,得出“研青一号”主要分布区域的生态因子值范围:最冷季均温4.5~18.9 ℃,最热季均温24.4~28.6 ℃,年均温14.9~24.3 ℃,年均相对湿度68.61%~77.35%,年均降水量987~1688 mm,年均日照124.96~145.47 W·m-2,土壤类型以强淋溶土、高活性强酸土、暗色土、人为土、黑钙土、铁铝土等为最多。
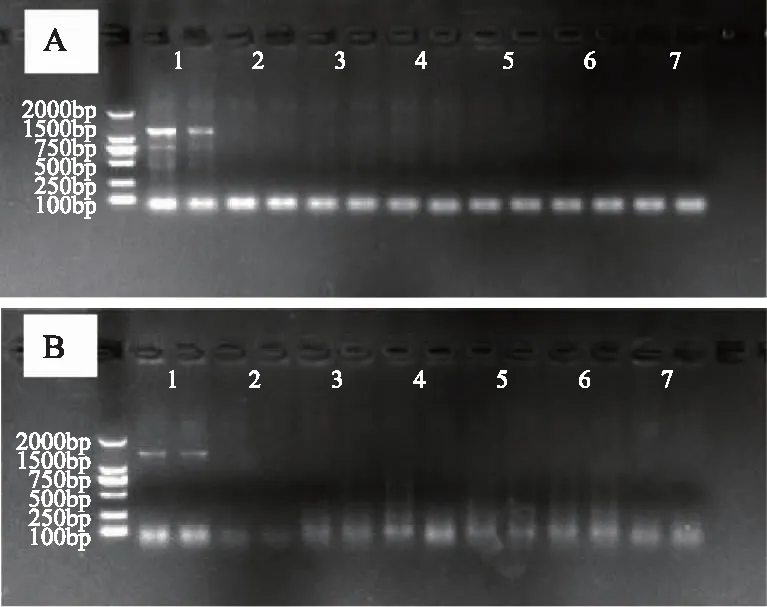
根据以上分析所得到的生态因子值范围,利用加权欧式距离法计算得到“研青一号”的最大生态相似度区域(指相似度99.9%~100%的区域分布图,见图4)。“研青一号”在亚洲的适宜生长区域面积分布较大,多处于亚热带季风和季风性湿润气候。其中,中国适宜性分布区域面积最大,达1 020 446.59 km2、越南占38 609.57 km2、巴西占8 006.91 km2、日本占3 247.25 km2.。
“研青一号”在中国的最大生态相似度区域,主要分布在我国东南部,具体包括广西壮族自治区、湖南、江西、广东、湖北、浙江、福建、四川、贵州、重庆、海南等。其中面积最大的为广西壮族自治区,适宜性分布区域面积达211 656.27 km2。根据GMPGIS分析结果可得,在我国东南部地区较适宜“研青一号”生长。
注:审图号为GS(2020)2680号。图4 “研青一号” 99.9%~100%最大生态相似度区域分布
3 “研青一号”无公害规范化栽培技术
3.1 种子繁殖
3.1.1选地与整地 “研青一号”生活能力较强,喜温,根据多点试验及GMPGIS分析结果,选择我国东南部海拔在800 m以下林缘、荒地,气候潮湿向阳,排水良好,疏松肥沃的沙壤土,未连作地块来进行种植较好。
播种前,对苗床进行精细耕作,使土地平整,土壤疏松,然后浇水使土壤润透,制作宽1.2 m、高20 cm的垄面,排水沟宽30 cm。
3.1.2播种时间 海南最佳育苗时间为11—12月;其余地区在1—2月播种较好。
3.1.3播种方法 播种前将种子与沙土拌匀,每1 g种子用4000~5000 g干细泥沙,然后均匀洒向床面,播种完成后,在苗床表面加播一层薄薄的草木灰,以遮住种子为度,再在苗床上覆盖一层地膜,以保持温度,便于种子萌发。每1 g种子可播15 m2,可种2664~3996 m2。
3.1.4苗床管理 播种7 d后,要勤时揭膜,观察苗床情况,通过揭膜通风和及时洒水使之保持合适的温湿度。种苗长到5 cm左右时可将地膜去掉,从苗床两端先撤,通过炼苗提高种苗的生长适应能力。
炼苗期间视情况而定,可用1.5 L水配50 g尿素加150 g复合肥配成的尿素水或者经30%稀释的农家肥催苗,施水肥后需用清水补淋1次,苗高10~15 cm主茎变硬时即可进行大田移栽。
3.2 移栽定植
3.2.1移栽时间 3—4月。
3.2.2选地整地 选择气候温暖向阳,排水良好,疏松肥沃的沙壤土地,土地翻耕后,起厢宽1.2 m,起垄宽0.6 m、高0.3 m,沟宽0.4~0.5 m。坡地耕后可直接种植,但注意不能种在起沟起槽的凹地处。每株移栽前在距根部4.5~6 cm间施100 g有机肥和30~40粒复合肥(硫酸钾型15+15+15)混合作底肥。
3.2.3拔苗移栽 当苗长到10~15 cm时,选择在晴天下午或阴天按1 m×0.9 m间距移栽。若苗床干结,用清水淋湿后再拔苗,当天种完。种植深度3~5 cm,种植后及时浇透定根水,保证成活率。
3.3 田间管理
种苗存活后,可在40、70 d左右生长期中进行第2次、第3次施加专用复合肥,每666 m2施加2 kg,沿植株冠幅边缘垂直线挖穴、放肥、盖土3~4 cm,避免肥料挥发流失及烧苗。移栽后及时检查种苗的存活情况并补苗,移栽初期及时清理杂草,后期由于植株生长旺盛,可不用考虑除草问题。“研青一号”在排水不良的潮湿地带生长较差,干旱时期要及时浇水,雨季则注意清沟、防渍排涝。
3.4 病虫害防治
“研青一号”病虫害并不严重,但在栽培过程中,由于连作[13]、气候变化、通风差[14-15]等原因可能会出现部分病虫害,主要病虫害为茎腐病、白粉病、黄萎病、蚜虫、小地老虎等。
3.4.1病害防治 茎腐病在高温多雨时节较易发生,根皮部及茎内木质部发黑、脱落,在发病初期可以喷淋1%硫酸亚铁溶液、70%甲基托布津500倍液,隔7~10 d喷1次防治,防治2~3次。
白粉病主要发病期在6—7月,白粉遍布全株,由老叶向新叶发展,可用可湿性粉锈灵兑水500~800倍进行喷雾防治。
黄萎病主要发病期在6—7月雨后高温天气时,染病植株从下部一些叶片开始黄化,逐渐向上扩展,最终导致整个植株黄萎病死。发病初期施用50%多菌灵可湿性粉剂450倍液,隔7~10 d喷1次防治,防治2~3次。
3.4.2虫害防治 蚜虫常大量附着在嫩叶、茎尖部位,可用20%速灭丁或蚜虱净等喷雾防治;小地老虎会将苗床内或刚移栽至大田的幼苗近地面茎部咬断,造成整株病死,每666 m2可用90%敌百虫30倍水溶液150 mL拌5 kg菜叶、鲜草制成毒草进行诱杀。
3.5 采收与储藏
“研青一号”大量采收时,选择晴天早上将全株从基部割倒,在晒场或屋檐下晾晒或阴干,待叶变为褐色且质地呈焦脆状时,可用棒敲或老式打谷机将叶子打下来,挑去小枝梗和杂质,打包装袋,于避光通风处保存。
4 讨论与展望
青蒿素作为抗疟一线药物,属于我国战略资源[16]。“研青一号”经长期选育,在栽培过程中表型渐为稳定,株型紧凑,青蒿素含量平均值较高。采用分子标记可以快速辅助药用植物品种选育[17-19]。参考黄花蒿全基因组信息[20],基于34份重测序分析,筛选获得2对特异性 InDel引物,可区分 “研青一号”与其他产地的黄花蒿种质资源。由于黄花蒿为异花授粉植物,且野外存在大量黄花蒿资源,因此在栽培过程中容易发生退化,虽然现在黄花蒿品种青蒿素含量已经较前期(0.8%)提高了2~3倍,但后期需要进行持续优化,保持品种的稳定性和优良性,并通过规范化种植,保持我国在青蒿素原料方面的优势地位。

