白榆组培快繁体系的建立
张瑞姿
(山西省林木育种研究中心,山西 太原 030031)
白榆(UImuspumilaL.)为榆科榆属落叶乔木,是我国北方主要的园林乡土观赏树种之一。具有生长快,对烟尘、二氧化碳等有毒气体抗性强,抗干旱、耐高温、耐瘠薄、耐严寒、抗盐碱等特点,是城市绿化、水土保持和盐碱地造林等的主要树种之一。白榆无性繁殖主要靠嫁接和扦插,嫁接繁殖速度慢,扦插只能用当年生嫩枝扦插,生根率不高。近年来,笔者以提高诱导率为目标,多次对白榆进行组培研究,旨在为白榆工厂化育苗提供理论依据。
1 材料与方法
1.1 试验材料
试验所用外植体采自山西省林木育种研究中心阳曲基地。在无病虫害、健壮的速生白榆母株上,选取芽点饱满、均匀的半木质化枝条作为外植体,迅速带回组培实验室。
1.2 试验方法
1.2.1 外植体消毒
将采回的外植体枝条,剪去叶片和叶柄,在流水下冲洗30 min,并用软毛刷轻洗表面,注意勿碰伤腋芽。将清洗后的枝条切成0.5 cm~1.0 cm的茎段,移至超净工作台上,用0.1%的HgCI2浸泡,设4 min,7 min和10 min 3个处理.之后倒掉溶液再用75%酒精消毒,设30 s,60 s 2个处理,期间不停摇晃。然后用无菌水冲洗5 次~7次,吸去表面水分,放置超净台内备用。以上过程设6组,每组100个茎段,接种到EM基本培养基中。每瓶接种1个外植体,比较不同消毒时间的灭菌效果。1周后观察记录,统计污染率和成活率。
1.2.2 启动培养
将消毒后的无菌茎段接种到启动培养基中。以EM为基本培养基,分别加入0.1 mg/L,0.2 mg/L,0.5 mg/L,1.0 mg/L 6-BA,以上各组均添加30 g/L蔗糖和7 g/L琼脂,pH值5.8.每瓶接种1个外植体,每组处理50瓶,重复3次。培养温度(25±2)℃,光照时间12 h/d,光照强度3 500 Lux.20 d后观察记录腋芽生长情况,统计腋芽萌芽率。
1.2.3 增殖培养
以EM为基本培养基,采用L9(34)正交试验设计,加入6-BA(0.2 mg/L,0.5 mg/L,1.0 mg/L),IBA(0.1 mg/L,0.2 mg/L,0.3 mg/L),IAA(0 mg/L,0.1 mg/L,0.2 mg/L).取经过启动培养后获得的无菌腋芽,将其接种到上述培养基中,接种20 d后统计增殖系数。继代苗每隔20 d转接1次。
1.2.4 生根培养
以EM,2/3 EM,1/2 EM为基本培养基,采用L9(34)正交试验设计,加入IBA(0.1 mg/L,0.2 mg/L,0.3 mg/L)和IAA(0 mg/L,0.1 mg/L,0.2 mg/L).选取经过3次继代培养后,生长健壮、苗高2.5 cm以上的继代苗,将其接种到生根培养基中,每瓶接种2株~3株。30 d后统计生根情况,统计生根率和根生长状况。
1.2.5 炼苗
将根长达1 cm~2 cm的生根瓶苗移至炼苗室,自然光照,遮荫度50%,温度保持22 ℃,湿度90%以上,放置7 d.然后打开瓶盖,再放置7 d.期间每天进行2次叶面喷水保湿,并观察叶片,无卷叶现象。
1.2.6 移栽
15 d后,将经过炼苗的生根瓶苗从瓶中取出,清洗干净根部附着的培养基,切勿弄伤嫩根。将生根苗移栽到已消毒的基质中,移入温室,保持湿度在75%左右,温度在20 ℃左右,待有新叶长出后,统计移栽成活率。
2 结果与分析
2.1 外植体消毒
不同灭菌处理对外植体灭菌效果的影响见表1.
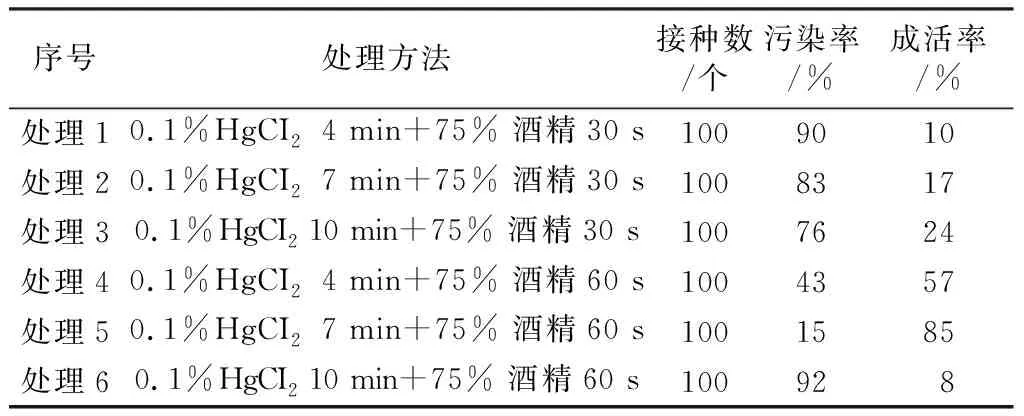
表1 不同灭菌处理对外植体灭菌效果的影响
由表1可知,用0.1% HgCI2和75%酒精对白榆外植体进行消毒处理,随着消毒时间的延长,污染率逐渐降低。处理1灭菌时间最短,处理6灭菌时间最长。随着灭菌时间延长,对外植体的伤害也越大,成活率降低。综表1数据得出,处理5外植体成活率最高,污染率最低,为白榆外植体消毒处理的最佳组合。
2.2 启动培养
将无污染的成活茎段接种到启动培养基中,不同浓度6-BA对白榆外植体启动的影响见表2.
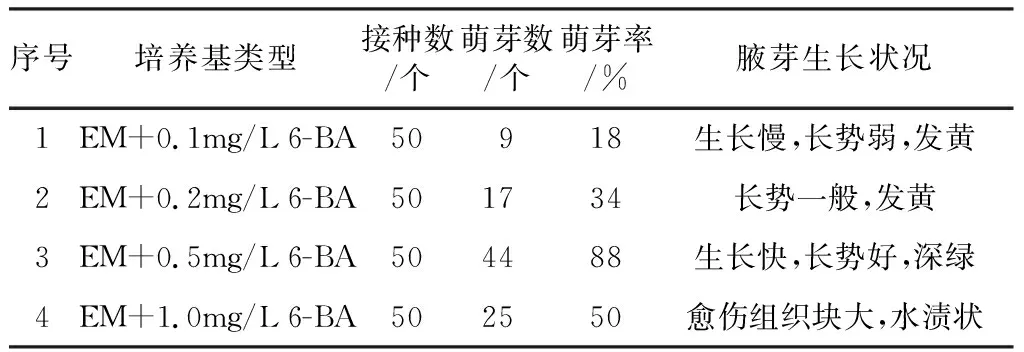
表2 不同浓度6-BA对白榆外植体启动的影响
由表2可知,1号、2号培养基中腋芽的萌芽率低,且腋芽生长缓慢、生长势弱;4号培养基中腋芽萌芽率高,但腋芽生长不良,有较大的愈伤组织;3号培养基中腋芽萌发率最高为,88%,且腋芽生长快、长势良好。综表2数据得出,EM+0.5 mg/L 6-BA为白榆启动最佳培养基。以上培养基均添加琼脂7 g/L,蔗糖30 g/L.
2.3 增殖培养
将生长良好的腋芽切下,接种到增殖培养基中,进行丛生芽增殖诱导。不同生长素配比对白榆增殖的影响见第36页表3.

表3 不同生长素配比对白榆增殖的影响
由表3可以看出,不同激素的不同配比,对白榆腋芽增殖有不同程度的影响。从R值的结果来看,细胞分裂素6-BA的影响作用最大,其次是生长素IAA,生长素IBA影响作用较小。在9个处理中,5号组合增殖系数最大。因此,白榆最佳增殖培养基为EM+0.5 mg/L 6-BA+0.2 mg/L IBA+0.2 mg/L IAA+琼脂 7g/L+蔗糖30 g/L.
2.4 生根培养
将经过继代培养、苗高2.5 cm的第3代继代苗,切取完整单株接种到生根培养基中,诱导生根。多因素配比对白榆生根的影响见表4.
由表4设计的L9(34)正交试验可知,多因素不同配比对白榆诱导生根有显著的影响。从R值的结果来看,培养基类型对白榆生根影响最大,其次是IAA,IBA的影响较小。在9个处理中,7号处理生根率最高,达95%,且根系生长状况最好,为下一步炼苗、移栽奠定了良好的基础。

表4 多因素配比对白榆生根的影响
2.5 炼苗移栽
经炼苗后移栽,移栽30 d后,白榆组培苗叶片长大,有新叶长出。统计移栽成活率,移栽成活率达90%以上。
3 结论
1) 白榆组培采用的基本培养基为EM基本培养基。
2) 白榆组培以半木质化带腋芽茎段为外植体,建立无菌系。
3) 外植体消毒最佳组合为:0.1% HgCI27 min+75%酒精1 min.
4) 最佳启动培养基为:EM+0.5 mg/L 6-BA+琼脂7 g/L+蔗糖 30 g/L.
5) 最佳增殖培养基为:EM+0.5 mg/L 6-BA+0.2 mg/L IBA+0.2 mg/L IAA+琼脂7 g/L+蔗糖30 g/L.
6) 最佳生根培养基为:1/2 EM+0.1 mg/L IBA+0.2 mg/L IAA+琼脂7 g/L+蔗糖30 g/L.
本实验为白榆组培快繁建立了理论基础,为白榆高效育苗提供了技术支撑,可推广应用于工厂化生产,为苗木市场提供优质的白榆种苗。

