牛骨胶原低聚肽对小鼠伤口愈合作用的研究
徐腾 刘睿 李林 王天星 李迪 刘欣然 李勇


摘 要:目的:研究牛骨胶原低聚肽对正常小鼠伤口愈合的影响及探讨其可能作用机制。方法:SPF级ICR雄性小鼠240只,随机分为1个对照組和5个BCOPs剂量组(0.375、0.75、1.5、3.0、6.0g/kg·BW)。用打孔器建立皮肤打孔手术模型,术后连续灌胃16 d,并在术后第4、8、12、16 d分批处死老鼠,测量不同时间点小鼠伤口剩余面积,检测血清中基质细胞衍生因子(SDF-1α)浓度,并进行HE染色行病理组织学观察。结果:与对照组相比,牛骨胶原低聚肽组小鼠术后伤口面积明显缩小(P<0.05),血清SDF-1α浓度显著增加(P<0.05)。并且同一时间点HE染色显示,牛骨胶原低聚肽组小鼠皮肤伤口上皮化水平、血管增生及纤维母细胞水平均优于对照组。结论:牛骨胶原低聚肽具有促进小鼠术后伤口愈合的作用,其机制可能与提高血清SDF-1α浓度有关。
关键词:牛骨胶原低聚肽;伤口愈合;基质细胞衍生因子;小分子生物活性肽
伤口愈合是一个由多细胞、多分子参与的精细修复过程,并且细胞之间必须相互协调发挥作用[1-2]。当皮肤受损后,伤口愈合进程也迅速开始,主要包括凝血期、炎症期、增生期和重塑期,这四个阶段连续发生并又相互交错[3]。在凝血期,凝血系统被激活后,血小板在受损部位聚集;在炎症期,可以观察到如巨噬细胞、中性粒细胞等白细胞;增生期则以纤维母细胞、内皮细胞等的迁移与增生,最终导致上皮血管再生,形成肉芽组织为主要特征;重塑期持续时间较长,过量的胶原被多种蛋白水解酶降解,完成组织修复[4-6]。很多情形下,创伤需要快速愈合,例如烧伤、外科创伤、糖尿病褥疮等[7]。因此,有必要寻找一种能够让伤口快速愈合、增加患者舒适、减少创伤后遗症的药物或功能性食品[8]。
研究表明,小分子生物活性肽(BAP)可明显改善氮吸收,提高内脏蛋白水平,增加体重,改善患者的免疫功能,且不会造成病人肠道不耐受,是临床营养制剂的良好原料。研究发现,海参肽、人参肽等小分子肽在抗炎、抗氧化、免疫调节和伤口愈合等方面有着重要作用[9-10]。现阶段对于提取自牛骨的肽类物质报道大多局限在对提取工艺的研究上,尚缺乏对其功能和应用方面的研究报道[11-12]。本研究采用皮肤打孔手术模型,研究一种提取自牛骨骼的小分子肽类物质即牛骨胶原低聚肽(BCOPs)对伤口愈合的促进作用及其可能机制,为BCOPs在作为促进伤口愈合功能性因子的保健食品及药品的开发方面提供科学依据。
1 材料与方法
1.1 样本
BCOPs,为淡白色固体粉末,经凯氏定氮仪测定肽含量为92.77 g/100 g、酸溶蛋白含量为95.5 g/100 g。利用高效液相色谱仪分析其游离氨基酸组成可知,氨基酸总量占2.73%,其中精氨酸、酪氨酸、苯丙氨酸、亮氨酸、赖氨酸较多。本样品购自北京天肽生物科技有限公司。
1.2 主要试剂与仪器
4%水合氯醛、青霉素G、4%甲醛溶液;6 mm打孔器、Adventurer TM 通用分析天平(美国奥豪斯国际贸易有限公司)、立式荧光显微镜(日本尼康公司,NIKON E400)、尼康D7200单反相机(日本尼康公司)、Eppendorf 高速冷冻离心机(德国艾本德股份公司)、电热恒温水浴锅(北京天林恒泰科技有限公司)。
1.3 实验动物
为排除雌激素的作用,本研究从北京大学医学部实验动物中心购买了240只6~8周龄,体质量为18~22 g的 ICR雄性小鼠(动物合格证号:SCXK(京)2012-0001;实验动物许可证号:SYXK(京)2011-0039;实验动物生产许可证号:SCXK(京)2011-0012)。实验动物房自由饮食。饲养实验室条件符合国标清洁级标准,温度范围为(25±1)℃,相对湿度为50%~60%,室内照明控制在12h/12h明暗周期节律。
1.4 方法
1.4.1 实验动物分组 动物适应性喂养1周后,根据随机分组原则,将240只小鼠按体重随机分为6个干预剂量组:1个对照组和5个BCOPs剂量组(0.375、0.75、1.5、3.0、6.0 g/kg·BW),分别对应BCOPs(0.375)、BCOPs(0.75)、BCOPs(1.5)、BCOPs(3.0)、BCOPs(6.0)。每个干预剂量组再随机分为4个实验亚组(n=10),在术后4、8、12、16 d依次对4个亚组的实验动物进行内眦取血、取样。
1.4.2 皮肤打孔手术模型的建立 4%水合氯醛腹腔麻醉小鼠后,剃干净小鼠背部毛发,用聚维酮碘和乙醇消毒后,使用4 mm打孔器在小鼠背部中线相距1cm处钻取全层皮肤,不伤及肌肉层,单侧孔相距1.5 cm,注射青霉素G(1 000 IU/g·体重)以防止感染。术后禁食6h,正常饮水。将手术当天记为术后0 d(POD 0),术后6 h进行受试物干预,每日经口灌胃给予受试样品。其中对照组给予蒸馏水,5个BCOPs剂量组依次灌胃给予相应浓度受试物,灌胃量为1 mL/100 g,干预时间为16 d。在实验期间密切观察实验动物的一般情况,包括毛色、精神状态、日常活动情况等。
1.4.3 伤口愈合率观察 在术后1、3、5、7、11、15 d给伤口拍摄照片;同时描摹伤口剩余面积,经扫描仪扫描之后,使用Photoshop软件计算伤口处像素点,等比例换算出面积,像素与实际面积比约为138∶1。
1.4.4 基质细胞衍生因子(SDF-1α)测量 在术后4、8、12、16 d经内眦采血分批处死小鼠,留取血清,用ELISA法测定血清SDF-1α浓度。
1.4.5 病理观察 在术后8 d取小鼠伤口边缘3 mm皮肤留存,经4%甲醛溶液固定,行HE染色。在光镜下进行观察伤口上皮化、纤维母细胞增生情况,并拍摄照片。
1.5 统计学处理
用SPSS 24.0软件对数据进行分析。连续变量数据用均数±标准差(±s)表示,行单因素方差分析,采用LSD法进行组间的统计检验,方差不齐者以Dunnetts T3法对多组均数进行post-hoc分析。使用graphpad prism 5绘制图表。确定P<0.05为差异有统计学意义。
2 结果与分析
2.1 实验动物一般情况
实验期间各组小鼠未死亡现象,正常进食、饮水,生长、活动未见异常,毛色、精神状况未见异常。
2.2 伤口愈合观察
2.2.1 肉眼观察 伤口愈合良好,未出现红肿、积血、积液等不良反应,术后15 d,可见伤口基本填平,伤口面积缩小,伤口颜色逐渐向正常皮肤组织转变(图1)。
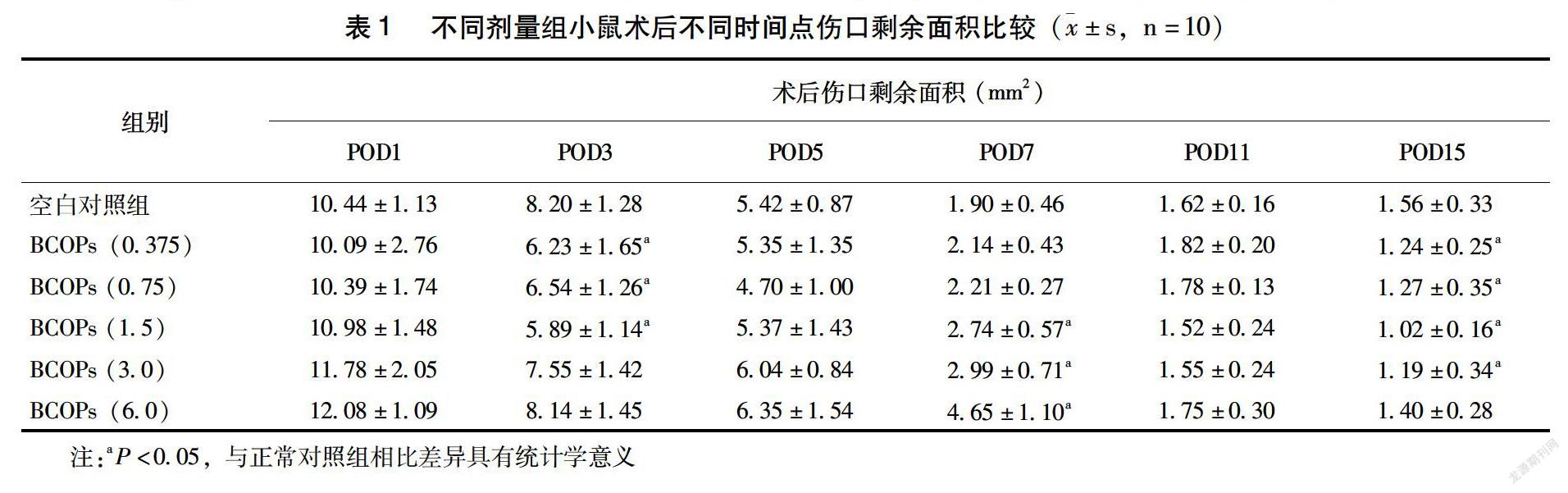
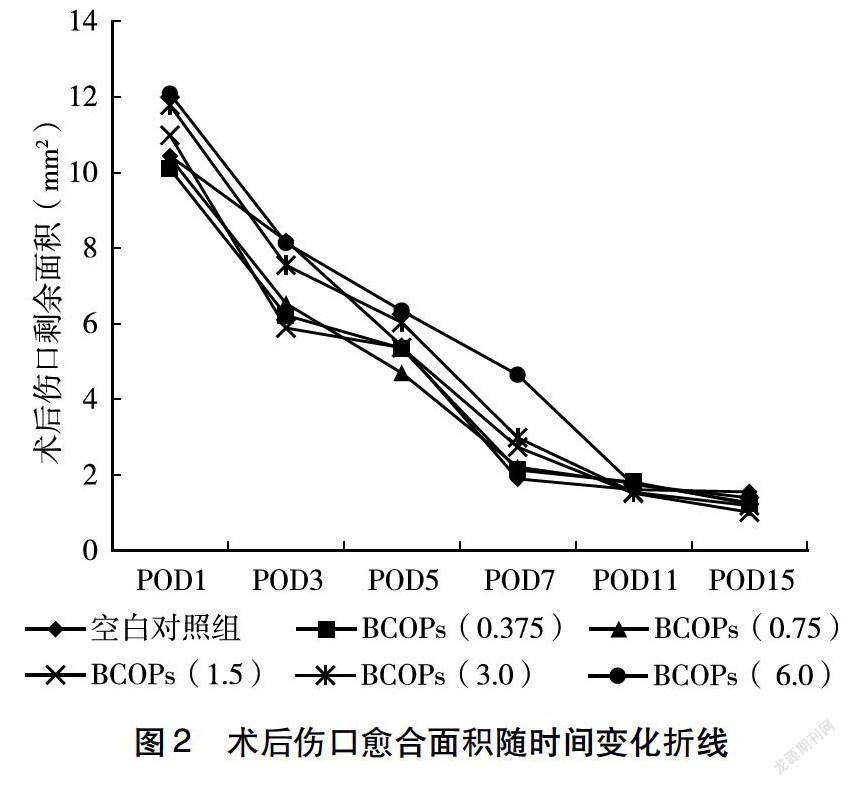
2.2.2 牛骨胶原低聚肽对皮肤伤口大小的影响 如表1所示,术后3 d,BCOPs剂量组伤口剩余面积均小于对照组,其中BCOPs(0.375、0.75、1.5)剂量组与对照组比较差异有统计学意义(P<0.05);术后7d,BCOPs劑量组伤口剩余面积均比对照组小,所有剂量组与对照组比较差异有统计学意义(P<0.05),提示牛骨肽使伤口愈合进程加快;术后15 d,BCOPs剂量组伤口剩余面积均小于对照组,BCOPs(0.375、0.75、1.5、3.0)剂量组与对照组相比差异有统计学意义(P<0.05)。图2为术后伤口剩余面积随时间变化的折线图。
2.3 牛骨胶原低聚肽对小鼠血清SDF-1α浓度的影响
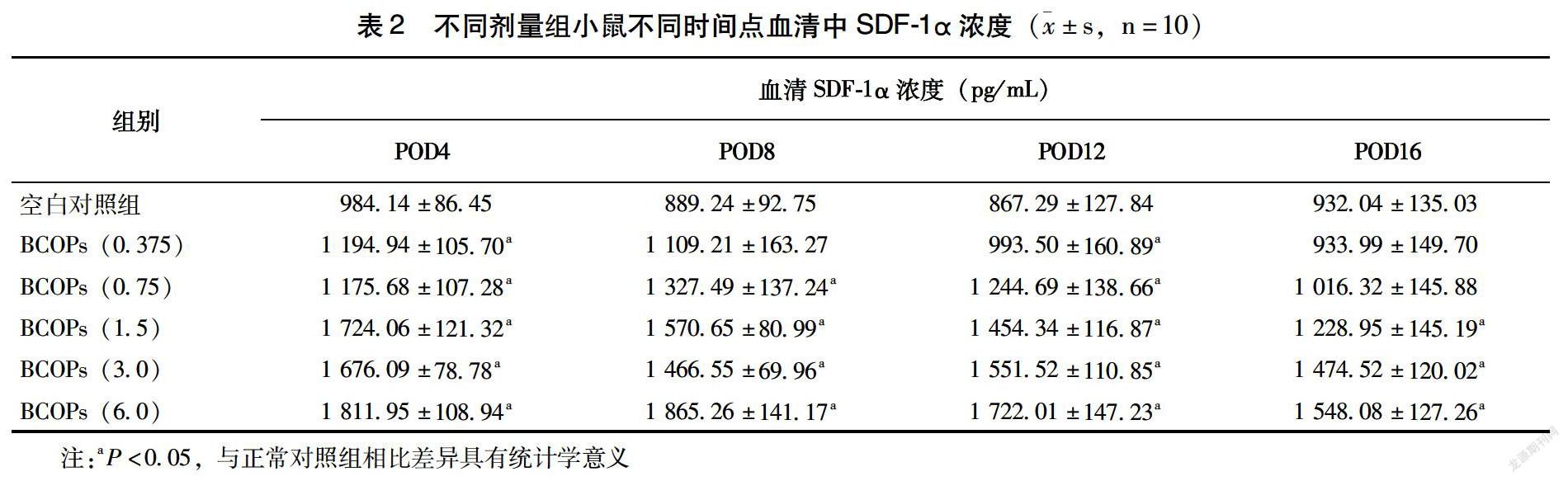
如表2所示,在术后4、8、12 d,BCOPs各剂量组小鼠血清中SDF-1α浓度均高于对照组,差异有统计学意义(P<0.05)。术后16 d,BCOPs各剂量组小鼠血清中SDF-1α浓度平均值均高于对照组,其中BCOPs(1.5、3.0、6.0)剂量组小鼠血清中SDF-1α浓度高于对照组,差异有统计学意义(P<0.05)。
2.4 皮肤打孔手术模型HE染色观察
如图3所示,对照组伤口上皮化较差,皮肤表皮层断裂不连续,同时纤维母细胞增生较少,血管数量较少;BCOPs(0.375)剂量组皮肤表皮连续,表皮层增厚,纤维母细胞数量增多;BCOPs(0.75)剂量组镜下可见纤维母细胞分化,胞浆较少,核变长,血管较多;BCOPs(1.5)剂量组镜下可见基底细胞紧密排列,真皮层胶原纤维趋于整齐;BCOPs(3.0)剂量组镜下可以发现胶原纤维排列整齐,上皮化良好,表皮层较厚,并且开始出现毛囊;BCOPs(6.0)剂量组镜下可见皮下组织分化良好的细胞。
3 讨论
伤口愈合是一个复杂的过程,是机体对损伤刺激的生理反应,其迅速开始于创伤发生后[6]。当机体出现外伤时,血管收缩,血小板在受损部位聚集,并释放生长因子吸引炎症细胞;同时,凝血系统被激活后产生了凝血酶,促进纤维蛋白原转化为纤维蛋白。在之后的2~3 d内,多种炎症细胞在伤口趋化和聚集,在吞噬入侵细菌的同时也会释放出多种生长因子。伤口愈合的增生期通常发生在创伤发生后的7~14 d,增生期是创伤愈合的关键阶段,特征之一便是上皮化[5]。在此期间,多种细胞增殖速度增加,多种生长因子发挥重要作用[13-15]。其后伤口愈合组织的重塑期和细胞增殖阶段彼此重叠,其过程可达数年甚至终生。目前,针对肽对促进伤口愈合作用的研究较少,刘悦等[16]、黄亚增等[17]研究发现,猪骨多肽在一定程度上可以抑制实验性大鼠蛋清性关节炎的炎性反应,并能够抑制棉球肉芽肿的渗出及抑制其增生,可应用于防治风湿、类风湿疾病,并且在骨折修复、骨质疏松方面也有一定作用。
本研究以蒸馏水作为对照,采用皮肤打孔手术模型,钻取小鼠背部两侧直径4 mm的全层皮肤,来探讨BCOPs对术后的伤口愈合是否具有促进作用,结果显示,术后3 d,BCOPs(0.375、0.75、1.5)剂量组伤口剩余面积小于对照组(P<0.05);术后7 d,所有BCOPs干预组的伤口剩余面积明显小于对照组(P<0.05),这表明BCOPs剂量组的伤口愈合情况明显优于对照组,提示BCOPs对于伤口愈合具有一定的促进作用。与此同时,本研究绘制了术后小鼠伤口剩余面积随时间变化的折线图,可见BCOPs(0.75)剂量组在术后0~11 d具有较快的愈合速度。对伤口剩余面积的进一步分析发现,伤口剩余面积会在某个时间点发生较大变化,对照组约发生在术后7 d,BCOPs剂量组有所提前,约发生在术后5 d。根据手术后15 d结果,BCOPs(6.0)剂量组小鼠伤口剩余面积与对照组相比无显著性差异,从折线图也未见其伤口愈合速度明显快于对照组,因此初步推测高剂量组在伤口愈合后期作用并不明显。
有研究显示,SDF-1α不仅具有促血管生成作用[18],还可以增加外周血内皮祖细胞的数量和功能,继而改善内皮修复能力,维持内皮损伤和修复之间的动态平衡,恢复及改善内皮功能[19]。对不同时期小鼠血清中SDF-1α的浓度进行统计分析发现,在术后4、8、12 d,BCOPs剂量组实验动物血清SDF-1α的浓度与对照组相比,均明显升高(P<0.05)。BCOPs能够促进SDF-1α的分泌,从而促进血管生成,改善内皮修复能力,这也可能是BCOPs对伤口愈合具有促进作用的机制之一。伤口愈合增生期约发生在创伤造成的7 d后[20]。本研究在术后8 d观察伤口组织病理情况,在BCOPs剂量组中发现大量上皮化、血管增生以及纤维母细胞分化的证据,以上发现也说明了BCOPs具有一定的促进伤口愈合的作用。
综上所述,本研究通过建立小鼠伤口模型,探讨BCOPs对伤口愈合是否具有促进作用,结果显示,BCOPs可以有效促进小鼠伤口愈合,缩短伤口愈合周期,其可能的机制之一是通过促进SDF-1α的分泌从而促进血管生成,加快伤口愈合。伤口愈合是一个复杂的过程,BCOPs对于促进伤口愈合的具体机制仍有待进一步探索研究。
参考文献
[1]Atiyeh BS,Ioannovich J,Al-Amm CA,et al.Management of acute and chronic open wounds:the importance of moist environment in optimal wound healing[J].Curr Pharm Biotechnol,2002,3(3):179-195.
[2]Kasuya A,Tokura Y.Attempts to accelerate wound healing[J].J Dermatol Sci,2014,76(3):169-172.
[3]Darestani KD,Mirghazanfari SM,Moghaddam KG,et al. Leech therapy for linear incisional skin-wound healing in rats[J].J Acupunct Meridian Stud,2014,7(4):194-201.
[4]Tanno H,Kawakami K,Ritsu M,et al.Contribution of invariant natural killer T cells to skin wound healing[J].Am J Pathol,2015,185(12):3248-3257.
[5]柏書博.小鼠放创复合伤伤口愈合延迟机理研究[D].上海:第二军医大学,2011.
[6]张静,张仲,胡永清,等.伤口愈合的研究进展[J].中华骨科杂志,2005,25(1):58-60.
[7]Kandhare AD,Alam J,Patil MV,et al.Wound healing potential of naringin ointment formulation via regulating the expression of inflammatory,apoptotic and growth mediators in experimental rats[J].Pharm Biol,2016,54(3):419-432.
[8]Bowler PG.Wound pathophysiology,infection and therapeutic options[J].Ann Med,2002,34(6):419-427.
[9]刘睿,任金威,陈启贺,等.人参低聚肽对急性酒精性肝损伤大鼠的保护作用[J].现代预防医学,2016,43(15):2820-2824.
[10]何丽霞,陈启贺,刘睿,等.海参寡肽海参寡肽:免疫调节作用及机制研究[J].科技导报,2016,34(11):42-47.
[11]何兰.牛骨胶原蛋白的提取及复合海绵的制备研究[D].武汉:华中农业大学,2012.
[12]付文雯,马美湖,蔡朝霞.牛骨蛋白酶解制取肽钙的研究进展[J].食品与发酵科技,2009,45(1):1-5.
[13]Smith PD,Kuhn MA,Franz MG,et al.Initiating the inflammatory phase of incisional healing prior to tissue injury[J].J Surg Res,2000,92(1):11-17.
[14]Stadelmann WK,Digenis AG,Tobin GR.Physiology and healing dynamics of chronic cutaneous wounds[J].Am J Surg,1998,176(2A Suppl):26S-38S.
[15]铁璐,伊利夏提·肖开提,王宪,等.糖尿病伤口愈合的分子机制[J].生理科学进展,2010,41(6):407-412.
[16]刘悦,吴刚,李磊.骨肽注射液治疗中老年骨质疏松症疗效观察[J].海南医学院学报,2004,10(6):404-405.
[17]黄亚增,侯思恩,赵红英,等.骨肽注射液(古欣肽)在四肢骨折合并肿胀病人的疗效观察[J].海峡药学,2004,16(4):99-101.
[18]冯帅南,王莎莉,朱方强,等.基质细胞衍生因子1α促进皮肤创面的新血管形成[J].中国组织工程研究与临床康复,2009,13(11):2019-2023.
[19]郑浩.基质细胞衍生因子-1a对外周血内皮祖细胞的影响及其机制探讨[D].杭州:浙江大学,2008.
[20]Stadelmann WK,Digenis AG,Tobin GR.Physiology and healing dynamics of chronic cutaneous wounds[J].Am J Surg,1998,176(2A Suppl):26S-38S.
Abstract:ObjectiveTo investigate the influence and mechanism of bovine collagen oligopeptide on wound healing in mice.MethodA total of 240 ICR mice were randomly assigned to 6 groups,including a control group and 5 bovine collagen oligopeptide intervention groups (0.375、0.75、1.5、3.0、6.0g/kg·BW).And each group was randomly assigned to 4 subgroups.The mice were carried out by mice stomach-lavaging continuously for 16 days after excisional wound model.And the mice would be sacrificed separately at day 4,day8,day12 and day 16.Wound closure was assayed,and the serum SDF-1α parameter was conducted.After fixation of the skin biopsy samples in 4% formalin,they were embedded in paraffin and stained with HE.ResultWe found that bovine collagen oligopeptide treatment could significantly decrease the wound region (P<0.05)and increase the secret of SDF-1α (P<0.05).ConclusionThese findings suggest that bovine collagen oligopeptide have an obvious promote on wound healing and the underlying mechanism may be related to enhancing SDF-1α.
Keywords:bovine collagen oligopeptide(BCOPs);wound healing;SDF-1α;BAP
(责任编辑 李婷婷)

