金矿提金技术及其研究进展
李骞 董斯宇 许瑞 杨永斌 徐斌 姜涛















摘要:从难处理金矿石中提金是黄金产业发展的必然趋势,而如何绿色、高效地回收金是当前面临的技术难题之一。概述了难处理金矿石的特征,综述了难处理金矿石预处理技术和研究现状,评述了浸金方法的研究进展,并分析了各方法的显著特点和作用机理,以及其优点和局限性,同时展望了预处理技术和浸金方法的合理配置将是难处理金矿石绿色提金的发展方向,为提金技术的进一步研究及应用提供参考依据。
关键词:难处理金矿;预处理技术;浸金方法;绿色提金;非氰浸出
中图分类号:TD953 文章编号:1001-1277(2020)09-0086-16
文献标志码:Adoi:10.11792/hj20200914
引 言
金以其优异的物理化学性能(如高熔点、良好的导电性和耐酸性能等)被广泛应用于电气设备、精密检测、生物制药等领域[1-2]。近年来,随着易处理金矿资源逐渐枯竭,低品位和难处理金矿已成为黄金生产的主要来源。据统计,世界上约2/3的黄金资源属于难处理金矿资源,黄金总产量的1/3左右产自难处理金矿[3-4]。因此,从难处理金矿石中提金已经成为国内外黄金生产领域研究的热点。
氰化法已广泛应用于从金矿石和金精矿中提金,但氰化物处理不当会对环境造成严重的污染。因此,非氰浸出试剂提金引起了广泛关注。但是,由于直接浸出法不能有效地从难处理金矿石中提金,浸出前必须进行预处理,因此预处理技术也得到了不断研究和发展。本文对难处理金矿石主要的预处理技术和浸金方法进行了综述,分析了其优缺点和研究进展,为金矿提金技术研究和应用提供参考和借鉴。
1 难处理金矿石预处理技术
难处理金矿石中的金颗粒通常被硫化物、碲化物、砷化物、碳质物(CM)等基质包裹,使金颗粒无法直接与浸金试剂接触。因此,在浸金前需要对其进行预处理,将金颗粒从难处理成分中释放出来,使金易于被浸金试剂溶解[5-7]。难处理金矿石主要预处理技术有焙烧氧化[8]、化学氧化[9]、加压氧化[10]和生物氧化[11]等。
1.1 焙烧氧化
迄今为止,焙烧氧化预处理难处理金矿石或金精矿已有70多年的历史,其具有工艺成熟可靠、操作简单、适应性强等优点,是最具经济效益的预处理方法之一。焙烧的目的是[4,12]:①破坏矿物组分,使金颗粒暴露;②减少可能消耗试剂的活性成分,如磁黄铁矿、硫酸亚铁等;③使碳质金矿石中的碳质物挥发;④生成比表面积大、孔隙率高的氧化产物(Fe2O3);⑤以环境可接受的形式固定砷和硫。
黄铁矿焙烧通常在650 ℃~700 ℃下进行。焙烧过程中首先将黄铁矿转化成磁黄铁矿(FeS),然后磁黄铁矿再转化为赤铁矿(Fe2O3),赤铁矿不溶于氰化物溶液,并且有足够的孔隙暴露金颗粒。其中,氧分压和焙烧温度是焙烧过程中的2个重要参数。发生的化学反应主要有:
焙烧温度在450 ℃以上时,AuTe也可以被分解,如化学反应式(4)所示。
毒砂的焙烧温度在650 ℃左右,在焙烧过程中毒砂最终被转化为赤铁矿、三氧化二砷(As2O3)和SO2。其中,氧分压和焙烧温度是控制最终产物的主要参数。发生的化学反应主要为:
焙烧过程中会出现铁物相熔融或再结晶现象,容易形成金的二次包裹,导致金浸出率降低;同时,会产生SO2和As2O3气体,严重污染环境。为解决焙烧过程中二次包裹和环境污染等问题,研究者对焙烧工艺和设备进行了改进,从单炉到多炉,从固定床焙烧到流化床焙烧再到闪速焙烧。此外,在传统工艺的基础上,发展了磁化焙烧[13]、富氧焙烧[14]、盐化焙烧[15]和固化焙烧[16]等。这些焙烧技术虽然在一定程度上提高了金浸出率,但都不可避免地会释放有毒有害气体或产生二次包裹的现象。
微波焙烧法是近些年发展起来的一种新预处理方法,其具有选择性强、加热速度快、效率高等优势。同时,微波加热具有降低反应温度的作用,可以通过适当控制温度来避免含砷、硫等有毒气体的产生。微波焙烧法主要是利用矿物的吸热特性加热矿物,由于微波能迅速穿透并将能量储存在矿物中,使焙烧预处理更加节能。研究表明,采用微波焙烧法對难处理金矿石和金精矿进行预处理,可有效氧化硫化物和碳质物,使金颗粒暴露,从而提高金浸出率[17]。Iván Amaya等[18]研究了在微波范围内应用电磁波预处理难处理金矿石,结果表明,焙烧时间减少了77 %~83 %,电耗平均降低了88 %左右,同时金浸出率可达到传统焙烧法的90 %左右。R.K.Amankwah等 [17]采用微波焙烧法处理难处理金精矿,结果表明,硫、砷和碳质物的去除率均在92 %以上,金浸出率超过95 %。目前,加拿大的EMR微波技术公司已对多种难处理金矿石和尾矿进行了微波预处理中试试验[19]。
1.2 化学氧化
化学氧化是难处理金矿石有效预处理技术之一,其适应性强,可以针对不同的矿物选择不同的试剂。化学氧化主要是利用溶液中的强氧化剂破坏硫化物结构,使金颗粒暴露,利于后续浸出。目前,常用的氧化剂主要有臭氧[20]、硫酸铁[21]、过氧化物[22]、高锰酸钾[23]、次氯酸盐[24]和硝酸[25]等。
Qingcui Li等[20]利用臭氧和铁离子在酸性介质中氧化难处理金矿石中的黄铁矿等硫化物,氰化金浸出率可由19.5 %提高到96.5 %,但该方法反应温度较高,需要大量的氧化剂。Denver H.Cowan等[21]研究了2种不同的碳基催化剂(AF-5和活性炭)对硫酸铁介质氧化黄铁矿的辅助作用,结果表明:在没有催化剂辅助时,黄铁矿氧化率仅为60 %;在相同的试验条件下,AF-5辅助作用下的黄铁矿氧化率约为96 %,活性炭辅助作用下的黄铁矿氧化率为100 %;尽管添加碳基催化剂极大地提高了黄铁矿的氧化动力学特性,但是碳质物对金具有一定的吸附作用,从而导致金浸出率降低。Jian Wang等[23]利用高锰酸钾溶液或过氧化氢在酸性介质中对高砷高硫难浸金精矿进行预氧化,结果表明:高锰酸钾作为氧化剂时,砷和铁的去除率分别为61.4 %和51.8 %;过氧化氢作为氧化剂时,砷和铁的去除率分别为57.2 %和51.9 %。Likang Fu等[24]研究发现,采用超声-氯化协同预氧化难处理金矿石,可以完全分解硫化物,并显著提高金浸出率。目前,硝酸预处理主要有Nitrox法和Arseno法,这2种方法已在工业中得到应用[25]。
虽然上述化学氧化法具有成本低、处理周期短等优点,但对试剂、矿物种类、工艺条件及环境变化等较为敏感。近期,Zaizheng Dong等[26-27]首次采用新型环保氧化剂二氧化氯(ClO2)在酸性条件下氧化黄铁矿和砷黄铁矿,结果表明:黄铁矿中Fe和S的氧化率分别可达到99.8 %和98.0 %;砷黄铁矿中Fe和As的氧化率分别为94.25 %和85.39 %;ClO2氧化法具有环境友好、氧化率高等优异性能,其有望作为难处理金矿石的预处理方法。ClO2氧化黄铁矿和砷黄铁矿的主要化学反应式如下:
1.3 加压氧化
加压氧化也是一种有效的难处理金矿石预处理技术。加压氧化通常在温度为190 ℃~230 ℃,压力为350~700 kPa的条件下进行[28]。在高温高压条件下,硫化物被氧化分解,使金颗粒从矿石中暴露出来。根据反应介质的不同,加压氧化预处理可分为碱性加压氧化和酸性加压氧化。其中,酸性加压氧化所用介质主要是H2SO4和HNO3,碱性加压氧化采用的介质主要是NaOH。
1)酸性加压氧化。当H2SO4作为介质时,高压釜中发生的主要化学反应为:
实际氧化过程中,H3AsO4并不是砷黄铁矿氧化后的最终产物,随着温度和停留时间,以及溶液酸度的变化,H3AsO4最终被转化为FeAsO4,以沉淀形式去除,如化学反应式(15)、(16)所示。
当HNO3作为介质时,发生的主要化学反应为:
氧化过程中生成的NO会被高压釜中的氧化剂继续氧化,进而转化为HNO3,而不会随尾气排放。
2)碱性加压氧化。当NaOH作为介质时,发生的主要化学反应为:
目前,国内外采用加压氧化的工厂已超过20家,由中国恩菲工程技术有限公司设计的国内第一个加压氧化项目也已超产稳定运行。然而,碱性加压氧化的工业应用较少,研究主要集中在酸性加压氧化。这主要是由于酸性加压氧化具有硫化物分解完全,适合大型提金厂使用等优势。但是,该方法对设备和材料质量要求高,安全风险大,条件控制不当会产生新生物质,导致二次包裹。此外,该方法不适用于含碳难处理金矿石。
1.4 生物氧化
生物氧化被认为是难处理金矿石和金精矿最具前景的预处理技术之一,在过去20多年中得到了广泛应用。这主要是由于生物氧化具有环境友好和对低品位矿石适应性强等优异性能[29-31]。目前,通过生物氧化所生产的黄金约占全球总产量的5 %[32]。在生物氧化过程中,一些自养细菌通过将Fe2+氧化为Fe3+或将单质硫(S)或其他还原性硫化物氧化成硫酸而获得能量,同时将金从硫化物中释放出来[31]。发生的化学反应为:
研究表明,Fe3+浓度会显著影响微生物对硫化物的氧化速率[33]。Natalya V.Fomchenko等[34]研究发现,Fe3+的加入在初始阶段破坏了毒砂表面的化学键,增强了毒砂与溶液之间的电子转移。Duorui Zhang等[35]评估了Fe3+对中等嗜热嗜酸菌株Sulfobacillus thermosulfidooxidans (S.t)YN-22促进毒砂生物浸出的影响,结果表明,Fe3+通过促进微生物的生长来增强矿物表面单质硫和雌黃(As2S3)的降解,从而促进毒砂的生物浸出,其氧化机理如图1所示。
一些难处理金矿石中含有一定量的碳质物(CM),在浸金过程中会发生“劫金”作用,从而降低金浸出率[36]。目前,对微生物降解CM的研究已有报道。Charles F.Kulpa等[37]研究发现,异养细菌的联合体可以使碳质组分上的活性位点失活,其可以是以下细菌中至少2种组成的微生物菌群:Pseudomonas(P.)maltophila,P.oryzihabitans,P.putida,P.fluorescens,P.stutzeri,Achromobacter spp.,Arthrobacter spp.和Rhodococcus spp.。此外,Phanerochaete chrysosporium可以通过产生木质素降解酶(木质素过氧化物酶和锰过氧化物酶)来降解碳质物[38]。Wantai Yen等[39]发明了一种基于真菌制剂和/或培养基从难处理金矿石中回收金的专利。这项专利中最具优势的微生物为异养白腐真菌,如Trametes spp.,Phanerochaete spp.,Phlebia spp.,Cyathus spp.和Tyromyces spp.等。
其中,某些真菌能将一部分CM转化为二氧化碳,而其他真菌则具有钝化CM的能力。此外,一些难处理金矿石中同时含有硫化物和CM,即双重难处理金矿石,可以采用两步微生物法处理此类矿石。R.K.Amankwah等[40]采用两步微生物法处理双重难处理金精矿:第一阶段,利用化能细菌氧化硫化物;第二阶段,使用链霉菌降解CM。硫化物经生物氧化处理后,氰化金浸出率为81.1 %;CM经Streptomyces setonii降解后,最终金浸出率达到94.7 %。此外,微生物也可用于氧化低品位含砷或含锑金矿石,从而提高金浸出率[41-42]。
综上,生物氧化预处理技术具有投资小、成本低、方法简单、操作方便、无污染等优点。然而,生物氧化仍存在一些不足,需要进一步改进。例如:大多自养浸矿细菌生长pH值为1.5~2.0,易腐蚀设备,且生物氧化过程较为缓慢等。
1.5 其他预处理技术
除上述预处理技术外,还有超细磨、磁脉冲等预处理技术。超细磨法是将金矿石超细磨至-10 μm占80 %左右,使微细粒金从包裹物中暴露出来,增大金与浸金试剂的接触面积,从而提高金浸出率。该方法虽然具有工艺简单,投资少,运行费用低,有利于微细粒金暴露等优势,但会增加硫化物的比表面积和反应活性,从而导致后续浸出过程中试剂的过度消耗[43]。磁脉冲是一种难处理金矿石的新型预处理技术,在高能磁脉冲作用下,矿物组分中晶格之间的键强度减弱,使载金矿物产生很多缝隙和裂纹,从而有利于浸金试剂与被矿物包裹的细粒浸染金接触。目前,磁脉冲预处理技术已在俄罗斯的几个大型金矿得到应用[44]。
2 浸金方法
浸金方法可分为非氰法和氰化法两大类。其中,非氰浸出试剂主要包括硫脲[45]、硫代硫酸盐[46]、卤化物(溴[47]、氯[48]、碘[49])、碱性氨基酸[50]、多硫化物[51]和硫氰酸盐[52]等。
2.1 氰化法
氰化法自诞生一个多世纪以来,由于其有效性、化学稳定性、低成本和成熟的工艺技术,一直在黄金生产行业处于主导地位。据统计,全世界超过80 %的黄金采用氰化法提取[49]。众所周知,金及其合金的溶解是在碱性氰化物和氧存在的条件下进行的,且溶解过程通常伴随氧的还原和氢氧化物的形成。发生的主要化学反应为:
当有过氧化氢(反应的中间产物)生成时,氧还原也可以分2个阶段进行。研究表明,氧直接还原和生成中间产物(过氧化氢)在热力学上都有可能[49]。第一阶段反应可表示为:
第二阶段反应可表示为:
一般情况下,堆浸氰化法金浸出率为50 %~80 %,常规浸出法平均金浸出率为99 %[53]。然而,浸出过程中的氰化物消耗和废水中氰化物的过量排放,加大了氰化浸金的经济成本[54-55]和环境成本[56]。氰化物在浸出阶段的消耗主要是与矿物(如铜和铁等硫化物)作用形成氰化络合物,或CN-转化为其他物质,如氰酸盐和硫氰酸盐。此外,氰化物具有很强的毒性,会对环境和人类健康造成很大的危害[57]。因此,氰化浸金过程中产生的废水必须经过处理,以降低氰化物和其他有毒物质的浓度,使其达到排放标准[58]。目前,已开发出多种可行的处理方法,但普遍存在成本较高等问题。因此,在浸出过程中减少氰化物的使用和排放是节约成本和避免污染的关键。G.Deschênes等[59]从含黄铁矿、少量磁黄铁矿和黄铜矿的矿石中回收金,结果表明,使用硝酸铅和氧气(分别为200 g/t和16×10-6)预浸后,氰化物消耗降低了三分之一,金浸出动力学速率提高了20 %。此外,众多研究者研究了氰化浸金动力学,并建立了模型[60-63],在实际浸出过程中,可通过模型控制关键因素来优化和降低氰化物的消耗。然而,对于含有铜、砷、辉锑矿和碳质物的难处理金矿石,氰化浸出的效率较低[64]。近年来,随着易于氰化浸出矿石资源的枯竭及世界各地金矿发生的一系列环境事故,引发了人们对非氰浸金试剂的广泛关注。
2.2 硫脲法
硫脲(SC(NH2)2/TU)是一种具有还原性的络合剂,能与多种金属离子结合形成络合物。Au[SC(NH2)2]+2的热力学稳定常数为22.1,表明硫脲是一种稳定的络合剂。金与硫脲只能形成一种稳定络合物,即双硫脲金络合物[65]。自首次报道硫脲可以作为金溶解试剂以来,大量的研究工作致力于研究硫脲作为氰化物的替代试剂从金矿石中浸金。目前,硫脲浸金体系已应用于澳大利亚新南威尔士州的新英格兰锑矿,其可以从辉锑矿精矿中回收50 %~80 %的金[66]。此外,Pierre Lacoste-Bouchet等[67]采用硫脲法从含0.4 % Cu 和5.6 g/t Au的矿石中提金,回收率达89 %。
2.2.1 酸性硫脲法
在酸性条件下,硫脲溶解金并形成阳离子络合物。阳极反应为:
与氰化物相比,硫脲的毒性很低,且在适当的氧化剂下,浸金初始反应动力学更快。Yaser Olyaei等[68]以金品位为0.8 g/t的代表性样品进行试验,考察了氰化法和硫脲法在不同浸出条件下的金浸出率,结果表明:粒度-63 μm占80 %,氰化物用量、浸出时间、pH值分别为1.23 kg/t、12 h和10.5的条件下,氰化金浸出率为95.21 %;硫脲用量、浸出时间、pH值分别为13.32 kg/t、5 h和1.7时,硫脲金浸出率为90.48 %。氰化法与硫脲法的主要区别为:在氰化法中,空气是唯一的氧化剂,而硫脲法则需要添加其他氧化剂才能溶解金。据有关资料,过氧化钠、过氧化氢、三价铁、纯氧、臭氧、二氧化锰、锰酸盐、重铬酸盐等均可作为硫脲浸金过程中的氧化剂[45],其中硫酸铁被证明是最有效的氧化剂[69]。硫脲和三价铁离子在酸性溶液中会形成相对稳定的络合物,有利于金的浸出。金在酸性硫脲溶液中的溶解主要发生以下化学反应[70]:
然而,在大多数硫脲浸金过程中,硫脲消耗较高,金表面会出现钝化现象,最终导致金浸出率较低。根据上述化学反应,硫脲浸金过程中会形成可以氧化金的二硫甲脒,其氧化产物会形成阳离子络合物配体Au(TU)+2的一部分。然而,如化学反应式(36)所示,二硫甲脒可被氧化为其他产物,且反应不可逆[71]。由于单质硫的形成,会导致硫脲消耗增加,同时硫会覆盖在矿物表面导致硫脲与金接触面积减小。
目前,普遍认为引起硫脲消耗的主要因素有矿物颗粒的吸附、热降解、与贱金属络合及铁离子和氧的氧化分解,而关键因素是溶液电位或硫酸铁浓度。为减少硫脲的消耗,提高金浸出率,研究人员采取了多种措施来调节浸出过程中的电位,如用水/稀酸溶液预洗、加还原剂(SO2、Na2SO3、Na2S2O5)和亚铁盐等。然而,金表面钝化和硫脲分解/消耗的机制仍不清楚。
2.2.2 碱性硫脲法
尽管有研究指出,只有当pH=1.78时,金才会在硫脲中溶解,且硫脲在pH=4.3以上时会被氧化而分解[72-73]。然而,酸性硫脲溶液浸金普遍存在硫脲消耗高,设备腐蚀严重,浸出条件(电位和pH)难以控制,浸出液再生過程复杂等一系列问题。为了克服上述缺点,提出了在碱性硫脲溶液中浸金的方法。在碱性硫脲溶液中,由于pH较高及硫脲具有还原性,导致Fe3+不能稳定存在。金在碱性硫脲溶液中溶解的机理可表示为:
综上所述,增强硫脲在碱性介质中的稳定性是碱性硫脲溶液浸金工业应用的首要条件。目前,已经发现Na2SO3和Na2SiO3可以有效阻止硫脲的分解,实现金的浸出[72,74]。Su Zheng等[72,75]研究了金矿焙砂在不同体系中的浸出行为,结果表明:稳定剂Na2SiO3可使浸出体系pH值维持在12左右,适合于碱性硫脲体系浸出;金矿石中伴生金属的浸出率均不到0.1 %(如表1所示),这表明碱性硫脲浸金具有较好的选择性。采用配合物的化学键理论和配位理论等分析发现,碱性硫脲溶液中Au、Ag、Cu、Ni和Fe分别以Au(TU)+2、Ag(TU)+3、Cu(TU)2+4、Ni(TU)2+4和Fe(TU)2+6的形式存在,Au(TU)+2中反馈σ-π配键的形成显著增强了其稳定性。Liyuan Chai等[76-77]从含金废料中选择性浸金,这些废料中含有贱金属和其他金属,如Ag、Ni和Fe等;电化学分析表明,在电位为0.58 V时,Au的溶出性能最佳;Au的溶解电流分别是Ag、Ni和Fe的2.04,2.42和27.7倍;随着Na2SO3和Na2SiO3的不断投加,Au的溶解电位向负方向移至0.42 V,Au的溶解电流分别为Ag、Ni和Fe的3.4,5.2和42.6倍[78]。该研究虽然从根本上解决了碱性硫脲溶液的稳定性问题,并成功实现了碱性硫脲体系高效、无害地从矿石中浸金,但对于高硫金矿石而言,碱性硫脲体系下金浸出率低于氰化法,并且可能存在钝化问题。此外,影响碱性介质中硫脲的稳定性和金选择性溶解的因素尚不明确。因此,为了提高金的浸出效果,许多问题仍需进一步研究。
2.3 硫代硫酸盐及多硫化物法
2.3.1 硫代硫酸盐法
硫代硫酸盐因其无毒、浸出效率高而被认为是最有前景的氰化物替代试剂之一。近年来,硫代硫酸盐浸金的工艺条件、浸出机理、热力学和动力学等方面已得到了广泛的研究[79-81]。在使用硫代硫酸盐浸金时,通常需要添加催化剂来提高金的浸出速率。其中,Cu-NH3-S2O2-3体系是国内外研究者长期研究形成的一种硫代硫酸盐浸金标准体系。在Cu-NH3-S2O2-3体系中,氨的主要作用是通过形成铜氨络合物稳定铜离子(如图2所示),从而减弱铜离子与硫代硫酸盐之间的反应。此外,该络合物可以将金的溶解速度提高18~20倍[82]。硫代硫酸盐浸金反应如化学反应式(43)所示。在阳极区,NH3优先扩散到金表面与其络合,生成Au(NH3)+2后进入溶液,NH3被S2O2-3取代形成更稳定的Au(S2O3)3-2,阳极反应如化学反应式(44)~(46)所示。在阴极区,Cu(NH3)2+4 被还原为Cu(S2O3)5-3,新生成的Cu(S2O3)5-3又被溶液中的溶解氧迅速氧化为Cu(NH3)2+4,阴极反应如化学反应式(47)、(48)所示。
Cu(NH3)2+4作为催化剂显著促进了金的溶解,但由于其较强的氧化能力,也加速了硫代硫酸盐的分解[83],S2O2-3很容易被Cu(NH3)2+4氧化为S4O2-6(如化学反应式(49)所示)。此外,硫代硫酸盐的分解产物S2-和SO2-3在硫代硫酸盐浸金体系中会在金表面形成严重的钝化层(如化学反应式(50)所示)。因此,Cu(NH3)2+4不仅催化了氧的还原反应,还催化了硫代硫酸盐的氧化反应。
鉴于Cu(Ⅱ)的催化会引起硫代硫酸盐的高消耗和金表面可能发生的钝化行为,以及氨潜在的环境风险等诸多因素,严重限制了传统的Cu-NH3-S2O2-3体系的开发和应用[84]。因此,研究人员进行了取代Cu-NH3催化的研究。Barrick黄金公司开发了一种将碱性加压氧化预处理与无氨硫代硫酸盐浸出相结合的工艺,该工艺已在美国内华达州的戈尔德斯特莱克矿成功实施[57]。目前,对无氨硫代硫酸盐体系的研究主要集中在从浸出过程中去除铜或氨(如氧-硫代硫酸盐体系等)。Suchun Zhang等[85]研究发现,碱性氧-硫代硫酸盐体系中金的溶解速率明显低于常规Cu-NH3-S2O2-3体系和氰化物体系。然而,当浸出试验在密闭的反应器中进行时,略微提高氧气压力和温度可以显著增加金浸出率[86]。有研究表明,一些过渡金属可作为铜潜在的替代品,如铁、镍和钴等[87-89];镍-氨催化的硫代硫酸盐用量明显低于铜-氨催化的硫代硫酸盐用量,2种体系催化作用下的金浸出率相当。Harunobu Arima等[90]采用镍-氨催化硫代硫酸盐体系从硅酸盐型金矿石中浸金,金浸出率可达到95 %,而硫代硫酸盐用量仅为1.2 kg/t矿。Bin Xu等[87]研究了以钴-氨络合物作为催化剂,用硫代硫酸盐从焙烧金精矿中浸金的新方法,结果表明,与传统的铜-氨催化浸金相比,钴-氨催化法对金浸出率无明显影响,但可明显降低硫代硫酸盐用量。J.A.Heath等[89]研究发现,Fe(Ⅲ)-EDTA4-和Fe(Ⅲ)-C2O2-4配合物是硫代硫酸盐溶液在好氧和厌氧条件下溶解金的有效氧化剂,但这2种体系对金的溶解速率明显低于传统的铜-氨-硫代硫酸盐体系。此外,Cu2+也可以与乙二胺络合,形成稳定的铜-乙二胺络合物。Hong Yu等[91]采用铜-乙二胺-硫代硫酸盐体系从含褐铁矿的金矿石中浸金,结果表明,铜-乙二胺-硫代硫酸盐体系比铜-氨-硫代硫酸盐体系浸金效果更好,使用十六烷基三甲基溴化铵作为协同添加剂,可以显著增加金浸出率并降低硫代硫酸盐的消耗,金浸出率达到94.3 %,硫代硫酸盐用量仅为1.12 kg/t矿。然而,乙二胺的毒性及其昂贵的价格严重限制了这种新型催化体系的应用。
许多含有羧酸或氨基官能团的有机化合物也已被证明可以作为氨的替代配体(如图3所示)。硫酸根离子、氯离子和磷酸根离子等阴离子的存在可以显著降低硫代硫酸盐对铜(Ⅱ)的还原速率[92],且添加硫酸盐对金的浸出有促进作用[93]。此外,EDTA与Cu2+络合后能有效稳定硫代硫酸盐,加入少量EDTA可显著提高金浸出率[93-94]。然而,EDTA能够与多种金属离子络合,在复杂多金属硫化物矿石浸出过程中,会导致成本较高。D.Feng等[92]使用氨基酸与硫代硫酸盐混合试剂对黄铁矿进行浸金时发现,氨基酸与Cu2+形成的稳定络合物比氨与Cu2+形成的络合物稳定,这有助于降低混合溶液电位,从而降低硫代硫酸盐的消耗。Jian Wang等[84]研究了铜-檸檬酸盐-硫代硫酸盐体系从难处理碳质金精矿中浸金,结果表明,当柠檬酸盐作为稳定剂时,铜-柠檬酸盐-硫代硫酸盐体系对金的浸出能力与传统的铜-氨-硫代硫酸盐体系相当,但硫代硫酸盐的消耗明显降低。据有关研究资料,硫化物如黄铁矿、黄铜矿和赤铜矿会促进无氨硫代硫酸盐体系对金的溶解[85],但不利于有氨硫代硫酸盐体系对金的溶解。无论是有氨还是无氨硫代硫酸盐体系,硫化物的存在都会增加硫代硫酸盐的消耗,这主要是由于硫化物会催化硫代硫酸盐的氧化[95-97]。
2.3.2 多硫化物法
多硫化物是含硫浸金试剂中另一种潜在的氧化剂,这主要是由于多硫化物可以从高分子量多硫化物还原为低分子量多硫化物或硫化物[51]。研究表明,在以铜-氨为催化剂的多硫化物/硫代硫酸盐溶液中,即使金精矿中含有5 %的砷,在反应温度50 ℃时,金回收率也可达到90 %[57]。多硫化物阴离子(S2-n,2 ≤ n ≤ 5)可以通过单质硫和硫化物在碱性溶液中反应获得,在碱性溶液中金被溶解而形成金硫络合物[57,98]。发生的化学反应主要为:
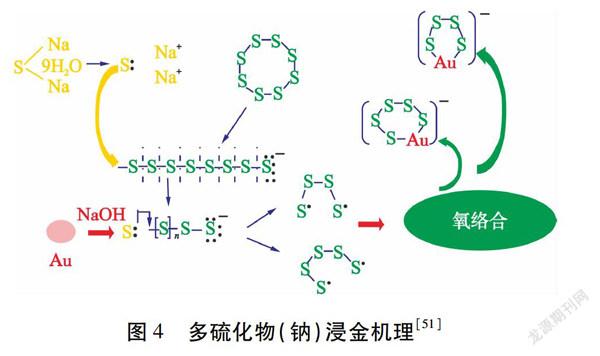
近年来,人们发现四硫化物和五硫化物在碱性多硫化物溶液浸金中起着重要作用,对含金锑矿石具有良好的浸出性能。Qingjuan Wen等[51]研究了碱性多硫化钠溶液从矿石中浸金的行为,结果表明,多硫化钠具有较好地从含金锑矿石中提取金的能力,金浸出率与多硫化钠浓度、硫/多硫化钠比例、氢氧化钠浓度和反应温度有关,优化后金浸出率为85 %。其中,四硫化钠和五硫化钠是金浸出的主要活化试剂,浸出机制如图4所示。
综上,多硫化物对含砷、锑难处理金矿石的浸出具有明显优势。此外,多硫化物浸出试剂可以从含金硫化物中制备,这为解决试剂消耗高的问题提供了一个潜在方案,同时使硫资源得到综合利用。然而,碱性含硫浸出体系会对金产生钝化作用,含硫阴离子经氧化或分解形成钝化层,钝化层主要由硫的同素异形体、硫化物和聚硫酸盐组成。因此,需要进一步研究不同含硫物质对金浸出的贡献及其与金表面的相互作用机理。随着对含硫浸出剂研究的不断深入,多硫化物浸出剂有望在将来实现工业应用。
2.4 卤化法
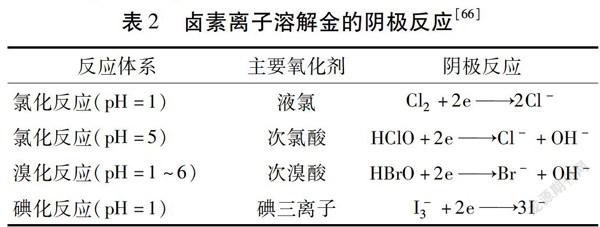
使用卤化物(氯、溴和碘)体系进行浸金的应用比氰化浸金更早,卤素离子X-溶解金的阳极反应可表示为:
阴极反应如表2所示。
1)氯化法。在氰化法出现之前,氯被广泛用作从焙烧矿石和精矿中回收金的浸出试剂,且氯化浸金速率高于氰化浸金。有研究表明,低pH、高浓度氯化物/氯和金颗粒的高比表面积,以及升高温度有利于氯化浸出动力学进行[100]。但是,即使是低含量的硫化物或矿石中存在的其他活性成分,也会使试剂过度消耗,并使AuCl-4还原为金属金。Morteza Baghalha[101]采用氯化物/次氯酸盐溶液从氧化金矿石中浸金,研究了操作条件对浸出性能和金氯络合物稳定性的影响,结果表明:金氯络合物在溶液中不稳定,且会被矿物中的石英成分强烈吸附;同时酸性系统会腐蚀设备,从而导致成本增加。当天然水为盐水时,可以通过电解方式从盐水中生产氯气,其成本可能比氰化浸金更低,这种方法已被提议用于原位浸出[66]。
2)溴化法。Schaeffer在1882年首次提出使用溴从矿石中提金,但溴化法作为氰化法的替代方法并没有受到太多关注,直到最近研究者才开始重新考虑其应用问题。这主要是因为溴具有危险性,难以安全储存和运输[47]。溴酸盐作为一种强氧化剂,在酸性溶液中,其氧化还原电位大于其他多数氧化剂,具有氧化黄铁矿和毒砂的热力学性能[102-103],且可以较为安全的储存,不会挥发和逸到大气中。尽管溴酸盐的毒性比氰化物低,但它仍对人体有一定的危害。事实上,溴化浸金具有许多优点,如浸出速度快,对pH的适应性强,溶解金的速率比氰化物快等,但试剂的消耗往往很高[100]。溴化浸金正受到越来越多的关注,特别是自从Great Lakes公司申请了溴化浸金工艺专利以来,该工艺是采用一种专有的二溴-二甲基-乙内酰脲化合物作为浸金试剂[104]。
3)碘化法。碘化法具有电极电位低、浸出动力学快、浸出速率高、反应条件温和等特点[105],且适用于原位浸出,是一种很有前景的无氰浸金方法,有可能在工业上替代氰化法。但是,碘化法仍未得到充分研究和利用,这主要是由于其成本较高。P.H.Qi等[106]比较了碘和氰化物对金浸出率的影响,结果表明,在同等条件下,碘对金的浸出率与氰化物相当。
有研究表明,金卤离子络合物的稳定性顺序为I->Br->Cl-,金碘络合物的稳定性仅次于金氰络合物[105]。尽管在20世纪80年代,氯化法被美国的一些工厂用于预处理难处理碳质金矿石,但金卤离子络合物通常不稳定,其广泛应用性仍受到质疑,目前仅限于分析应用。其主要是需要在浸出过程中进行化学和过程控制,以保持金在溶液中的稳定性[100]。
2.5 硫氰酸盐法
硫氰酸盐法已被证明可以作为氰化法的替代方法从含金矿石中溶解和回收金[107],其重要特征之一是在酸性溶液中浸出金,金浸出率与硫脲相当。硫氰酸盐与氰化物相比其毒性更低,在各種介质中的稳定性更好,并且可以作为工艺过程中的副产品再生和获得。A.G.Kholmogorov等[108]从弱酸性KSCN溶液中回收了95 %以上的金,并用含碳吸附剂和离子交换器回收了硫氰酸盐复合物。A.J.Monhemius等[109]研究了在酸性氧化条件下使用碘催化的硫氰酸盐溶液浸出多米尼加共和国的金矿样品,结果表明,硫氰酸盐体系与氰化物体系浸金效果相当,但比硫脲浸出效果好,且SCN-消耗很少(<1 kg/t矿)。金在酸性硫氰酸盐溶液(pH=1.5)中的溶解过程可以表示为[110]:
在实际浸出过程中,Au(SCN)-2或Au(SCN)-4的生成取决于浸出条件,如硫氰酸盐浓度和氧化电位[110]。在氧化条件下硫氰酸盐的热力学性质不稳定,很容易被氧化成硫酸盐和亚稳态氰化物或氢氰酸(如化学反应式(55)所示)。
Jinshan Li等[107,110-113]系统描述了硫氰酸盐的化学和热力学行为、稳定性及浸金动力学和回收问题。在酸性硫氰酸盐溶液浸金过程中,常用硫酸铁作为氧化剂,Fe(Ⅲ)在氧化SCN-的过程中被还原为Fe(Ⅱ),并生成多种中间产物,包括(SCN)-3和(SCN)-2等,其既能氧化金又能络合金。在水溶液中,酸性硫氰酸盐可以溶解金并形成Au(Ⅰ)和Au(Ⅱ)络合物[100]。Jinshan Li等[110]测定了不同因素对硫氰酸盐氧化速率的影响,结果表明,硫氰酸盐氧化Fe(Ⅲ)对温度比较敏感,在50 ℃时,硫氰酸盐与三价铁离子的氧化还原反应生成亚铁离子的速率显著加快。硫氰酸盐消耗和/或亚铁离子生成的经验速率方程可表示为:
硫氰酸盐体系具有反应选择性好、环境风险小等优点,可利用Fe(Ⅲ)作为氧化剂加快浸出速率。但是,硫氰酸盐在浸出过程中容易被氧化剂氧化分解,导致浸出剂消耗增大,且需要特殊的不锈钢和橡胶衬里的设备来抵抗其高腐蚀性和氧化性。
2.6 甘氨酸法
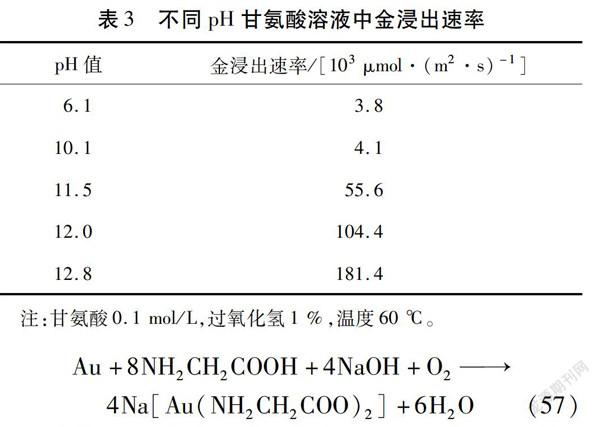
最近,有研究人员提出用甘氨酸溶液作为替代氰化物的浸出剂来浸出金等贵金属[114]。甘氨酸是一种非挥发性物质,无毒,在广泛的pH和Eh范围内都较为稳定[115],碱性甘氨酸体系已被证明有利于金的浸出。与氰化物相比,其价格相近或更低[116]。纯金箔在不同pH甘氨酸溶液中的浸出速率如表3所示[117]。由表3可以看出,当pH值从10.1增加到12.8时,金浸出速率明显增加。金与甘氨酸在中性及碱性条件下可形成甘氨酸金络合物,如化学反应式(57)所示,可以使用氢氧化钠或石灰调节pH。
甘氨酸作為无毒试剂在湿法冶金领域具有很大的应用潜力[118]。E.A.Oraby等[118-119]研究表明,甘氨酸浸出速度比常规氰化物慢很多,且在甘氨酸浸出过程中需要适度加热,但即使在高温下,其浸出率也低于室温下氰化浸出的1/3。然而,在有少量氰化物的情况下,其浸出率是仅氰化浸出的6倍和仅甘氨酸浸出的18倍。D.Feng等[92]研究表明,在硫代硫酸盐溶液中加入氨基酸(如甘氨酸)可以大大提高金浸出率。Hao Wu等[120]采用硫氰酸铵和甘氨酸混合试剂体系进行浸出试验,结果表明,在硫氰酸铵浸出液中加入甘氨酸,可降低硫氰酸铵用量,提高金浸出率。此外,在氧化剂存在的条件下,甘氨酸可以在不同的pH和温度下溶解金。J.J.Eksteen等[117]已经证明了铜是甘氨酸浸出的催化剂。D.H.Brown等[121]研究了过氧化氢对甘氨酸溶解铜金合金的影响,结果表明:铜含量越高,金和铜的浸出量越大;过氧化氢的存在有利于铜和金的浸出。C.G.Perea等[50]也发现,Cu2+可以提高金浸出率。然而,到目前为止,以甘氨酸作为唯一配体浸金的研究较少,仍需要进一步研究甘氨酸在不同条件下的浸金行为。
2.7 其他浸金方法
除上述浸金方法外,其他浸金方法有:①煤-金团聚法(CGA)。其已被证明可以作为氰化浸金的替代方法[100]。英国石油公司(BP)在20世纪80年代中期开发并申请了CGA工艺的专利。CGA工艺适用于浸出游离金颗粒,大规模应用潜力有限。②腈法。腈与氰化物类似,但毒性比氰化物小,价格比氰化物高[122]。美国矿业局(USBM)报道了丙二腈(CN-CH2-CN)比氰化物能更有效地浸出金[123],但丙二腈的毒性和较强的螯合能力阻碍了对其进一步的研究。③石硫合剂法。石硫合剂是由石灰和硫磺合制而成的一种浸金试剂。该方法具有浸出速度快、对设备腐蚀小、浸金试剂成本低等优点,但有效浸金成分不稳定,严重限制了其在工业中的应用[124]。此外,Rong Chen等[125]采用了一种新型无毒的有机浸出剂(3YL)进行了浸金研究,结果表明,与传统的氰化法相比,3YL在浸出速度、环境影响等方面都优于氰化物,但3YL的一些性质尚不清楚,仍需对其进行进一步研究。
综上所述,不同浸金方法具有不同的优缺点和反应条件,如表4和图5[126]所示。氰化法仍是目前最主要的浸金方法,但氰化物剧毒,易导致金矿地区土壤和水体污染,造成严重的生态环境问题。硫脲浸金是一种成熟的技术,其初始浸金速率较快且毒性较低,适用于难处理矿石,但其不稳定,易分解为其他复杂化合物,使金表面钝化,从而降低金的溶解速率,且工艺参数难以控制。硫代硫酸盐具有浸出效率较高,而且更环保的优点,但其非常不稳定,会被氧化为连多硫酸盐,导致试剂消耗高,循环使用能力有限。卤化物浸金具有金溶解动力学快,溶解过程中不发生钝化作用等优势,但卤化物与硫化物具有很高的反应活性,反应过程难以控制,需要昂贵的抗氧化材料,而且卤化物价格很高。硫氰酸盐是一种毒性低、比硫脲和硫代硫酸盐更稳定的浸出剂,但其浸出速率较慢,且需要特殊的不锈钢和橡胶衬里的设备来抵抗具有高腐蚀性的酸性和氧化条件。甘氨酸具有无毒、稳定性好等优点,但单独使用甘氨酸浸出比常规氰化物浸出慢很多,可以将甘氨酸与其他浸出试剂协同浸金。
3 难处理金矿石浸金现状
研究表明,对难处理金矿石进行预处理可显著提高金回收率。近年来发表的一些重要的难处理金矿石浸金研究成果如表5所示。然而,如何有效地将预处理技术与浸金方法相结合,形成低成本、高效率、环境友好的难处理金矿石浸金体系,仍是今后的主要研究方向。
4 结 论
难处理金矿石在浸出前通常要进行预处理,焙烧氧化、加压氧化、化学氧化和超细磨等是其有效的预处理方法。这些预处理方法不同程度存在污染环境、设备成本高、运行维护成本高、操作人员素质要求高等问题,严重阻碍了其实际应用。虽然生物氧化是一种成本低、环境友好、易于控制的预处理方法,但存在周期长等不足。目前,非氰浸出试剂已在冶金工业中引起了广泛关注。
其中,硫代硫酸盐是最具前景的浸金试剂之一,已在实验室规模上进行了大量研究,但其存在稳定性差,发生钝化现象,对难处理金矿石浸出率低等局限性。因此,综合考虑经济、可行性和环境问题,寻找一种低成本、高回收率的技术对从难处理金矿
石中回收金具有重要意义。建议未来可从以下几个方面进行进一步研究:
1)开发新型环保、价格低廉、氧化能力强的氧化剂,促进难处理金矿石的有效利用。
2)改善硫代硫酸盐的结构特性,提高其化学稳定性。
3)合理配置预处理技术和浸金方法,形成稳定的浸金体系是目前难处理金矿石高效浸出的发展趋势。然而,合理配置浸金体系的主要难点在于选择的冶金工艺要符合矿石的特性。因此,协同设计、联合优化具有集成功能的浸金体系是难处理金矿资源化利用的有效途径之一。
[参 考 文 献]
[1] MURAKAMI H,NISHIHAMA S,YOSHIZUKA K.Separation and recovery of gold from waste led using ion exchange method[J].Hydrometallurgy,2015,157:194-198.
[2] DAS N.Recovery of precious metals through biosorption—A review[J].Hydrometallurgy,2010,103(1/2/3/4):180-189.
[3] WANG H J,FENG Y L,LI H R,et al.The separation of gold and vanadium in carbonaceous gold ore by one-step roasting method[J].Powder Technology,2019,355:191-200.
[4] NAN X Y,CAI X,KONG J.Pretreatment process on refractory gold ores with as[J].ISIJ International,2014,54(3):543-547.
[5] KAKSONEN A H,MUDUNURU B M,HACKL R.The role of microorganisms in gold processing and recovery—A review[J].Hydrometal-lurgy,2014,142:70-83.
[6] OFORI-SARPONG G,OSSEO-ASARE K.Preg-robbing of gold from cyanide and non-cyanide complexes:effect of fungi pretreatment of carbonaceous matter[J].International Journal of Mineral Processing,2013,119:27-33.
[7] HU J H,HUANG H G,XIE H Z,et al.A scaled-up continuous process for biooxidation as pre-treatment of refractory pyrite-arsenopyrite gold-bearing concentrates[J].Biochemical Engineering Journal,2017,128:228-234.
[8] KIM B J,CHO K H,LEE S G,et al.Effective gold recovery from near-surface oxide zone using reductive microwave roasting and magnetic separation[J].Metals,2018,8(11):1-11.
[9] BIDARI E,AGHAZADEH V.Alkaline leaching pretreatment and cyanidation of arsenical gold ore from the Carlin-type Zarshuran deposit[J].Canadian Metallurgical Quarterly,2018,57(3):283-293.
[10] SALAZAR-CAMPOY M M,VALENZUELA-GARCIA J L,QUIRZ-CASTILLO L S,et al.Comparative study of gold extraction from refractory pyritic ores through conventional leaching and simultaneous pressure leaching/oxidation[J].Mining Metallurgy & Exploration,2020,37:1 279-1 284.
[11] KONADU K T,HUDDY R J,HARRISON S T L,et al.Sequential pretreatment of double refractory gold ore(drgo)with a thermophilic iron oxidizing archeaon and fungal crude enzymes[J].Minerals Engineering,2019,138:86-94.
[12] BROOY S R L,LINGE H G,WALKER G S.Review of gold extraction from ores[J].Minerals Engineering,1994,7(10):1 213-1 241.
[13] LIU B L,ZHANG Z H,LI L B,et al.Recovery of gold and iron from the cyanide tailings by magnetic roasting[J].Rare Metal Materials and Engineering,2013,42(9):1 805-1 809.
[14] LIU X L,LI Q,ZHANG Y,et al.Improving gold recovery from a refractory ore via Na2SO4 assisted roasting and alkaline Na2S leach-ing[J].Hydrometallurgy,2019,185:133-141.
[15] LI H Y,ZHANG L B,KOPPALA S,et al.Extraction of gold and silver in the selective chlorination roasting process of cyanidation tailing[J].Separation Science and Technology,2018,53(3):458-466.
[16] HE Y,HU X Z,ZI F T,et al.Solidification of sulfur and arsenic in gold concentrate and leaching of the gold by thiosulfate[J].Asia-Pacific Journal of Chemical Engineering,2020,15(1):1-14.
[17] AMANKWAH R K,OFORI-SARPONG G.Microwave roasting of flash flotation concentrate containing pyrite,arsenopyrite and carbonaceous matter[J].Minerals Engineering,2020,151:1-5.
[18] AMAYA I,BERNAL D,GARNICA S,et al.Improved roasting of some colombian gold ores[J].Dyna,2013,80(178):70-77.
[19] HAQUE K E.Microwave energy for mineral treatment processes—A brief review[J].International Journal of Mineral Processing,1999,57(1):1-24.
[20] LI Q C,LI D X,QIAN F J.Pre-oxidation of high-sulfur and high-arsenic refractory gold concentrate by ozone and ferric ions in acidic media[J].Hydrometallurgy,2009,97(1/2):61-66.
[21] COWAN D H,JAHROMI F G,GHAHREMAN A.Atmospheric oxidation of pyrite with a novel catalyst and ultra-high elemental sulphur yield[J].Hydrometallurgy,2017,173:156-169.
[22] MA J,TANG Y,YANG D Q,et al.Kinetics of advanced oxidative leaching of pyrite in a potassium peroxy-disulphate solution[J].The Journal of the Southern African Institute of Mining and Metallurgy,2020,120(2):165-172.
[23] WANG J,WANG W,BAI Y L,et al.Study on pre-oxidation of a high-arsenic and high-sulfur refractory gold concentrate with potassium permanganate and hydrogen peroxide[J].Transactions of the Indian Institute of Metals,2020,73(3):577-586.
[24] FU L K,ZHANG L B,WANG S X,et al.Synergistic extraction of gold from the refractory gold ore via ultrasound and chlorination-oxidation[J].Ultrasonics Sonochemistry,2017,37:471-477.
[25] BEATTIE M J V,RAUDSEPP R,ISMAY A.Arseno/redox process for refractory gold ores[C]∥DOBBY G S,RAO S R.Processing of complex ores.Oxford:Pergamon Press,1989:431-439.
[26] DONG Z Z,ZHU Y M,HAN Y X,et al.Study of pyrite oxidation with chlorine dioxide under mild conditions[J].Minerals Engineering,2019,133:106-114.
[27] DONG Z Z,ZHU Y M,HAN Y X,et al.Chemical oxidation of arseno-pyrite using a novel oxidant—Chlorine dioxide[J].Minerals Engineering,2019,139:1-10.
[28] FLEMING C A.Basic iron sulfate—A potential killer in the processing of refractory gold concentrates by pressure oxidation[J].Minerals & Metallurgical Processing,2010,27(2):81-88.
[29] GUO Y J,GUO X,WU H Y,et al.A novel bio-oxidation and two-step thiourea leaching method applied to a refractory gold concentrate[J].Hydrometallurgy,2017,171:213-221.
[30] VERA M,SCHIPPERS A,SAND W.Progress in bioleaching:fundamentals and mechanisms of bacterial metal sulfide oxidation—Part A[J].Applied Microbiology and Biotechnology,2013,97(17):7 529-7 541.
[31] PURNOMO I,CHAERUN S K,MUBAROK M Z.Biooxidation pretreatment of low grade refractory gold tailings using a sulfur-oxidizing mixotrophic bacterium[C]∥2nd mineral processing and technology international conference.Bristol:Iop Publishing Ltd,2019.
[32] SONG Y,YANG H Y,CHEN G M,et al.Application of microwave for promoting biooxidation of refractory high-sulphide concentrates:influencing factors analysis[J].Canadian Metallurgical Quarterly,2020,59(2):233-241.
[33] MIKHLIN Y L,ROMANCHENKO A S,ASANOV I P.Oxidation of arsenopyrite and deposition of gold on the oxidized surfaces:a scanning probe microscopy,tunneling spectroscopy and xps study[J].Geochimica et Cosmochimica Acta,2006,70(19):4 874-4 888.
[34] FOMCHENKO N V,MURAVYOV M I.Thermodynamic and XRD analysis of arsenopyrite biooxidation and enhancement of oxidation efficiency of gold-bearing concentrates[J].International Journal of Mineral Processing,2014,133:112-118.
[35] ZHANG D R,XIA J L,NIE Z Y,et al.Mechanism by which ferric iron promotes the bioleaching of arsenopyrite by the moderate thermophile Sulfobacillus thermosulfidooxidans[J].Process Biochemistry,2019,81:11-21.
[36] SITANDO O,SENANAYAKE G,DAI X,et al.The adsorption of gold(I)on minerals and activated carbon(preg-robbing)in non-ammoniacal thiosulfate solutions-effect of calcium thiosulfate,silver(I),copper(I)and polythionate ions[J].Hydrometallurgy,2019,184:206-217.
[37] KULPA C F,BRIERLEY J A.Microbial deactivation of preg-robbing carbon in gold ore[M].Warrendale:Minerals,Metals & Materials Soc,1993.
[38] LI J F,TONG L L,XIA Y,et al.Microbial synergy and stoichiometry in heap biooxidation of low-grade porphyry arsenic-bearing gold ore[J].Extremophiles,2020,24(3):355-364.
[39] YEN W T,AMANKWAH R K,CHOI Y.Microbial pre-treatment of double refractory gold ores:US2009/0158893A1[P].2009-06-25.
[40] AMANKWAH R K,YEN W T,RAMSAY J A.A two-stage bacterial pretreatment process for double refractory gold ores[J].Minerals Engineering,2005,18(1):103-108.
[41] ZHENG Y,WEI D Z,LIU W G,et al.One novel two-step bio-oxidation pretreatment of arsenic-containing gold-bearing concentrate[J].International Journal of Electrochemical Science,2018,13(6):5 983-5 994.
[42] DE CARVALHO L C,DA SILVA S R,GIARDINI R M N,et al.Bio-oxidation of refractory gold ores containing stibnite and gudmundite[J].Environmental Technology & Innovation,2019,15:1-11.
[43] MAHLANGU T,SUMAILI F A,AYIZI D N,et al.Kibali gold mine sulphide concentrate treatment-understanding the preoxidation of sulphide concentrates[J].Mineral Processing and Extractive Metallurgy(Transactions of the Institutions of Mining and Metallurgy),2020,129(1):74-86.
[44] 克雷諾娃,崔洪山,林森.采用磁脉冲预处理强化从矿石和精矿中回收金的过程[J].国外金属矿选矿,2007(12):24-25.
[45] LI J S,MILLER J D.A review of gold leaching in acid thiourea solutions[J].Mineral Processing and Extractive Metallurgy Review,2006,27(3):177-214.
[46] WANG Q,HU X Z,ZI F T,et al.Environmentally friendly extraction of gold from refractory concentrate using a copper-ethylenediamine-thiosulfate solution[J].Journal of Cleaner Production,2019,214:860-872.
[47] SOUSA R,FUTURO A,FIUZA A,et al.Bromine leaching as an alternative method for gold dissolution[J].Minerals Engineering,2018,118:16-23.
[48] AHTIAINEN R,LUNDSTROM M.Cyanide-free gold leaching in exceptionally mild chloride solutions[J].Journal of Cleaner Production,2019,234:9-17.
[49] KONYRATBEKOVA S S,BAIKONUROVA A,AKCIL A.Non-cyanide leaching processes in gold hydrometallurgy and iodine-iodide applications:a review[J].Mineral Processing and Extractive Metallurgy Review,2015,36(3):198-212.
[50] PEREA C G,RESTREPO O J.Use of amino acids for gold dissolution[J].Hydrometallurgy,2018,177:79-85.
[51] WEN Q J,WU Y F,WANG X,et al.Researches on preparation and properties of sodium polysulphide as gold leaching agent[J].Hydrometallurgy,2017,171:77-85.
[52] GOULD W D,KING M,MOHAPATRA B R,et al.A critical review on destruction of thiocyanate in mining effluents[J].Minerals Engineering,2012,34:38-47.
[53] YANNOPOULOS J C.Cyanidation of gold ores[M].New York:Springer,1991.
[54] ANDERSON C G.Alkaline sulfide gold leaching kinetics[J].Minerals Engineering,2016,92:248-256.
[55] MUIR D M.A review of the selective leaching of gold from oxidised copper-gold ores with ammonia-cyanide and new insights for plant control and operation[J].Minerals Engineering,2011,24(6):576-582.
[56] KHODADAD A,TEIMOURY P,ABDOLAHI M,et al.Detoxification of cyanide in a gold processing plant tailings water using calcium and sodium hypochlorite[J].Mine Water and the Environment,2008,27(1):52-55.
[57] SUN C B,ZHANG X L,KOU J,et al.A review of gold extraction using noncyanide lixiviants:fundamentals,advancements,and challenges toward alkaline sulfur-containing leaching agents[J].International Journal of Minerals Metallurgy and Materials,2020,27(4):417-431.
[58] KUYUCAK N,AKCIL A.Cyanide and removal options from effluents in gold mining and metallurgical processes[J].Minerals Engineering,2013,50/51:13-29.
[59] DESCHNES G,WALLINGFORD G.Effect of oxygen and lead nitrate on the cyanidation of a sulphide bearing gold ore[J].Minerals Engineering,1995,8(8):923-931.
[60] ADAMS M D.The chemical behavior of cyanide in the extraction of gold.2.Mechanisms of cyanide loss in the carbon-in-pulp process[J].Journal of the South African Institute of Mining and Metallurgy,1990,90(3):67-73.
[61] DE ANDRADE LIMA L R P,HODOUIN D.Simulation study of the optimal distribution of cyanide in a gold leaching circuit[J].Minerals Engineering,2006,19(13):1 319-1 327.
[62] ADAMS M D.A methodology for determining the deportment of cyanide losses in gold plants[J].Minerals Engineering,2001,14(4):383-390.
[63] LOTZ P W,VAN RENSBURG S J,SWARTS A.Kinetic gold leach monitoring including cyanide speciation[J].Journal of the South African Institute of Mining and Metallurgy,2009,109(10):635-639.
[64] DAI X W,SIMONS A,BREUER P.A review of copper cyanide recovery technologies for the cyanidation of copper containing gold ores[J].Minerals Engineering,2012,25(1):1-13.
[65] GAPAR V,MEJEROVICH A S,MERETUKOV M A,et al.Practical application of potential-pH diagrams for Au-CS(NH2)2-H2O and Ag-CS(NH2)2-H2O systems for leaching gold and silver with acidic thiourea solution[J].Hydrometallurgy,1994,34(3):369-381.
[66] LABROOY S R,LINGE H G,WALKER G S.Review of gold extraction from ores[J].Minerals Engineering,1994,7(10):1 213-1 241.
[67] LACOSTE-BOUCHET P,DESCHNES G,GHALI E.Thiourea leach-ing of a copper-gold ore using statistical design[J].Hydrometallurgy,1998,47(2/3):189-203.
[68] OLYAEI Y,NOPARAST M,TONKABONI S Z S,et al.Response of low-grade gold ore to cyanidation and thiourea leaching[J].Particulate Science and Technology,2019,37(1):86-93.
[69] LI J S,MILLER J D.Reaction kinetics of gold dissolution in acid thiourea solution using ferric sulfate as oxidant[J].Hydrometallurgy, 2007,89(3/4):279-288.
[70] GNEN N,KRPE E,YILDIRIM M E,et al.Leaching and CIL pro-cesses in gold recovery from refractory ore with thiourea solutions[J].Minerals Engineering,2007,20(6):559-565.
[71] UBALDINI S,FORNARI P,MASSIDDA R,et al.An innovative thio-urea gold leaching process[J].Hydrometallurgy,1998,48(1):113-124.
[72] ZHENG S,WANG Y Y,CHAI L Y.Research status and prospect of gold leaching in alkaline thiourea solution[J].Minerals Engineering,2006,19(13):1 301-1 306.
[73] ZHOU H,SONG Y S,LI W J,et al.Electrochemical behavior of gold and its associated minerals in alkaline thiourea solutions[J].International Journal of Minerals Metallurgy and Materials,2018,25(7):737-743.
[74] LI L F,ZHU Z S,LIU Y C,et al.Optimisation of efficient auxiliary agents of gold leaching in an alkaline thiourea solution for a finely disseminated gold ore[J].International Journal of Mining and Mineral Engineering,2014,5(4):315-327.
[75] 鄭粟,王云燕,柴立元.基于配位理论的碱性硫脲选择性溶金机理[J].中国有色金属学报,2005,15(10):1 629-1 635.
[76] CHAI L Y,OKIDO M.Dissolution theory of gold in alkaline thio-urea solution(Ⅱ)electrochemical study on Au-Fe mix anode in alkaline thiourea solution containing Na2SO3[J].Transactions of Nonferrous Metals Society of China,1999,9(2):393-398.
[77] ZHENG S,WANG Y Y,CHAI L Y.Research status and prospect of gold leaching in alkaline thiourea solution[J].Minerals Engineering,2006,19(13):1 301-1 306.
[78] ZHANG C F,CHAI L Y,ZHONG H Y,et al.Selective dissolution of gold in an alkaline thiourea solution by electrolysis[J].Journal of Central South University of Technology,1997,4:73-78.
[79] CHANDRA I,JEFFREY M I.An electrochemical study of the effect of additives and electrolyte on the dissolution of gold in thiosulfate solutions[J].Hydrometallurgy,2004,73(3/4):305-312.
[80] LIU X L,XU B,YANG Y B,et al.Thermodynamic analysis of ammoniacal thiosulphate leaching of gold catalysed by Co(Ⅲ)/Co(Ⅱ)using Eh-pH and speciation diagrams[J].Hydrometallurgy,2018,178:240-249.
[81] JEFFREY M I.Kinetic aspects of gold and silver leaching in ammonia-thiosulfate solutions[J].Hydrometallurgy,2001,60(1):7-16.
[82] ZHAO H F,YANG H Y,CHEN X,et al.Effect of triethanolamine as a new and efficient additive on thiosulfate-copper-ammonia system leaching of gold[J].JOM,2020,72(2):946-952.
[83] CHEN J,JIANG T,XU S.Electrochemistry of gold leaching with thiosulfate.li.Cathodic behaviour and leaching mechanism of gold[C]∥Proceedings of the XVIII International Mineral Processing Congress.Sydney:Australasian Institute of Mining and Metallurgy,1993:23-28.
[84] WANG J,XIE F,WANG W,et al.Eco-friendly leaching of gold from a carbonaceous gold concentrate in copper-citrate-thiosulfate solutions[J].Hydrometallurgy,2020,191:1-12.
[85] ZHANG S C,NICOL M J.An electrochemical study of the dissolution of gold in thiosulfate solutions Part I:alkaline solutions[J].Journal of Applied Electrochemistry,2003,33(9):767-775.
[86] JI J,FLEMING C,WEST-SELLS P G,et al.A novel thiosulfate system for leaching gold without the use of copper and ammonia[C]∥Proceedings of hydrometallurgy international symposium.Pittsburgh:TMS,2003:227-244.
[87] XU B,LI K,LI Q,et al.Kinetic studies of gold leaching from a gold concentrate calcine by thiosulfate with cobalt-ammonia catalysis and gold recovery by resin adsorption from its pregnant solution[J].Separation and Purification Technology,2019,213:368-377.
[88] XU B,LI K,DONG Z L,et al.Eco-friendly and economical gold extraction by nickel catalyzed ammoniacal thiosulfate leaching-resin adsorption recovery[J].Journal of Cleaner Production,2019,233:1 475-1 485.
[89] HEATH J A,JEFFREY M I,ZHANG H G,et al.Anaerobic thiosulfate leaching:development of in situ gold leaching systems[J].Minerals Engineering,2008,21(6):424-433.
[90] ARIMA H,FUJITA T,YEN W T.Using nickel as a catalyst in ammonium thiosulfate leaching for gold extraction[J].Materials Transactions,2004,45(2):516-526.
[91] YU H,ZI F,HU X,et al.The copper-ethanediamine-thiosulphate leaching of gold ore containing limonite with cetyltrimethyl ammonium bromide as the synergist[J].Hydrometallurgy,2014,150:178-183.
[92] FENG D,VAN DEVENTER J S J.The role of amino acids in the thiosulphate leaching of gold[J].Minerals Engineering,2011,24(9):1 022-1 024.
[93] XIA C,YEN W T,DESCHENES G.Improvement of thiosulfate stability in gold leaching[J].Mining Metallurgy & Exploration,2003,20:68-72.
[94] FENG D,VAN DEVENTER J S J.Thiosulphate leaching of gold in the presence of ethylene diamine tetraacetic acid(EDTA)[J].Minerals Engineering,2010,23(2):143-150.
[95] XU B,YANG Y B,LI Q,et al.Effect of common associated sulfide minerals on thiosulfate leaching of gold and the role of humic acid additive[J].Hydrometallurgy,2017,171:44-52.
[96] LIU X L,XU B,MIN X,et al.Effect of pyrite on thiosulfate leach-ing of gold and the role of ammonium alcohol polyvinyl phosphate(AAPP)[J].Metals,2017,7(7):1-17.
[97] SENANAYAKE G,ZHANG X M.Gold leaching by copper(Ⅱ)in ammoniacal thiosulphate solutions in the presence of additives.Part Ⅱ:effect of residual Cu(Ⅱ),pH and redox potentials on reactivity of colloidal gold[J].Hydrometallurgy,2012,115/116:21-29.
[98] JEFFREY M,ANDERSON C.A fundamental study of the alkaline sulfide leaching of gold[J].The European Journal of Mineral Processing and Environmental Protection,2003,3(3):336-343.
[99] SITANDO O,SENANAYAKE G,DAI X,et al.A review of factors affecting gold leaching in non-ammoniacal thiosulfate solutions including degradation and in-situ generation of thiosulfate[J].Hydrometallurgy,2018,178:151-175.
[100] HILSON G,MONHEMIUS A J.Alternatives to cyanide in the gold mining industry:what prospects for the future?[J].Journal of Cleaner Production,2006,14(12/13):1 158-1 167.
[101] BAGHALHA M.Leaching of an oxide gold ore with chloride/hypochlorite solutions[J].International Journal of Mineral Processing,2007,82(4):178-186.
[102] CHANDRA A P,GERSON A R.The mechanisms of pyrite oxidation and leaching:a fundamental perspective[J].Surface Science Reports,2010,65(9):293-315.
[103] CORKHILL C L,VAUGHAN D J.Arsenopyrite oxidation—A review[J].Applied Geochemistry,2009,24(12):2 342-2 361.
[104] TRAN T,LEE K,FERNANDO K.Halide as an alternative lixiviant for gold processing—An update[M].Warrendale:Minerals,Metals & Materials Soc,2001.
[105] LIANG C J,LI J Y.Recovery of gold in iodine-iodide system—A review[J].Separation Science and Technology,2019,54(6):1 055-1 066.
[106] QI P H,HISKEY J B.Dissolution kinetics of gold in iodide solutions[J].Hydrometallurgy,1991,27(1):47-62.
[107] LI J S,SAFARZADEH M S,MOATS M S,et al.Thiocyanate hydrometallurgy for the recovery of gold.PartⅠ:chemical and thermodynamic considerations[J].Hydrometallurgy,2012,113/114:1-9.
[108] KHOLMOGOROV A G,KONONOVA O N,PASHKOV G L,et al.Thiocyanate solutions in gold technology[J].Hydrometallurgy,2002,64(1):43-48.
[109] MONHEMIUS A J,BALL S P.Leaching of dominican gold ores in iodide-catalyzed thiocyanate solutions[J].Mineral Processing and Extractive Metallurgy(IMM Transactions section C),1995,104:117-124.
[110] LI J S,SAFARZADEH M S,MOATS M S,et al.Thiocyanate hydrometallurgy for the recovery of gold.Part Ⅲ:thiocyanate stability[J].Hydrometallurgy,2012,113/114:19-24.
[111] LI J S,SAFARZADEH M S,MOATS M S,et al.Thiocyanate hydrometallurgy for the recovery of gold.Part Ⅳ:solvent extraction of gold with alamine 336[J].Hydrometallurgy,2012,113/114:25-30.
[112] LI J S,SAFARZADEH M S,MOATS M S,et al.Thiocyanate hydrometallurgy for the recovery of gold.Part V:process alternatives for solution concentration and purification[J].Hydrometallurgy,2012,113/114:31-38.
[113] LI J S,SAFARZADEH M S,MOATS M S,et al.Thiocyanate hydrometallurgy for the recovery of gold.Part Ⅱ:the leaching kinetics[J].Hydrometallurgy,2012,113/114:10-18.
[114] AZADI M R,KARRECH A,ATTAR M,et al.Data analysis and estimation of thermodynamic properties of aqueous monovalent metal-glycinate complexes[J].Fluid Phase Equilibria,2019,480:25-40.
[115] EKSTEEN J J,ORABY E A,TANDA B C,et al.Towards industrial implementation of glycine-based leach and adsorption technologies for gold-copper ores[J].Canadian Metallurgical Quarterly,2018,57(4):390-398.
[116] ORABYA E A,EKSTEEN J J,KARRECH A,et al.Gold extraction from paleochannel ores using an aerated alkaline glycine lixiviant for consideration in heap and in-situ leaching applications[J].Minerals Engineering,2019,138:112-118.
[117] EKSTEEN J J,ORABY E A.The leaching and adsorption of gold using low concentration amino acids and hydrogen peroxide:effect of catalytic ions,sulphide minerals and amino acid type[J].Minerals Engineering,2015,70:36-42.
[118] ORABY E A,EKSTEEN J J.The leaching of gold,silver and their alloys in alkaline glycine-peroxide solutions and their adsorption on carbon[J].Hydrometallurgy,2015,152:199-203.
[119] ORABY E A,EKSTEEN J J.Gold leaching in cyanide-starved copper solutions in the presence of glycine[J].Hydrometallurgy,2015,156:81-88.
[120] WU H,FENG Y L,HUANG W F,et al.The role of glycine in the ammonium thiocyanate leaching of gold[J].Hydrometallurgy,2019,185:111-116.
[121] BROWN D H,SMITH W E,FOX P,et al.The reactions of gold(0)with amino acids and the significance of these reactions in the biochemistry of gold[J].Inorganica Chimica Acta(Bioinorganic Chemistry),1982,67:27-30.
[122] SPARROW G J,WOODCOCK J T.Cyanide and other lixiviant leaching systems for gold with some practical applications[J].Mineral Processing and Extractive Metallurgy Review,1995,14(3/4):193-247.
[123] UDUPA A R,KAWATRA S K,PRASAD M S.Developments in gold leaching:a literature survey[J].Mineral Processing and Extractive Metallurgy Review,1990,7(2):115-135.
[124] LI J Y,HUANG L.The leaching gold and silver from E-waste by LSSS method[C]∥2010 4th International Conference on Bioinformatics and Biomedical Engineering.Chengdu:Sichun University,2010.
[125] CHEN R,HOU Y N,ZHAO Y M,et al.Study on the properties and gold leaching kinetics of a new organic leaching agent[C]∥2018 international conference of green buildings and environmental management.Bristol:Iop Publishing Ltd,2018.
[126] BIRICH A,STOPIC S,FRIEDRICH B.Kinetic investigation and dissolution behavior of cyanide alternative gold leaching reagents[J].Scientific Reports,2019,9:1-10.
[127] LI J S,MILLER J D.Reaction kinetics of gold dissolution in acid thiourea solution using ferric sulfate as oxidant[J].Hydrometallurgy,2007,89(3/4):279-288.
[128] BAGHALHA M.The leaching kinetics of an oxide gold ore with iodide/iodine solutions[J].Hydrometallurgy,2012,113/114:42-50.
[129] KORTE F,COULSTON F.From single-substance evaluation to eco-logical process concept:the dilemma of processing gold with cyanide[J].Ecotoxicology and Environmental Safety,1995,32(1):96-101.
[130] ALP I,CELEP O,PAKTUNC D,et al.Influence of potassium hydroxide pretreatment on the extraction of gold and silver from a refractory ore[J].Hydrometallurgy,2014,146:64-71.
[131] HASAB M G,RASHCHI F,RAYGAN S.Simultaneous sulfide oxidation and gold leaching of a refractory gold concentrate by chloride-hypochlorite solution[J].Minerals Engineering,2013,50/51:140-142.
[132] GUDYANGA F P,MAHLANGU T,ROMAN R J,et al.An acidic pressure oxidation pre-treatment of refractory gold concentrates from the KweKwe roasting plant,Zimbabwe[J].Minerals Engineering,1999,12(8):863-875.
[133] MUBAROK M Z,WINARKO R,CHAERUN S K,et al.Improving gold recovery from refractory gold ores through biooxidation using iron-sulfur-oxidizing/sulfur-oxidizing mixotrophic bacteria[J].Hydrometallurgy,2017,168:69-75.
[134] ASAMOAH R K,SKINNER W,ADDAI-MENSAH J.Leaching behaviour of mechano-chemically activated bio-oxidised refractory flotation gold concentrates[J].Powder Technology,2018,331:258-269.
[135] GONZLEZ-ANAYA J A,NAVA-ALONSO F,PECINA-TREVI O E T.Gold recovery optimization of a refractory concentrate by ultrafine grinding—A laboratory study[J].Minerals & Metallurgical Processing,2011,28(2):94-101.
[136] WANG X,QIN W Q,JIAO F,et al.Mineralogy and pretreatment of a refractory gold deposit in zambia[J].Minerals,2019,9(7):1-16.
Gold extraction technology for gold ores and its research progress
Li Qian,Dong Siyu,Xu Rui,Yang Yongbin,Xu Bin,Jiang Tao
(School of Minerals Processing and Bioengineering,Central South University)
Abstract:Extracting gold from refractory gold ores is an inevitable trend in the development of the gold industry.However,how to recover gold from refractory gold ores in a green and efficient manner is one of the technical challenges currently.Therefore,the characteristics of refractory gold ores were summarized,the pretreatment technology for refractory gold ores and their current research status were reviewed,the research progress of the leaching processes was evaluated,and the features and reaction mechanisms of each method were analyzed as well as their benefits and limitations.In the meantime,the outlook is that the reasonable allocation of pretreatment technology and leaching method should be the development trend for green gold extraction from refractory ores.The research provides basis for further research and application of gold extraction technology.
Keywords:refractory gold ores;pretreatment technology;leaching method;green gold extraction;non-cyanide leaching
收稿日期:2020-05-28; 修回日期:2020-08-30
基金項目:国家重点研发计划项目(2018YFE0110200);国家自然科学基金项目(51574284);云南省科技计划项目(2018ZE001)
作者简介:李 骞(1975—),男,甘肃静宁人,教授,博士,研究方向为贵金属冶金及矿产资源综合利用;主持的重大科研项目有科技部国际合作项目“砷黄铁矿微生物分步氧化规律及多相界面反应的调控机制”(2018YFE0110200),云南省重大专项“铂族金属高效回收除杂关键技术及产业示范”(2018ZE001),湖南省地矿局专项“矿区周边重金属污染耕地微生物溶淋修复技术研究及应用”(201903),湖南省自然资源厅专项“典型有色矿区微生物-植物联合生态修复治理关键技术研究与应用”(2020-21);获得的重大奖项有教育部科技进步奖一等奖,湖南省创新团队一等奖,湖南省自然科学奖一等奖等;长沙市岳麓区麓山南路932号,中南大学资源加工与生物工程学院,410083;E-mail:csuliqian@126.com
*通信作者,E-mail:ruixu1923@csu.edu.cn,13608818911

