乙酰水杨酸应用于牙龈干细胞对免疫相关疾病的调节功能及机制研究
熊 璟,何元春,邱勇棋,刘 杰,张 英,李永强,庄 瑞,邓红豆
(汉中市中心医院口腔科,汉中 723000)
牙龈干细胞(mesenchymal stem cells derived from gingiva,GMSCs)来源于牙龈组织,具有自我更新、多向分化、免疫调节的功能。其在体外可以诱导T细胞凋亡,受到了广大学者的关注。同时GMSCs注射可以治疗小鼠炎症性肠炎[1-3],但尚处于初步研究阶段。广大学者积极探讨能够促进GMSCs免疫调节功能的治疗方法是一项有重要意义的研究。乙酰水杨酸(acetylsalicylic acid,ASA)是一种应用非常广泛的非甾体抗炎药,已经发现ASA可以增强脱落乳牙干细胞的免疫调节功能[4-5]。在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)疾病中,会出现自身反应性免疫细胞浸润渗透到中枢神经系统的现象,发生炎症性反应,破坏血脑屏障。本文将探究ASA应用于GMSCs对EAE的调节功能及其机制研究。
1 资料与方法
1.1 材料与试剂干细胞:经患者同意后,收集一例露龈笑患者手术切除的健康牙龈组织。
图1 受试者牙龈组织切除前后
实验动物:C57BL/6J小鼠购自成都达硕实验动物有限公司。
主要试剂:乙酰水杨酸(Sigma Aldrich,美国);胎牛血清(四季青);DMEM培养基(Gibico,美国);双抗(Hyclone公司);鼠抗人抗体(CD90-PE、CD-34PE、CD-45PE 、CD105-FITC、CD146-PE)(R&D,美国);细胞凋亡检测试剂盒(R&D,美国);MTT assay kit试剂盒(Thermo Scientific,美国);抗鼠抗体CD4(R&D,美国);分散酶Ⅱ和胶原酶Ⅰ(HyClone,美国);苏木精-伊红染色液(北京索莱宝);
主要仪器:显微镜(OLYMPUS,日本);流式细胞仪(BIOLEGEND,美国);多功能酶标仪(Thermo,美国);细胞计数板(实用医疗器材有限公司);细胞培养皿(Coming,美国);低温高速离心机(Eppendorf,美国);离心管、微量移液器等。
1.2 方法(1)GMSCs的分离培养[6]将收集的牙龈组织剪碎并消化,1小时后过筛,获得单细胞悬液,接种于培养皿并置于细胞培养箱中,24小时后换液。每隔2天换一次培养液,显微镜下观察,当细胞达到70%~80%融合时进行细胞传代培养。(2)流式细胞技术鉴定GMSCs表面抗原[6]选用第4代细胞,接种于培养皿,待融合度达到80%时,用胰酶消化获得细胞混悬液。PBS清洗2次,丢弃上清,PBS重悬细胞,计数,密度为1x106/ml。吸取混悬液于EP管中,分别加入CD34、CD45、CD90、CD105、CD146,室温避光孵育1小时。PBS清洗2次,丢弃上清,PBS重悬细胞,流式细胞仪进行检测。(3)GMSCs与 T 细胞共培养[6]取小鼠脾脏并将其进行组织研磨直至成为单细胞。抗CD3抗体铺板、抗CD28抗体培养2~3天,以激活T细胞。接种GMSCs 1×105/孔到12孔板,观察到细胞贴壁后,加入T细胞1×106/孔,使其在一起培养2~3天。收集细胞,流式分析技术检测T细胞凋亡,MTT实验方法检测细胞增殖。实验组用50mg /L ASA(根据查文献及预实验而选择剂量)进行药物干预作用24 h。(4)乙酰水杨酸对 GMSCs增殖能力的影响[6]接种 0.5×104GMSCs于96孔板,待细胞贴壁后,其中一孔板用50mg /L ASA进行药物干预作用24小时,而另一孔板GMSCs不作处理,待加入MTT后,37℃孵育4小时。用二甲基亚砜(DMSO)中和沉淀并测量光密度值。(5)乙酰水杨酸对GMSCs调节T细胞分化的影响[7]诱导T细胞向Treg细胞、Th17细胞分化,50mg /L ASA进行药物干预作用 24 小时。(6)制备小鼠 EAE 模型 参照 Yang RL[7]等方法造模,1周后实验组小鼠注射0.2×106GMSCs或ASA- GMSCs。4周后处死小鼠,收集脊髓标本,用4%福尔马林固定行苏木精-伊红(HE)染色,并用流式分析技术检测T细胞分化。
1.3 统计学分析用SPSS 19.0进行统计分析,实验所得数据用mean±SD表示,干细胞表面标志物表达及MTT细胞增殖采用双侧t检验法,其他实验结果采用单因素方差分析法,组间比较采用LSD法。以P<0.05判断差异有统计学意义。
2 结果
2.1 流式细胞分析结果结果显示GMSCs表面分子标记CD90、CD146和CD105阳性表达,CD34和CD45不表达,这和间充质来源干细胞表面抗原表达的特征 一致(图2)。

图2 流式细胞技术分析细胞表面抗原
2.2 T细胞的凋亡情况GMSCs和T细胞共培养中,流式细胞分析显示GMSCs诱导T细胞凋亡,ASA促进GMSCs诱导T细胞凋亡,MTT显示GMSCs在共培养中抑制T细胞增殖,ASA对GMSCs抑制T细胞增殖起到促进作用,提示ASA能够增强GMSCs免疫调节功能(图3)。
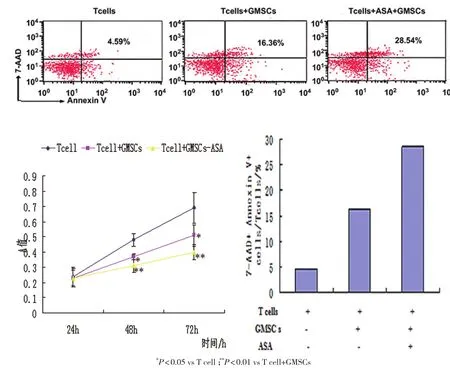
图3 ASA对GMSCs免疫功能的影响
2.3 MTT细胞实验结果显示,ASA可以显著提高GMSCs的细胞增殖率(图4)。
2.4 ASA对GMSCs体外调节T细胞分化的影响流式细胞分析结果显示,在GMSCs和T细胞共培养中,GMSCs促使了Treg分化,同时抑制了Th17细胞分化,ASA能够增强GMSCs对T细胞的调节分化作用(图5)。
2.5 HE结果结果显示,在EAE小鼠脊髓组织中可以观察到有炎症细胞浸润的现象,而注射GMSCs和ASA-GMSCs后均可以减少炎性浸润的严重性,ASAGMSCs注射组的减少程度更明显。EAE小鼠脾脏Th17细胞增高、Treg细胞减少,而GMSCs和ASA-GMSCs注射组均可以部分恢复Treg细胞和Th17细胞,GMSCs注射通过调节细胞免疫分化作用,对小鼠EAE具有治疗作用,ASA可以增强GMSCs治疗效果(图6A、B)
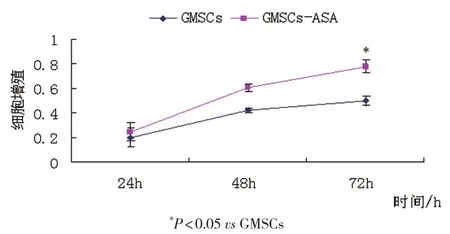
图4 ASA对GMSCs干细胞增殖的影响
3 讨论
GMSCs是从牙龈组织中分离出来的,是干细胞的一种,除了具有干细胞的生物学特性外,还具有组织愈合能力强和无瘢痕愈合的特点,可以向损伤部位和缺血组织归巢,对组织损伤修复具有重要作用[8-10]。并且研究发现从病变的牙龈组织中分离培养的GMSCs所具有的潜能和特点与从健康牙龈组织中分离培养得到的并没有明显差异[11]。GMSCs在组织工程与再生修复方面将发挥重要作用,具有良好的发展前景。
本研究成功分离出GMSCs,间充质干细胞表面标志物记CD90、CD146和CD105高表达,CD34和CD45不表达。在体外诱导环境下,GMSCs诱导T细胞凋亡、抑制T细胞增殖、调节T细胞分化,而ASA可以促进这一系列反应并增加GMSCs的细胞增殖。
MSCs具有生长稳定、增殖迅速、克隆形成的特性。MSCs可以诱导T细胞凋亡,促进Treg细胞生成,并抑制T细胞增殖,抑制激活的T细胞向其亚群Th17、 Th1、Th2分化,诱导免疫耐受[12],而细胞的分化是引起免疫反应疾病的病理基础。在某些自身免疫性及炎症反应疾病中,如EAE、肠炎,会发生T细胞分化失衡引起病理变化,需要通过调节T细胞分化,恢复炎性因子到原来水平,以发挥治疗作用[7]。GMSCs与MSCs相似,具有免疫调节的功能[4-5],在维持牙龈组织健康和恢复损伤组织中起着重要作用。

图5 ASA对GMSCs体外调节T细胞分化的影响

图6A HE染色显示EAE小鼠脊髓组织切片有明显炎性细胞浸润,GMSCs注射降低小鼠炎症细胞浸润,ASA-GMSCs注射治疗效果优于GMSCs。
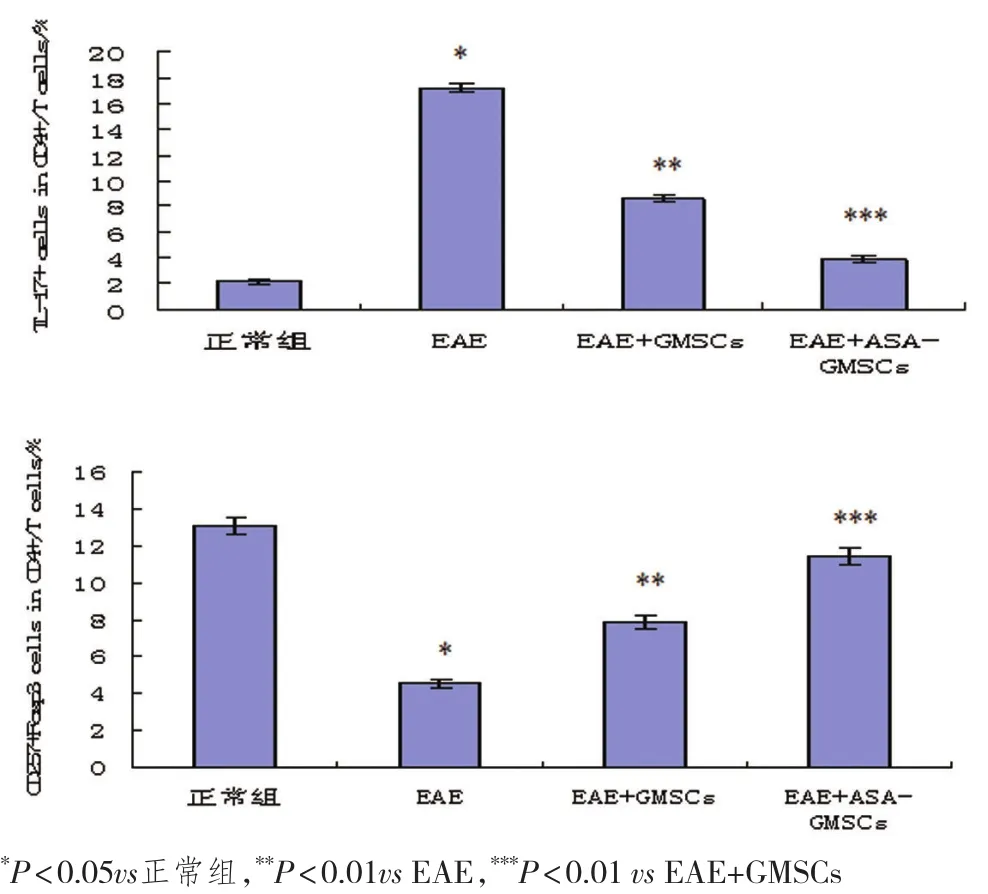
图6B 流式细胞仪分析显示相较于正常组小鼠,EAE小鼠脾脏Th17细胞升高、Treg细胞降低,而在注射GMSCs与ASA-GMSCs后均可以抑制Th17细胞升高和Treg细胞降低,并且注射ASA-GMSCs后抑制作用更明显。
阿司匹林是一种非甾体抗炎药,疗效稳定,可以调控细胞分化,其所含的乙酰水杨酸类物质可以抑制骨髓基质细胞的增殖分化[13-15],具有促进人牙髓间充质干细胞成骨分化的能力[16]。ASA可以提高GMSCs干细胞活性,提高GMSCs对小鼠肠炎的治疗效果,通过高表达FasL来提高其免疫调节能力[6]。在本实验中,在体内EAE小鼠模型中,注射MSCs与ASA-MSCs均可以改善小鼠的脊髓病理损伤,同时调节T细胞分化,促使其向Treg细胞分化并且抑制其向Th17细胞分化,通过此机理来调控炎症反应发挥免疫调节作用。相较于MSCs来说,ASA-MSCs发挥改善的作用更加明显。提示ASA-MSCs注射是治疗EAE的一种有效方法。
通过本实验研究发现ASA可以提高GMSCs的细胞增殖增强其表达,可以推测ASA-MSCs具有免疫调节的功能,通过增强MSCs诱导T细胞凋亡、抑制T细胞增殖、调节T细胞分化的能力来实现,并改善小鼠EAE的严重程度。ASA可能是一种提高MSCs治疗免疫疾病的药物,其机制需要进一步研究探索。牙源性干细胞是组织工程研究中具有广阔应用前景的干细胞之一,乙酰水杨酸是应用较为广泛的非甾体抗炎药,将两者结合,可以更有效的发挥治疗作用。

