外源钙对盐胁迫下荷花生理特性的影响
刘艺平, 苏少文, 张琳, 黄志远, 刘莹, 贺丹, 孔德政
(河南农业大学林学院,河南 郑州 450002)
盐渍化是一个全球性的社会和经济问题[1]。中国现有不同程度的盐碱地面积约占全球盐碱地总面积的10%[2-3],且盐碱地面积仍呈逐年增加的趋势[4]。因而,潜在的土地资源即盐渍化土地受到重视。在盐渍化土壤中种植具有一定耐盐性、经济价值和观赏价值的植物,不仅可有效地利用土地资源,而且可以改善其生态环境。因此,探讨植物抗盐的生理机制对扩大盐碱地植物种植面积和改善生态环境具有重要的理论意义和应用价值。研究表明,外源钙添加能够提高植物对干旱、盐分和重金属的多种抗性[5-8],从而缓解逆境胁迫对抗氧化酶和渗透调节系统的伤害和植株生长的抑制[6-7]。韩冰等[6]研究了钙对盐胁迫下黄瓜幼苗抗氧化系统的影响,发现外源钙离子可以有效提高黄瓜幼苗的可溶性蛋白含量和CAT、POD抗氧化酶活性,并使之维持在较高的水平。荷花(Nelumbonucifera)隶属于睡莲科莲属,是中国的传统名花和重要的水生植物之一,具有极高的观赏价值和经济价值[9]。荷花因其花色艳丽、花型丰富、气味芳香,而受到众人喜爱,被广泛应用于园林造景之中[10]。随着土壤盐分浓度的增加,其栽培与生产已受到影响,普通的荷花品种对盐胁迫更为敏感。目前关于荷花耐盐性研究报道主要集中在盐胁迫[11-12]、耐盐相关基因[12-14]和外源钙对荷花幼苗盐胁迫缓解效应[15-16]等方面,但研究中涉及的品种是以藕莲为主[15-16],关于观赏莲耐盐性研究报道较少。本试验通过添加外源CaCl2,初步探讨外源CaCl2对盐胁迫下荷花生长生理的影响,为利用添加外源物质方法减轻盐胁迫伤害提供科学依据及在生产上的应用奠定理论基础。
1 材料与方法
1.1 试验材料
供试材料由河南驻马店荷花培植研究会(郑州基地)提供,品种为‘凤舞’‘粉美人’‘红楼’‘鲜娇’‘春红’和‘水晶粉七号’等生长健壮、形态基本一致 (高度约为53 cm) 的荷花,定植于直径为50 cm,高40 cm的橡胶花盆中,单株定植。试验在河南省优质花卉蔬菜种菌工程研究中心露天苗圃地中进行,平均温度为32 ℃。试验期间不另施肥,雨天将荷花移到室内,并观测荷花叶片形态特征变化。
1.2 试验处理
选取生长健壮均匀的植株,待长出3~5片叶时,先进行NaCl处理,设置5个处理,每个处理重复3次,共75株,处理7 d后测量株高和盐害指数。NaCl处理后筛选出盐抗性品种与盐敏感品种,再选取生长健壮均匀的植株,待长出3~5片叶时,进行外源钙处理(6个处理),每个处理重复3次,共36株。处理7和14 d后采集荷花植株叶片,实验室剪样,液氮冷冻,储存在-80 ℃冰箱中备用。
1.3 测定指标与方法
1.3.1 盐害指数的测定 采用盐害级别判定标准[17-18]进行耐盐性评价。对全部植株进行观察统计, 计算植株各处理的盐害指数。盐害分级标准为一级:生长正常,无明显盐害症状;二级:轻度盐害,少数叶片尖缘枯焦或黄化;三级:中度盐害,1/2叶片尖缘枯焦黄化或少量叶片脱落失水萎蔫;四级:重度盐害,大部分叶片枯焦,1/2左右叶片脱落;五级:极重度盐害,多数叶片脱落,枝条枯死,植株濒临死亡。盐害指数计算公式如下:
盐害指数/%=[∑(盐害级值×相应盐害级值株数)/(总株数×盐害最高级值)]×100。

表1 不同浓度的NaCl处理Table 1 Different concentrations of NaCl treatment mmol·L-1
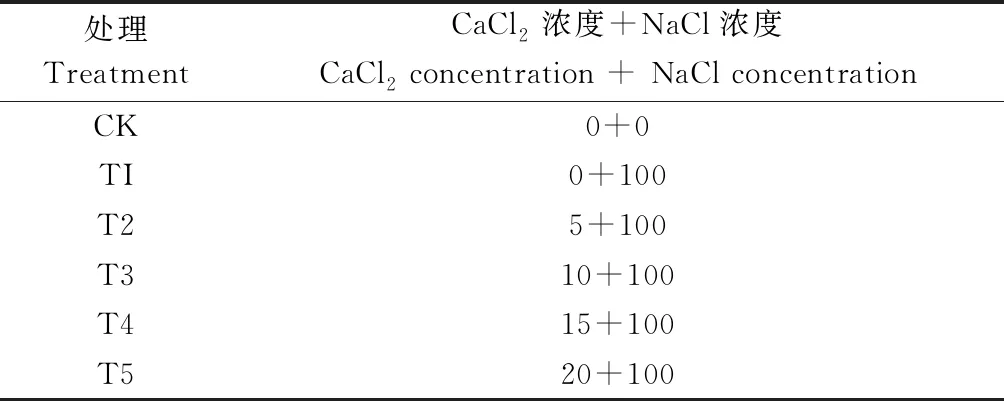
表2 盐胁迫下不同浓度的CaCl2处理Table 2 Treatment of different concentrations of CaCl2 under salt stress mmol·L-1
1.3.2 生长生理指标的测定 用尺子测量植株的株高,重复测量3次,取其平均值;净高生长量计算公式如下:净高生长量=NaCl处理7 d后平均株高-原始平均株高;POD活性采用愈创木酚法测定[19],CAT活性采用紫外吸收法测定[19],SOD 活性采用氮蓝四唑(NBT)法测定[19],可溶性蛋白含量采用考马斯亮蓝G-250法测定[19],可溶性糖含量采用蒽酮比色法测定[19]。
1.4 数据统计
数据采用Excel进行初步分析,并使用SPSS19.0进行方差分析,分析其差异显著性,使用Excel和OriginPro 8绘制各项指标变化图。
2 结果与分析
2.1 NaCl胁迫对荷花株高的影响
盐胁迫对植物的伤害作用中最明显的就是抑制植物的生长。由表3可看出,所有荷花品种在没有NaCl处理下,7 d后净高生长量的范围为12.0~15.6 cm。其中‘水晶粉七号’的净高生长量最大,达到15.6 cm;‘粉美人’的净高生长量最小,达到12.0 cm。在NaCl浓度从0升高至100 mmol·L-1时,所有品种的净高生长量平缓下降,在NaCl浓度为100 mmol·L-1时,净高生长为5.7~10.9 cm。当NaCl浓度为150 mmol·L-1时,所有品种净高生长量均大幅下降,‘粉美人’的净高生长量下降最为显著,与对照组相比下降82.50 %。当NaCl浓度为200 mmol·L-1时,所有品种的净高生长量范围仅为1.3~3.3 cm,此时‘粉美人’的净高生长量最小,仅为1.3 cm,植株基本不生长。这些数据表明150和200 mmol·L-1NaCl处理对荷花的生长有明显的抑制作用,荷花净高生长量最小甚至停止生长,说明此浓度下对荷花的危害很大。
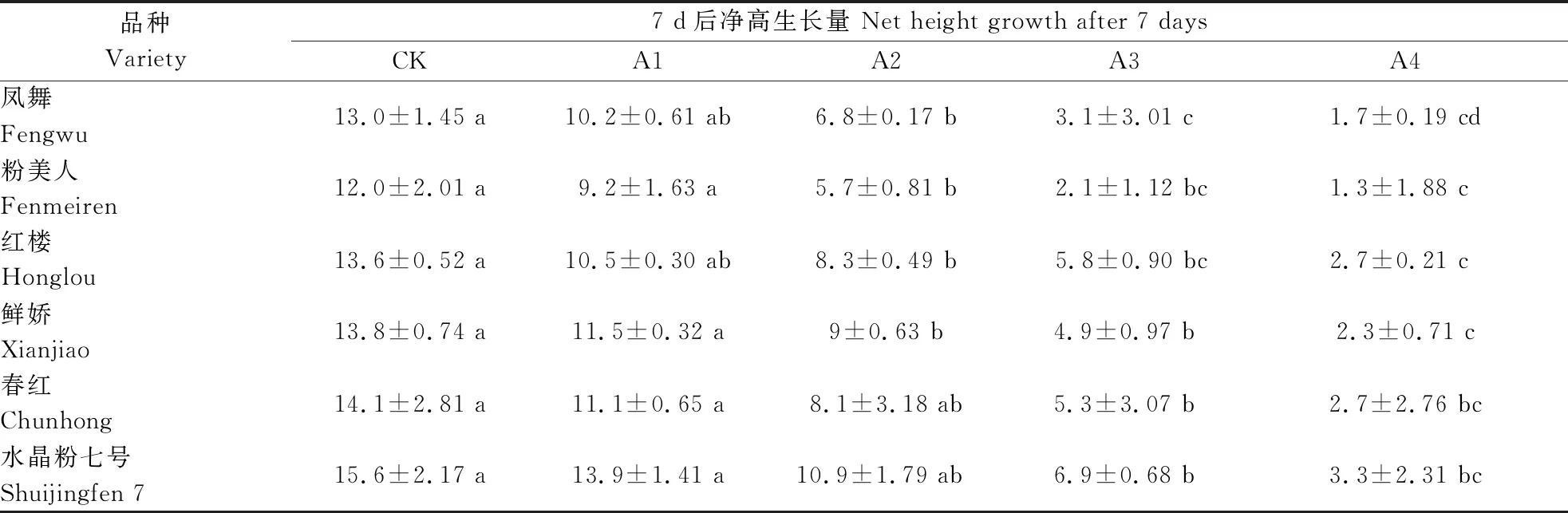
表3 NaCl胁迫对荷花净高生长量的影响
采用盐害级别判定标准[18-19]对荷花植株的耐盐性进行评价。在NaCl处理试验中,对全部植株外观特征进行观察统计, 并计算植株各处理的盐害指数。由表4可看出,综合盐害指数平均值来看,各品种耐盐能力排序为‘水晶粉七号’>‘鲜娇’>‘春红’>‘红楼’>‘凤舞’>‘粉美人’,‘水晶粉七号’抗性最强即为盐抗性品种,‘粉美人’抗性最弱为盐敏感品种。
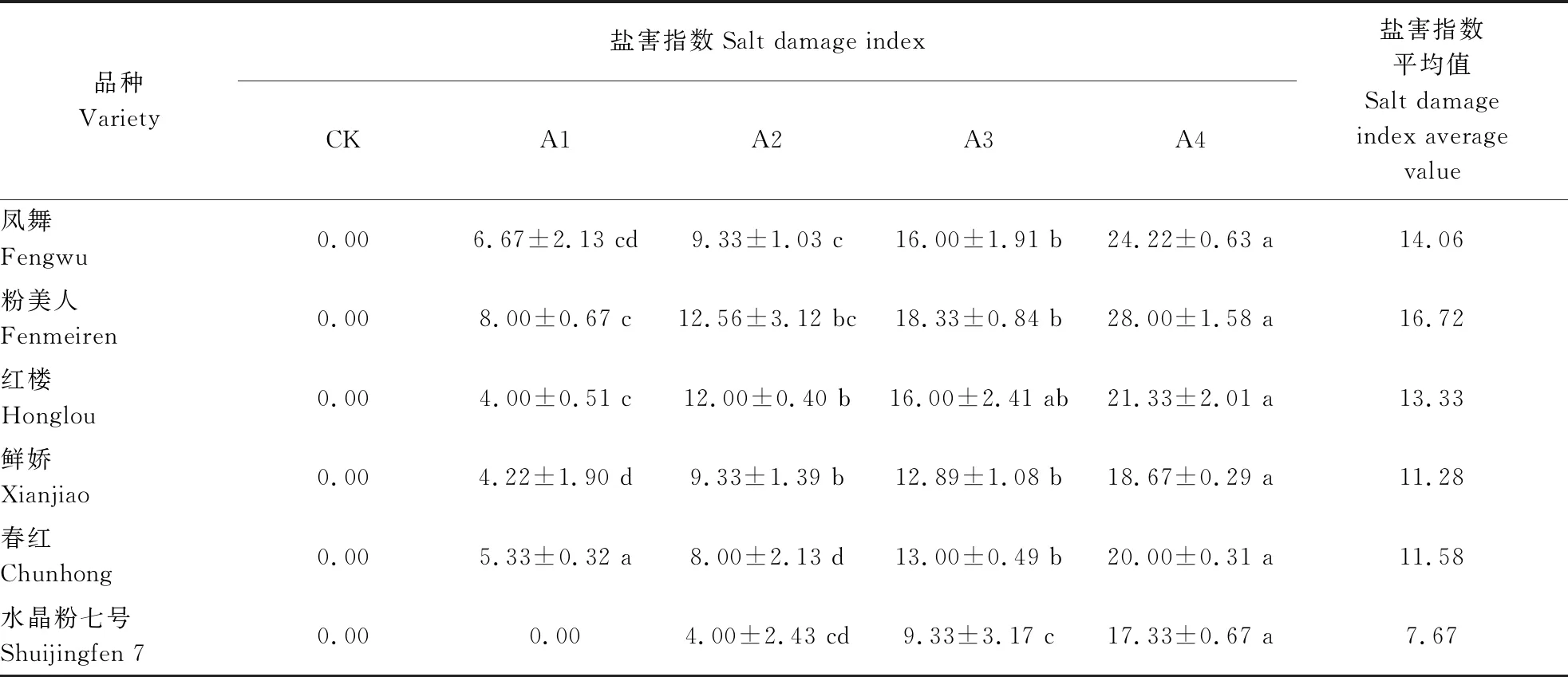
表4 NaCl胁迫下荷花的盐害指数Table 4 Salt damage index of lotus under NaCl stress %
2.2 外源钙对NaCl胁迫下荷花POD活性的影响
如图1所示,T1处理时,2种荷花叶片的POD活性均显著高于对照组T0。与T0和T1相比,不同浓度的外源CaCl2处理均能提高盐胁迫下荷花叶片的POD活性,其中以T3和T4处理下的POD活性最高。在T3处理下,7 d后敏感品种和抗性品种的POD活性与NaCl单独处理相比,达到了57.95和71.86 U·g-1,分别增加了25.47%和21.12%;在T4处理下,14 d后敏感品种‘粉美人’和抗性品种‘水晶粉七号’的POD活性较T1处理分别增加了24.89%和4.15%,这表明在15 mmol·L-1CaCl2处理下敏感品种‘粉美人’的POD活性较抗性品种‘水晶粉七号’的增幅较大。而T4与T5处理差异不显著,且均为T4处理优于T5。这说明高浓度的CaCl2处理可能不存在显著的抑制作用。

图1 外源CaCl2对盐胁迫下敏感品种和抗性品种7和14 d后POD的影响Fig.1 Effects of exogenous CaCl2 on POD in sensitive variety and tolerant variety under salt stress after 7 d and 14 d
2.3 外源钙对NaCl胁迫下荷花CAT活性的影响
图2为不同处理下荷花叶片CAT活性的变化趋势,抗性品种‘水晶粉七号’和敏感品种‘粉美人’在T1处理下其CAT活性显著增加,敏感品种的增幅较大。随着CaCl2浓度的升高,2种荷花的CAT活性也呈现出逐渐上升的趋势,而当CaCl2浓度达到10~15 mmol·L-1时,其CAT活性开始下降。敏感品种在T4处理下7 d后CAT活性为最大值,达到了10.75 U·g-1,比对照组T0增加了57.37%;在T3处理下,14 d后CAT活性为最大值,达到了10.22 U·g-1,比对照组T0增加了41.72%。抗性品种在T3处理下,7 d后CAT活性为最大值,达到了10.57 U·g-1,比对照组T0增加了22.81%;14 d后CAT活性为最大值,达到了10.96 U·g-1,比对照组T0增加了33.40%。这说明,一定浓度范围内CaCl2处理确实能够通过促进抗氧化酶的活性来缓解盐胁迫产生的危害。

图2 外源CaCl2对盐胁迫下敏感品种和抗性品种7和14 d后CAT的影响Fig.2 Effects of exogenous CaCl2 on CAT in sensitive variety and tolerant variety under salt stress after 7 d and 14 d
2.4 外源钙对NaCl胁迫下荷花SOD活性的影响
由图3可知,T1处理下7和14 d后,敏感品种荷花的SOD活性与对照组T0相比有显著升高,敏感品种‘粉美人’的SOD活性比对照组T0分别增加了5.07%和13.68%,这表明敏感品种‘粉美人’的SOD活性随着时间的延长其活性更大。抗性品种的SOD活性在T1处理下7和14 d后分别达到了278.37和294.35 U·g-1,比对照组T0分别增加了1.44%和2.79%,变化不大,但胁迫14 d后,敏感品种的SOD活性相较于对照组的增加量比抗性品种‘水晶粉七号’显著提高。在添加CaCl2处理后,两种荷花的SOD活性均有所升高,其中T3处理7和14 d后,敏感品种和抗性品种的SOD活性显著升高,比对照分别高13.76%和8.4%,说明10 mmol·L-1CaCl2处理对盐敏感品种‘粉美人’的效果更明显。
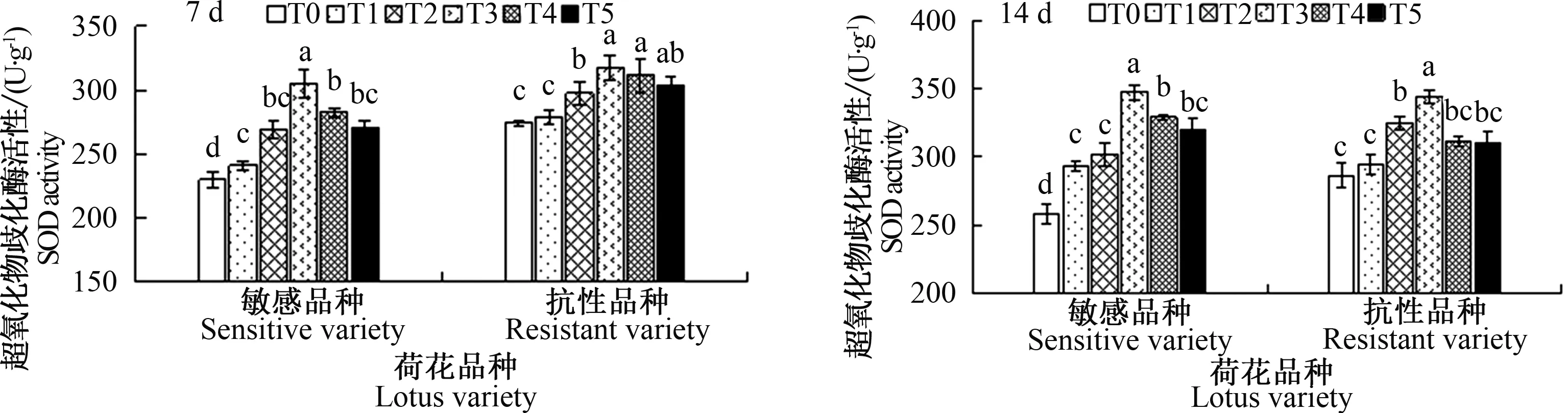
图3 外源CaCl2对盐胁迫下敏感品种和抗性品种7和14 d后SOD的影响
2.5 外源钙对NaCl胁迫下荷花可溶性糖含量的影响
由图4可以看出,与对照相比,盐胁迫7 d时敏感品种荷花叶片的可溶性糖含量显著增加,抗性品种T3处理下增加显著;14 d时敏感品种在T3处理后差异显著,但抗性品种各处理浓度间差异不显著。不同浓度的CaCl2处理后增加了盐胁迫下荷花叶片的可溶性糖含量,与仅在盐胁迫下有一定的差异,尤其以T3和T4处理较好,敏感品种‘粉美人’的可溶性糖含量T3处理7和14 d后分别比对照组增加11.20%和18.95%,抗性品种‘水晶粉七号’的可溶性糖含量T3处理7和14 d后分别比对照组增加29.78%和15.00%,这表明外源CaCl2可提高荷花叶片可溶性糖含量,有效地增加渗透调节物质的含量,对缓解盐胁迫对叶片的损伤有一定作用。
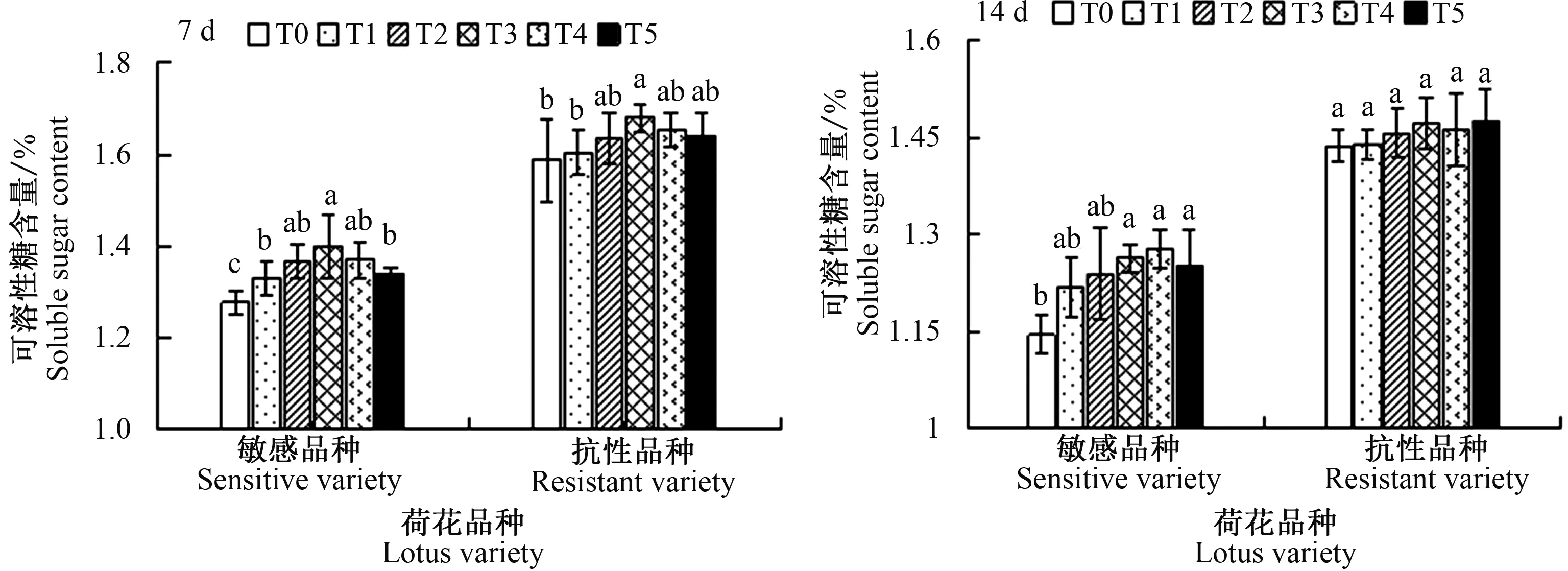
图4 外源CaCl2对盐胁迫下敏感品种和抗性品种7和14 d后可溶性糖含量的影响
2.6 外源钙对NaCl胁迫下荷花可溶性蛋白含量的影响
由图5可以看出,2个荷花品种的可溶性蛋白含量在盐胁迫下增加,并且通过CaCl2处理进一步提高,主要呈现先上升再缓慢下降的趋势。抗性品种‘水晶粉七号’叶片中的可溶性蛋白含量高于敏感品种‘粉美人’。不同浓度的CaCl2对可溶性蛋白含量的增加效果不同,T3处理下可溶性蛋白含量显著增加。7 d后,敏感品种‘粉美人’在T3处理下的可溶性蛋白含量达到了7.49 mg·g-1,比对照组T0增加了58.36%;抗性品种‘水晶粉七号’的可溶性蛋白含量达到了6.83 mg·g-1,比对照组T0增加了44.09%。14 d后,敏感品种‘粉美人’和抗性品种‘水晶粉七号’的可溶性蛋白含量分别比对照组增加了25.87%和21.35%,这表明外源CaCl2对盐胁迫下敏感品种‘粉美人’可溶性蛋白含量的增加起到一定的作用。

图5 外源CaCl2对盐胁迫下敏感品种和抗性品种7和14 d后可溶性蛋白含量的影响
2.7 外源钙缓解盐胁迫下荷花生长指标的相关性分析
由表5可知,对于盐敏感荷花品种‘粉美人’,不同水体CaCl2的浓度与POD活性呈极显著正相关(P<0.01),与CAT活性呈显著正相关(P<0.05),与抗氧化酶SOD、可溶性糖、可溶性蛋白的相关性不显著。在控制CaCl2浓度变量的偏相关分析中发现,POD活性与CAT活性呈显著正相关关系(P<0.01),可溶性蛋白含量与可溶性糖含量呈极显著正相关关系(P<0.05),SOD活性与可溶性蛋白含量、可溶性糖含量均呈显著正相关关系(P<0.01)。试验结果表明,随着外源钙浓度的增加,细胞中的POD活性、CAT活性均呈上升趋势,两者相辅相成,共同抵御植物在盐胁迫下受到的损伤。同时,可溶性糖与可溶性蛋白含量也在不断的增加,共同维持细胞正常渗透压。这也印证了添加外源钙确实对盐胁迫下的植物有一定的缓解作用。
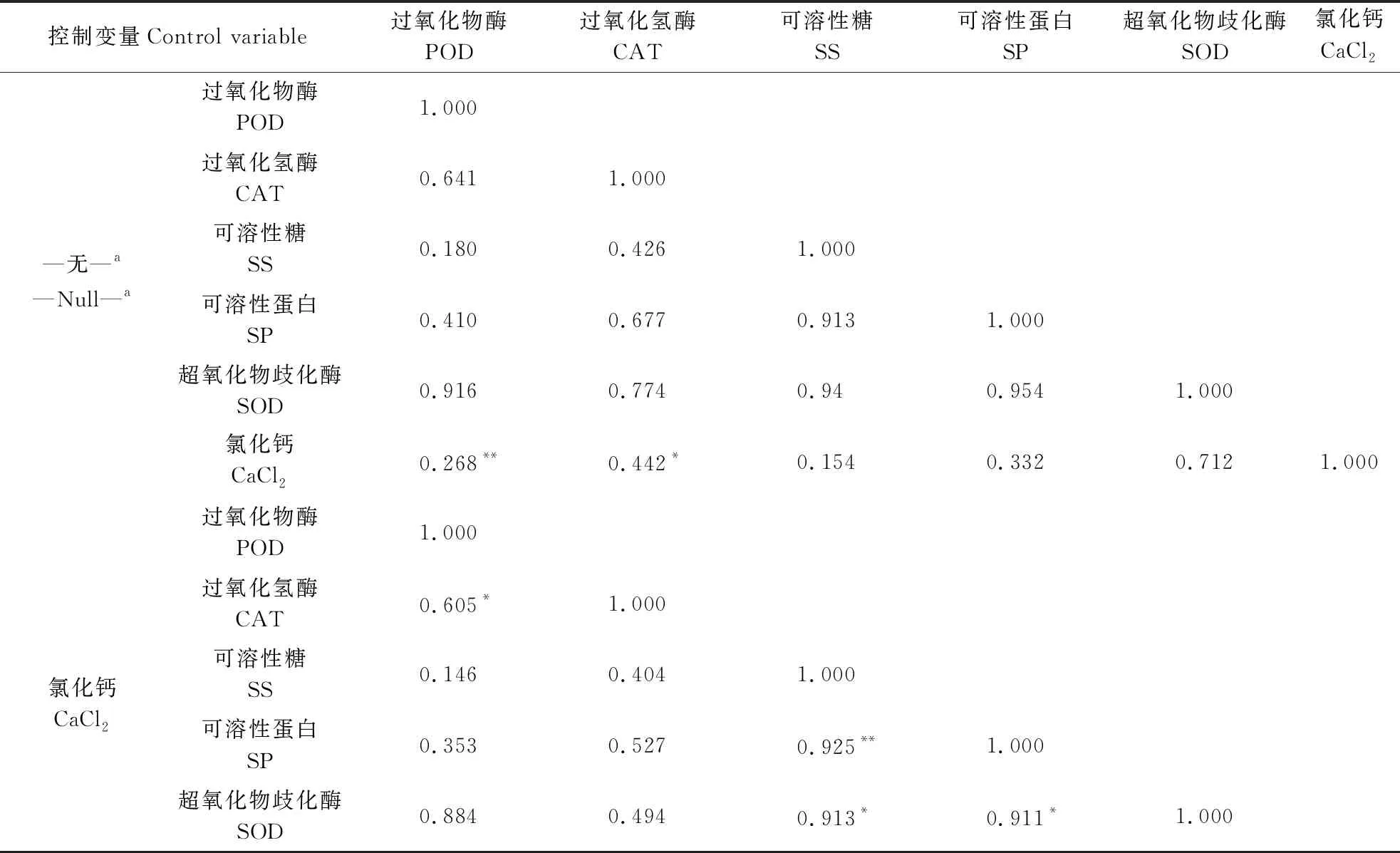
表5 盐敏感荷花品种‘粉美人’生理指标的相关性
由表6可知,对于盐抗性荷花品种‘水晶粉七号’,不同水体CaCl2的浓度与POD活性、CAT活性均呈显著正相关关系(P<0.05),与其他生理指标相关性不显著。另外,在控制钙浓度变量的偏相关分析中发现,POD活性与CAT活性、SOD 活性呈极显著正相关关系(P<0.01),其他生理指标之间相关性不显著;SOD 活性与可溶性蛋白含量呈极显著正相关关系(P<0.05)。试验结果表明,随着外源钙浓度的增加,细胞中的CAT活性、POD活性也均呈上升趋势,清除活性氧等有害物质,共同抵御植物在盐胁迫下受到的损伤。可见CAT、POD是外源钙对盐抗性荷花品种抵抗盐胁迫逆境的重要响应指标。
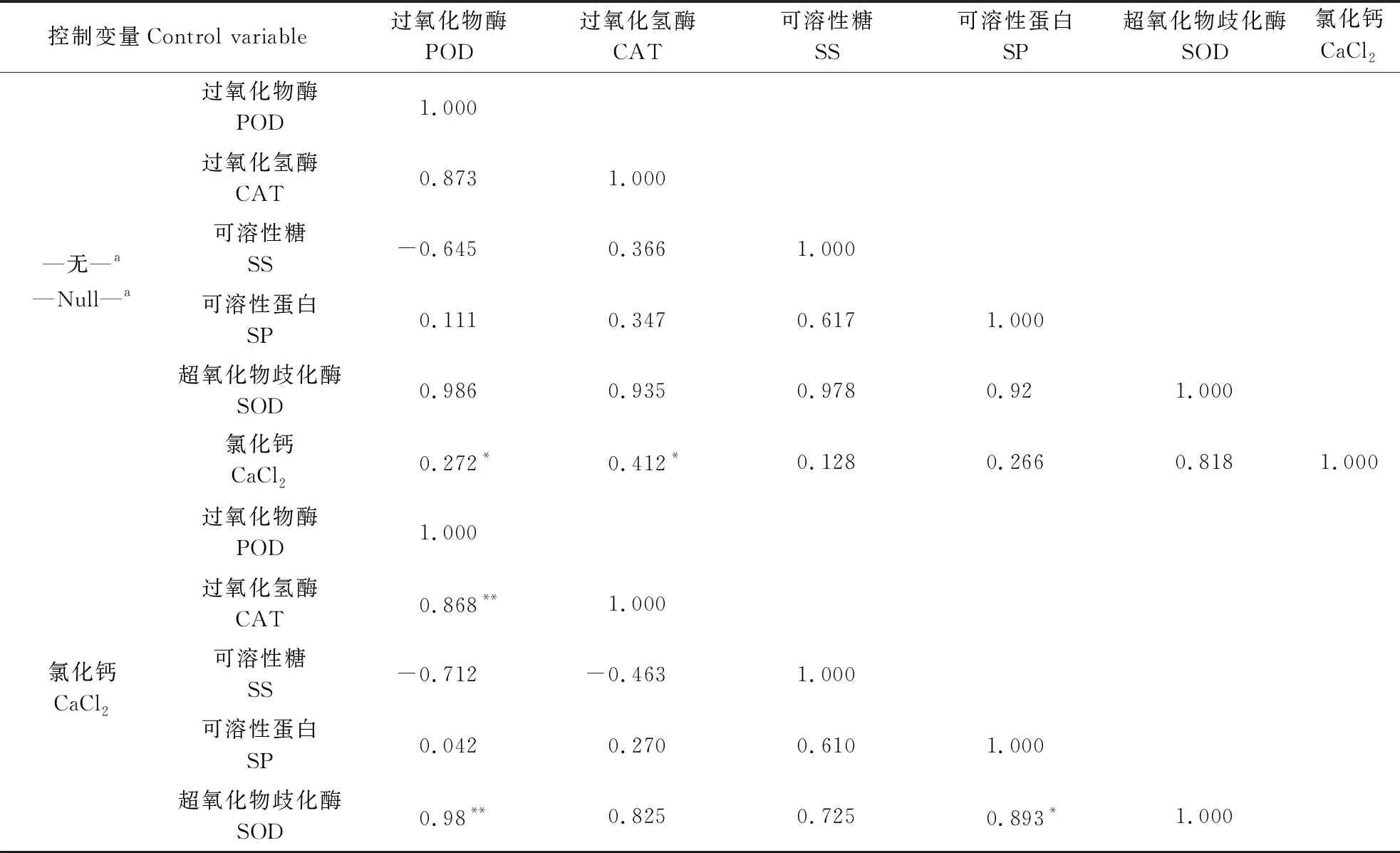
表6 盐抗性荷花品种‘水晶粉七号’生理指标的相关性Table 6 Correlation of physiological indexes of salt-resistant lotus variety ‘Shuijingfen 7’
3 讨论与结论
盐分对非盐生植物最重要的表现就是植物的生长受到抑制[20]。细胞内钙的平衡失调是植物盐胁迫的原始反应[21],外源Ca2+能够重建植株体内离子平衡, 因而施加外源钙是缓解盐胁迫对植物造成伤害的重要途径[22]。本试验表明,NaCl浓度从0升高至100 mmol·L-1时,所有荷花品种的净高生长量均呈现缓慢下降的趋势;其中150和200 mmol·L-1NaCl处理对荷花的危害较大,荷花净高生长量最小(1.3~6.9 cm)。添加浓度为10 mmol·L-1的CaCl2时,荷花抗氧化酶活性和渗透调节物质含量均显著提高,增强了植株对逆境的适应能力。
植物细胞中存在着自由基的产生和消除过程,当其受到盐胁迫时,会造成植株体内活性氧(ROS)大量积累[23]。ROS包括超氧阴离子(O2-)、羟自由基(-OH)等含氧自由基,也包括过氧化氢(H2O2))、单线态氧(1O2)等非自由基形式的含氧分子。当生物自由基处于一个较低的水平,才能消除自由基的毒害。过氧化氢酶、过氧化物酶和超氧化物歧化酶协同作用影响着植物体内自由基的含量,有效减少其对植物细胞膜系统的伤害[24-25]。以往的研究结果表明,外源Ca2+处理可以在一定时间保持植物根系抗氧化酶的活性,及时清除产生的活性氧[26]。或添加适量的外源Ca2+能在一定程度上减轻盐胁迫对植物生长的抑制作用,增加抗氧化酶活性,并使其保持在较高的水平,缓解盐胁迫对植物生长造成的伤害[27]。抗氧化酶活性测定表明,抗性品种‘水晶粉七号’的SOD和CAT活性较敏感品种‘粉美人’相对较高,导致O2-积累较少。李淑艳等[15]研究添加外源钙对盐胁迫下盐敏感荷花品种影响,发现低浓度的Ca2+可以显著提高SOD活性,本研究与此结论相一致。SOD是最有效的细胞内的抗氧化酶,它能够将O2-转化为H2O2,而CAT是含有四聚体血红素的酶,具有直接将H2O2分解成H2O和O2的潜力。这一结果符合在其他植物物种中获得的结果,即盐胁迫提高抗氧化酶活性和促进活性氧的产生[28-29]。
植物提高其耐盐性的重要途径之一是渗透调节,可溶性糖和可溶性蛋白是植物体内重要的渗透调节物质[30]。可溶性糖可提供碳骨架和能量,参与有机物的合成,维持细胞膜的稳定[31]。本试验中,盐抗性品种‘水晶粉七号’的可溶性糖含量明显升高,同豌豆[32]和油菜[33]的研究结论相一致。印荔[16]研究藕莲对盐胁迫响应,发现添加外源钙后可溶性蛋白含量显著提高,与本研究结论不同。本试验中胁迫7 d后,可溶性蛋白含量呈现先升后降的趋势,胁迫14 d后的可溶性蛋白含量均低于胁迫7 d时,这可能是因为盐胁迫使植株体内蛋白质合成受阻,且蛋白酶活性增强,从而加快其水解速度造成的[34]。
通过相关性分析,2种荷花不同Ca2+浓度与POD、CAT酶活性均呈显著正相关关系,说明随着Ca2+浓度的不断增大,荷花植株叶中的POD和CAT酶活性也不断增加,以抵抗盐胁迫伤害。表明添加外源Ca2+对盐胁迫下的荷花具有明显的缓解效应。这与黄瓜幼苗[6]和水稻幼苗[7]在添加外源Ca2+缓解盐胁迫的响应相一致。
综上所述,100 mmol·L-1的NaCl胁迫阻碍了荷花植株的正常生理和生化活动。添加适宜浓度的外源Ca2+有效地缓解了盐胁迫对植株的伤害,维持植株生理和生化代谢稳定,增强荷花植株的耐盐能力。

