基于纳米银制备重金属离子电化学传感器
周 亚
(晋中职业技术学院,山西 晋中 030600)
1 实验原理
纳米银制备原理:三电极体系中的工作电极释放电子,AgNO3溶液中的Ag+获得电子还原为银原子,吸附在工作电极表面,最终得到纳米银[1]。
传感器检测原理:采用三电极体系(见表1),通过阳极溶出伏安法(SWASV)对Cu(Ⅱ)和Pb(Ⅱ)进行检测。首先在-1V的电位下,对Cu(Ⅱ)和Pb(Ⅱ)进行富集180 s,然后再施加反向电位,使Cu(Ⅱ)和Pb(Ⅱ)重新回归到溶液中,Cu(Ⅱ)和Pb(Ⅱ)在对应电位产生氧化电流,形成氧化电流峰,其氧化电流峰值与Cu(Ⅱ)和Pb(Ⅱ)的浓度成正比[2-3]。

表1 三电极体系
2 实验仪器、试剂及溶液配制(见表2~表4)

表2 实验仪器
表3 实验试剂

表4 溶液配制
3 实验过程
3.1 制备纳米银
采用三电极体系,在0.2 mol·L-1的硝酸银溶液中制备纳米银,沉积电压设置为-1.5 V,时间设置为200 s。
3.2 电化学性能表征
在0.1 mol·L-1的铁氰化钾溶液中进行CV和EIS测试,以表征修饰后玻碳电极的电化学特性。在第15页图1a)中,裸电极和修饰后电极的氧化电流峰值分别约为93.4 μA和153.2 μA,修饰后电极的氧化还原峰值更高,表明修饰后电极表面的电子转移速率更快。第15页图1b)为EIS测试结果。在图1b)中,裸电极和修饰后电极的电子转移电阻值分别约为92.5 Ω和81.2 Ω,实验结果表明纳米银修饰的工作电极表面的电子转移速率更快,EIS结果与CV结果一致。
3.3 重金属离子检测
在0.1 mol·L-1醋酸-醋酸钠缓冲液中,采用三电极体系,利用电化学工作站中的SWASV法对Pb(Ⅱ)和Cu(Ⅱ)进行检测,离子浓度范围从0.01 μmol至0.06 μmol。在实验结果图2a)中,Pb(Ⅱ)和Cu(Ⅱ)氧化溶出峰的出现分别在-0.5 V和0 V附近,随着两种离子浓度的增加,对应的检测电流峰值也增加。将两种离子的检测浓度与检测电流进行线性拟合,最终得到线性关系方程为I(μA)=0.13+88.49c(μmol·L-1)和I(μA)=0.48+79.96c(μmol·L-1)。Pb(Ⅱ)和Cu(Ⅱ)的灵敏度分别为88.49 μA·μM-1和79.96 μA·μM-1,检测限分别为0.13 μmol·L-1和0.21 μmol·L-1。
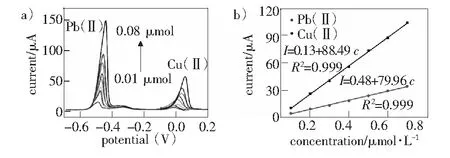
图2 a)重金属离子检测 b)对应 a)的线性关系图
3.4 传感器稳定性测试
重金属离子电化学传感器进一步进行稳定性检测。每隔两天对0.03 μmol的Cu(Ⅱ)离子进行检测,进行了5次平行实验,实验结果总结至表5,可看出,Cu(Ⅱ)检测电流基本保持不变。实验结果表明,该电化学传感器具有很好的稳定性。
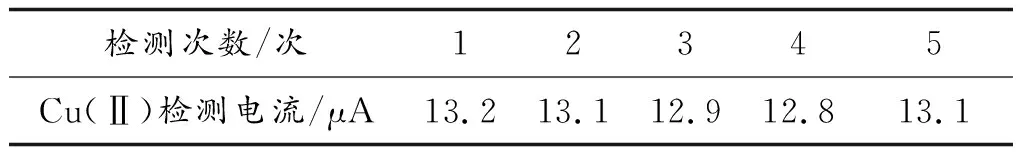
表5 平行实验
4 结论
通过沉积法成功制备出纳米银,将其应用于重金属离子电化学传感器,实现了对Pb(Ⅱ)和Cu(Ⅱ)两种离子的同时检测。该重金属离子电化学传感器对Pb(Ⅱ)和Cu(Ⅱ)的检测限分别为0.13 μmol·L-1和0.21 μmol·L-1。实验结果表明,纳米银制备重金属离子电化学传感器有一定的应用前景。

