大鼠阴道炎模型的建立与评价
彭冬冬,董珂,厉巧,周志敏,肖洒,姜德建
(湖南省药物安全评价研究中心,新药药效与安全性评价湖南省重点实验室,长沙 410331)
阴道炎是目前妇科门诊中常见疾病,是引导粘膜及粘膜下结缔组织发生的炎症,其主要包括细菌性阴道炎、霉菌性阴道炎、滴虫性阴道炎以及细菌和真菌混合性阴道炎。 临床上阴道炎病例大多是由多种菌(包括细菌和真菌) 混合感染所致,以阴道黏膜易充血、肿胀,有颗粒状脓疱和小出血点等为主要临床表现。 根据病原学流行病学调查结果显示,亚洲妇女阴道炎发病率如下:阴道毛滴虫2% ~5%,念珠菌属 3% ~ 14%,细菌性阴道病 0% ~16%,细菌和真菌混合感染50%以上,混合性阴道炎占比逐年上升[1]。 混合性阴道炎不仅会影响女性患者的生活质量,而且会导致女性不孕症,故此类动物模型建立对该病的治疗和发病机制研究具有重要意义。 因此,本研究采用SD 大鼠通过混合菌(加德纳菌GV10-1 菌,白色念珠菌,B 族链球菌悬液)诱导建立混合性阴道炎模型,并对其临床表现和病理生理改变进行观察,为混合性阴道炎的药物开发和评价提供新模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级约7 周龄雌性 SD 大鼠30 只,体重210 g,购于湖南斯莱克景达实验动物有限公司【SCXK(湘)2019-0004】;饲养于湖南省药物安全评价研究中心 ABSL-II 生物安全实验室 IVC 系统【SYXK(湘)2015-0016】。 饲养期间各组大鼠自由饮水,饲喂SPF 鼠料(Co60消毒)由北京科澳协力饲料有限公司【SCXK(京)2019-0003】提供。 饲养环境:昼夜各半循环照明,温度20.9 ~25.9℃,湿度42.5% ~64%。 动物实验均按照湖南省药物安全评价研究中心动物伦理与福利委员会的指导方针和批准进行(审批号:IACUC-2019(3)051)。
1.1.2 受试物
复方甲硝唑阴道栓,组份为:甲硝唑0.45 g、四环素50 mg、制霉菌素30 mg。 规格:每粒3 g,批号:09191001,失效日期:2021.09。 主要适应症:用于治疗滴虫性阴道炎、霉菌性阴道炎、细菌性阴道炎和老年性阴道炎、非特异性阴道炎及支原体感染、淋病双球菌感染等病症。 生产单位:河北金牛原大药业科技有限公司。
1.1.3 试剂与仪器
苯甲酸雌二醇注射液,批号:20180101,规格:2 mL:4 mg,10 支/盒,失效日期:2020.01.05,生产厂家:四川金科药业有限责任公司;注射用硫酸链霉素,批号:17053101,规格:1 g(100 万单位)/瓶,失效日期:2020.04,生产厂家:瑞阳制药有限公司。 革兰氏染色液试剂盒,货号:HB8278,批号:20190511,生产单位:青岛海博生物技术有限公司。
DFC 420C 型病理成像系统(德国 Leica);DM2500 型荧光显微镜(德国Leica);3111 型二氧化碳培养箱(美国Thermo);SPL-250 型生化培养箱(天津市莱伯特瑞);TP1020 型全自动脱水机(德国Leica);EG1150H+C 型组织包埋机(德国 Leica);RM2235 型石蜡切片机(德国 Leica)、CX31 型生物显微镜(日本奥林巴斯公司);CV5030+HV 型全自动封染一体机(德国Leica);BX43+MD50 型生物显微镜+数码成像系统(日本奥林巴斯公司)。
1.1.4 试验菌株
阴道加德纳氏菌(BNCC 337545)和白色念珠菌(17015177)由杭州先端生物科技有限公司提供,B族链球菌(ATCC 12386)由北纳创联生物科技有限公司提供,均来源于阴道炎患者的白带样本。 所有菌株均在本中心进行培养及传代,并扩增至108CFU/mL 以上。
1.2 方法[2-8]
1.2.1 菌株的复苏、传代/纯化
阴道加德纳氏菌:取阴道加德纳氏菌甘油冻存液,于37℃水浴中轻轻摇晃,加速解冻,用一次性无菌接种环划线接种于哥伦比亚血平板(成品,购于广东环凯微生物科技有限公司)上复苏,(36 ± 1)℃厌氧培养48 h,形成灰白色、半透明、光滑、针尖样大小的菌落。 用一次性无菌接种环于一生长良好的阴道加德纳氏菌的哥伦比亚血平板上挑取单个菌落,采用划线法转接于另一无菌哥伦比亚血平板上,(36 ± 1)℃培养48 h,2 ~ 8℃暂存,备用。
B 族链球菌:取 B 族链球菌甘油冻存液,于37℃水浴中轻轻摇晃,加速解冻,用一次性无菌接种环划线接种于血平板(成品,购于广东环凯微生物科技有限公司)上复苏,(36 ± 1)℃培养24 h 后,形成灰白色、表面光滑、圆形、β 溶血的菌落,部分菌株无明显β 溶血环。 用一次性无菌接种环于一生长良好的B 族链球菌的血平板上挑取单个菌落,采用划线法转接于另一无菌血平板上,(36 ± 1)℃培养24 h,2 ~ 8℃暂存,备用。
白色念珠菌:取白色念珠菌甘油冻存液,于37℃水浴中轻轻摇晃,加速解冻,用一次性无菌接种环划线接种于沙氏葡萄糖琼脂(成品,购于广东环凯微生物科技有限公司。 121℃,30 min 高温高压灭菌,待冷却至50℃左右,注入20 ~25 mL 于90 mm无菌培养皿中,待凝固后方可使用)平板上复苏,25~28℃培养48 h 后,生成灰白乳酪样菌落。 用一次性无菌接种环于一生长良好的白色念珠菌的沙氏葡萄糖琼脂平板上挑取单个菌落,采用划线法转接于另一无菌沙氏葡萄糖琼脂平板上,25 ~28℃培养48 h,2 ~ 8℃暂存,备用。
1.2.2 形态观察及革兰氏染色观察
光学显微镜下观察阴道灌洗液菌株形态和数量等。 用接种环挑取1 环蒸馏水至洁净载玻片上,挑取1 个单菌落,与蒸馏水混合均匀;涂布经火焰固定,加结晶紫溶液和碘液,各染1 min 水洗,脱色液,不时摇动载玻片约10 ~30 s,至无紫色脱落为止水洗,再加复染色染1 min 水洗。 干后油镜观察菌株形态。
1.2.3 大鼠混合性阴道炎模型建立
30 只大鼠分别于给药前第1 ~3 天每只皮下注射0.5 mg 的苯甲酸雌二醇注射液(每日上午进行),其中20 只模型大鼠阴道内注入链霉素每只每次50 μg(上午进行),然后向阴道内注入混合菌(加德纳菌GV10-1 菌,白色念珠菌,B 族链球菌悬液)(1 × 108CFU/mL)每只每次 50 μL(下午进行),每天1 次,连续3 d,复制混合性阴道炎模型,空白组大鼠阴道接种 50 μL 不含菌株的半固体培养基。 模型组和空白组大鼠分别于分组前向大鼠阴道内注入50 μL 无菌 PBS,移液枪轻轻吹打5 次后吸出冲洗液(约250 μL),取50 μL 用于显微镜下观察是否存在阴道混合菌感染。 选取感染成功20 只大鼠按体重和菌株负荷量随机分为模型组和药物验证组(复方甲硝唑阴道栓每只54 mg,每天1 次,连续5 d),每组10 只动物。 正常组和模型组大鼠经阴道给予等量的0.9%氯化钠注射液。
1.2.4 观察指标
(1)分别于分组前及给药第5 天后用棉签蘸取SD 大鼠外阴或阴道分泌物,涂于病理载玻片上,酒精固定,常规瑞氏染色和革兰氏染色镜检,并在显微镜(× 200 倍)下观察菌体和线索细胞情况。 治愈(转阴):显微镜下观察不到菌丝和(或)芽孢(或)线索细胞;未愈:显微镜下观察可见菌丝和(或)芽孢(或)线索细胞。 计算转阴率(转阴率=治愈例数/动物总例数)(2)分别于分组前及给药第5 天后取大鼠阴道分泌物进行清洁度检查。 阴道清洁度评分标准:I 度:镜下以阴道杆菌为主,并可见大量上皮细胞,计为1 分;II 度:有部分阴道杆菌,上皮细胞亦可见,也有部分脓细胞和杂菌,计为2 分;III度:只见少量阴道杆菌和上皮细胞,但有大量的脓细胞和其他杂菌,计为3 分;IV 度:镜下无阴道杆菌,几乎全是脓细胞和大量杂菌,计为4 分。 (3)于末次给药后处死大鼠,取出、吸干表面液体后称量阴道重量,计算阴道指数(阴道指数=阴道重量/动物体重),同时测量阴道pH。 (4)收集分组前、治疗5 d 的阴道灌洗液,按照梯度稀释后进行培养,计数100 μL 灌洗液中的菌落数。 (5)取阴道组织置于10%中性福尔马林溶液中固定,石蜡包埋、切片、HE 染色进行组织病理学观察。 根据充血、水肿、出血、浸润4 项指标进行评分,具体评分标准:黏膜上皮光滑,无坏死脱落,黏膜下无充血、水肿、出血、炎细胞浸润,阴道内无炎性渗出物,计为0 分;黏膜上皮无坏死脱落,黏膜下充血,阴道内无炎性渗出物,计为1 分;黏膜上皮有灶性坏死脱落,黏膜下充血、水肿,无炎细胞浸润,计为2 分;黏膜上皮有灶性坏死脱落,黏膜下充血、水肿、点状出血、少量炎细胞浸润,计为3 分;黏膜上皮坏死脱落,黏膜下充血、水肿、点状出血、炎细胞浸润,阴道内有大量炎性渗出物,计为4 分。 记录炎症分值并统计。
1.3 统计学分析
采用SPSS 16.0 进行数据统计,计量资料采用平均值± 标准差( ¯x ± s)表示。 Leven’s test 方法检验方差齐性,单因素方差分析(One-Way ANOVA)进行统计分析,LSD test(参数法)进行两两比较分析。 计数资料以百分率表示,采用χ2检验或Fisher确切概率法,以P <0.05 为差异有统计学意义。
2 实验结果
2.1 阴道分泌物涂片转阴率
如图1 和图2 所示,正常组10/10 例动物阴道涂片未染色和染色镜检可见少量卵圆形白色念珠菌,但均未见菌丝和线索细胞,感染率为0;模型组9/10 例动物阴道涂片未染色和染色镜检可见大量菌丝和球状的线索细胞,感染率90%;复方甲硝唑阴道栓组9/10 例动物阴道涂片未染色和染色镜检未见菌丝和线索细胞,1/10 例动物阴道涂片未染色和染色镜检可见菌丝,但不未见线索细胞,治愈率90%。
2.2 阴道灌洗液混合菌计数
如图3 及图4 所示,革兰氏染色镜检,阴道加德纳氏菌染色镜检,呈革兰阴性细小杆菌,常呈球杆状;B 族链球菌呈革兰阳性球菌,单个、成双或链状排列、长短不一;白色念珠菌表层卵圆形芽生细胞,革兰染色呈阳性。 如表1 所示,与正常组比较,给药第5 天后模型组阴道灌洗液混合菌计数显著增加(P <0.01);与模型组比较,给药第5 天后复方甲硝唑阴道栓组阴道灌洗液混合菌计数显著降低(P <0.01)。

图1 阴道涂片(× 40,标尺 = 50 μm)Figure 1 Vaginal smear(× 40,Bar = 50 μm)
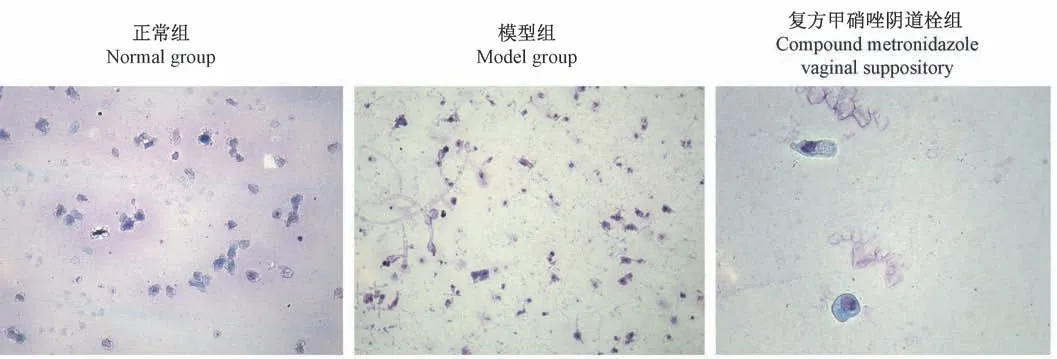
图 2 阴道涂片(Wright’s staining,× 10,标尺 = 100 μm)Figure 2 Vaginal smear (Wright’s staining, × 10,Bar = 100 μm)

图3 接种前菌株培养镜检(革兰氏染色, × 100,标尺 = 100 μm)Figure 3 Microscopic examination of strain culture before inoculation (Gram’s staining, × 100, Bar = 100 μm)

注:A: 革兰氏染色(阴道加德纳氏菌;B 族链球菌);B:阴道涂片(白色念珠菌)。图4 阴道灌洗液镜检(× 40,标尺 = 50 μm)Note. A, Gram staining (gardnerella vaginalis; group B streptococcus). B, Vaginal smear (candida albicans).Figure 4 Transvaginal lavage(× 40,Bar = 50 μm)

表1 混合性阴道炎对大鼠阴道灌洗液菌落数的影响( ¯x ±s,n = 10)Table 1 Effects of mixed vaginitis on colony count of vaginal lavage in rats ( ¯x ±s,n =10)
2.3 阴道清洁度检查
正常组动物阴道涂片有部分阴道杆菌,同时可见大量的上皮细胞,清洁度为II 度,评分为2.0 ±0.0;模型组动物阴道涂片仅少见上皮细胞,无阴道杆菌,可见大量的杂菌,清洁度为III ~IV 度,评分为3.7 ± 1.2;复方甲硝唑阴道栓组动物阴道涂片仅少量的阴道杆菌,可见部分的上皮细胞,清洁度为II~ IIII 度,评分为 2.3 ± 0.2。 提示模型组动物连续接种混合菌3 d,致病菌经5 d 在大鼠阴道体内不断繁殖,优势菌逐渐减少,清洁度明显增加(P <0.05);经阴道给予复方甲硝唑阴道栓治疗5 d 后,清洁度较模型组明显降低(P <0.05)。
2.4 阴道pH
给药前各组动物阴道分泌物经0.1 级pH 试纸检测,正常组、模型组及复方甲硝唑阴道栓组阴道分泌物 pH 值分别为 4.1 ± 0.9、4.0 ± 1.2、3.9 ±1.4;给药第5 天,正常组、模型组及复方甲硝唑阴道栓组阴道分泌物 pH 值分别为 4.2 ± 1.1、7.7 ±2.1、4.5 ± 0.6。 提示模型组动物连续接种混合菌3 d,致病菌经5 d 在大鼠阴道体内不断繁殖,优势菌逐渐减少,pH 值明显增加(P <0.01);经阴道给予复方甲硝唑阴道栓治疗5 d 后,动物阴道pH 值与给药前变化不大,与同期模型组比较,pH 值明显降低(P < 0.01)。
2.5 阴道组织指数
正常组、模型组及复方甲硝唑阴道栓组阴道体质量分别为 1.02 ± 0.23、0.98 ± 0.45 及 1.13 ±0.17,模型组大鼠阴道指数与正常组比较,差异不具有显著性;混合性阴道炎大鼠经复方甲硝唑阴道栓治疗5 d 后,复方甲硝唑阴道栓组阴道指数与模型组比较,差异不具有显著性。
2.6 阴道组织病理检查
2.6.1 一般镜下观察
如图5 所示,正常组:阴道黏膜上皮细胞未见坏死,固有层为致密结缔组织,未见充血水肿及炎细胞浸润。 模型组:阴道壁变厚,上皮细胞坏死,固有层出现充血和水肿,以中性粒细胞为主,淋巴细胞和单核细胞炎细胞浸润,纤维细胞增生明显。 复方甲硝唑阴道栓组阴道分泌物减少,镜下观察上皮连续性好,少见浅表糜烂,炎症细胞浸润减少。
2.6.2 阴道组织病变评分
正常组阴道组织未见炎症细胞浸润或水肿及充血,病变评分为0.0 ± 0.0;模型组阴道组织可见大量的炎症细胞浸润,同时伴有炎性渗出物,病变评分为3.5 ± 0.4;复方甲硝唑阴道栓组阴道组织可见充血,但未见水肿和炎症细胞浸润,病变评分为1.0 ± 0.1。 结果显示模型组动物连续接种混合菌3 d,大鼠阴道组织病变程度加重(P <0.01);经阴道给予复方甲硝唑阴道栓治疗5 d 后,动物阴道组织病变程度有所减轻(P <0.01)。 提示复方甲硝唑阴道栓能显著改善混合性阴道炎大鼠阴道组织病变程度。
3 讨论
混合性阴道炎是指阴道受多种病菌(如霉菌、细菌、滴虫等)、原虫感染而引起的炎症性病变,也就是阴道菌群失调的局部表现。 临床实践上多数是混合感染,如真菌感染多继发于细菌感染或治疗之后。 临床上妇科诊断主要通过阴道分泌物培养、清洁度、pH 以及胺臭味试验检查,筛选出可能性疾病。 阴道炎治疗原则主要是消除诱因,根据患者情况选择局部或全身应用抗真菌药物,应将抗真菌药与抗细菌药联合应用。 但这些药物在杀死致病菌的同时,也杀死了起自洁作用的乳杆菌,所以只能取得暂时缓解,由于失去优势乳杆菌的保护,新一轮感染很快出现,导致迁延反复。 由此可见,阴道炎方面疾病对人类健康的危害依然严重,其治疗任务依然艰巨,因此建立符合临床阴道炎表现的模型对阴道炎的治疗都有着重要的意义。 目前文献报道的模型有细菌性、真菌性、滴虫性和衣原体性阴道炎模型,其中真菌性阴道炎模型研究较多,而真菌和细菌混合感染模型报道甚少,因此本研究主要通过大鼠经皮下注射给予苯甲酸雌二醇,建立假动情期,同时经阴道给予注射用硫酸链霉素处理,能够破坏正常大鼠的阴道菌群, 再注入致病性混合菌(加德纳菌GV10-1 菌,白色念珠菌,B 族链球菌悬液)更容易定植到大鼠阴道内,有利于混合菌的生长和繁殖,从而复制混合性阴道炎模型。

图5 SD 大鼠阴道组织病理切片(× 100,HE 染色)Figure 5 Vaginal histopathological sections of SD rats (× 100, HE staining)
研究显示,混合性阴道炎模型组大鼠给药第5天混合感染率为90%,致病性菌落数显著增加,阴道分泌物涂片转阴率显著减少,清洁度评分显著增加,同时阴道pH 显著增加,其异常症状与临床上阴道炎的临床表现相似。 显微镜下观察到阴道壁变厚,上皮细胞坏死,固有层出现充血和水肿,以中性粒细胞为主,淋巴细胞和单核细胞炎细胞浸润,纤维细胞增生明显,其病理改变与临床基本一致。 复方甲硝唑阴道栓含有甲硝唑、制霉菌素、四环素等多种成分,可以同时杀死细菌、霉菌和滴虫,用于治疗滴虫性阴道炎、细菌性阴道炎和霉菌性阴道炎等多种类型的阴道炎。 甲硝唑的抗菌谱包括消化链球菌、韦荣球菌、梭形杆菌、真杆菌等,其中甲硝唑的硝基在特定条件下还原成一种细胞毒性物质,并参与细菌的基因代谢过程致细菌的死亡[9-11]。 制霉菌素栓剂是一种多烯型抗真菌药物,对念珠菌属的抗菌活性高,可与真菌细胞膜上甾醇结合,改变细胞膜通透性进而发挥抗菌功能[12]。 故本次研究选用复方甲硝唑阴道栓作为混合性阴道炎模型的阳性药进行验证,结果显示复方甲硝唑阴道栓能显著减轻阴道黏膜的炎症浸润,显著减少阴道分泌物和阴道灌洗液的致病菌群数目,同时降低阴道pH 值和清洁度评分。
综上所述,对大鼠进行雌激素和注射用硫酸链霉素预处理后,接种混合菌可成功建立大鼠混合性阴道炎模型,为女性生殖系统的药物筛选与评价提供有效的动物模型。